Doporučení ČNS a ČSKB ČLS JEP k diagnostice chronického onemocnění ledvin (odhad glomerulární filtrace a vyšetřování proteinurie)
Obsah
1. Definice a klasifikace chronického onemocnění ledvin
1.1 Vyšetření u nemocných s chronickým onemocněním ledvin
2. Vyšetření glomerulární filtrace
2.1 Úvod
2.2 Metody vyšetření glomerulární filtrace
2.2.1 Metody určení GF bez sběru moči
2.2 Metody měření GF se sběrem moči
2.2.3 Závěr
3. Vyšetření proteinurie
3.1 Úvod
3.2 Fyziologie vylučování bílkovin do moči
3.3 Klasifikace zvýšeného vylučování bílkovin do moči
3.4 Analytika a výsledky stanovení proteinů v moči
3.4.1 Základní pravidla
3.4.2 Stanovení albuminu a ACR
3.4.3 Stanovení celkových proteinů a PCR
3.4.4 Semikvantitativní stanovení albuminu a celkových proteinů testovacími proužky
3.4.5 Vyšetření dalších proteinů v moči
1. Definice a klasifikace chronického onemocnění ledvin
Definice
Chronické onemocnění ledvin (CKD) je definováno jako funkční nebo strukturální abnormalita ledvin, která trvá déle než tři měsíce a má dopad na zdraví nositele. Kritéria pro CKD (kterékoliv z následujících přítomné déle než tři měsíce):
- přítomnost poškození ledvin nebo
- pokles funkce ledvin (pod 1,0 ml/s/1,73 m2).
Ukazateli poškození ledvin jsou:
- albuminurie: ≥ 30 mg/24 h nebo poměr albumin/kreatinin ≥ 3,0 g/mol (fyziologická albuminurie je < 1,0 g/mol kreatininu), u dětí jsou hodnoty normální albuminurie závislé na věku,
- nález v močovém sedimentu (např. erytrocytární válce, leukocytární válce, granulované válce),
- nález ukazující na renální tubulární poruchy = elektrolytové a jiné poruchy vnitřního prostředí způsobené tubulárními poruchami (např. renální tubulární acidóza, renální tubulární proteinurie),
- histologický nález při biopsii,
- nález zjištěný zobrazovacími metodami (např. polycystické ledviny, hydronefróza způsobená obstrukcí),
- anamnéza transplantace ledvin.
Klasifikace (staging)
Pacient s CKD by měl být klasifikován podle:
- příčiny (např. diabetické CKD, CKD způsobené amyloidózou),
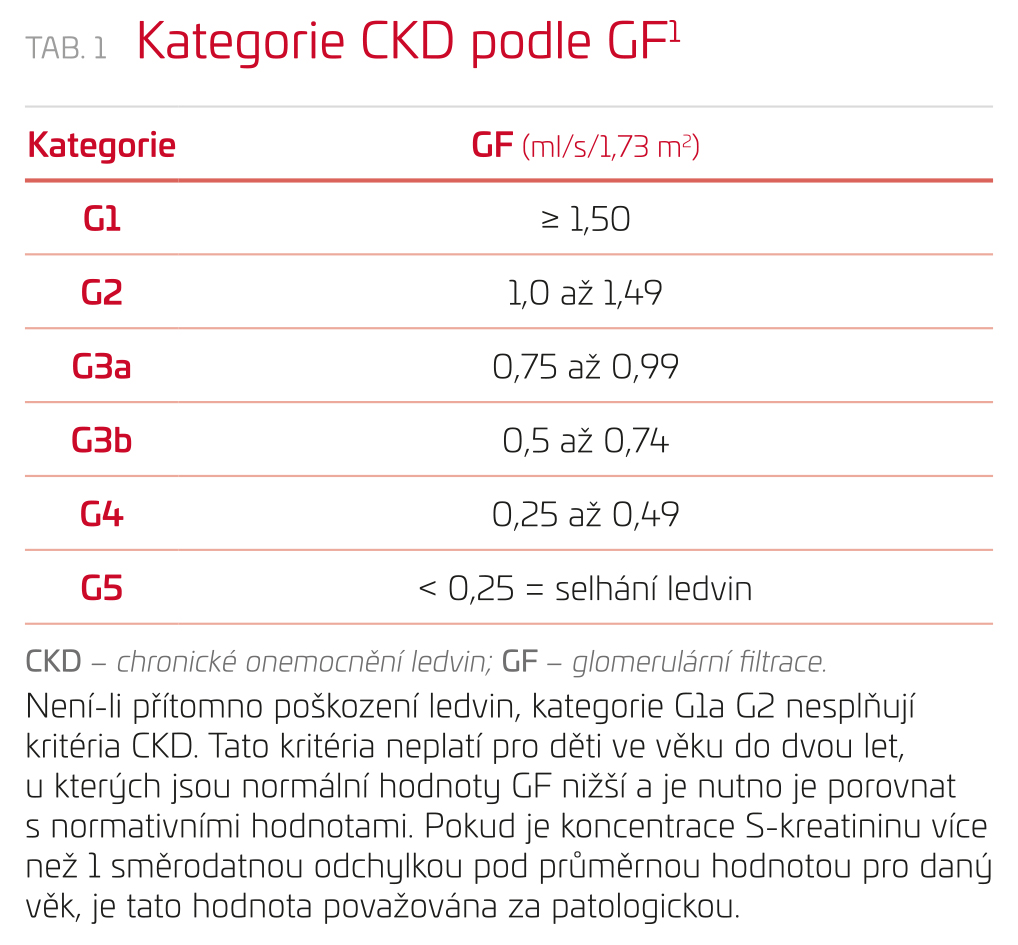
- kategorie glomerulární filtrace (GF) (G1, G2, G3a, G3b, G4, G5) (tab. 1),
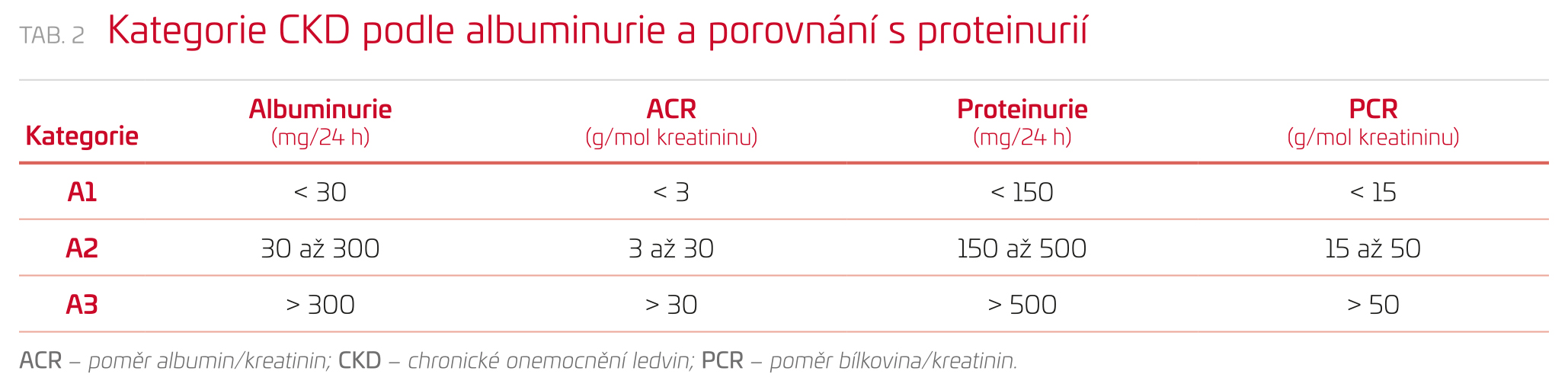
- kategorie albuminurie (A1, A2, A3) (tab. 2). Tato kategorie se nepoužívá u dětí, protože nejsou data, která spojují prognózu s albuminurií.
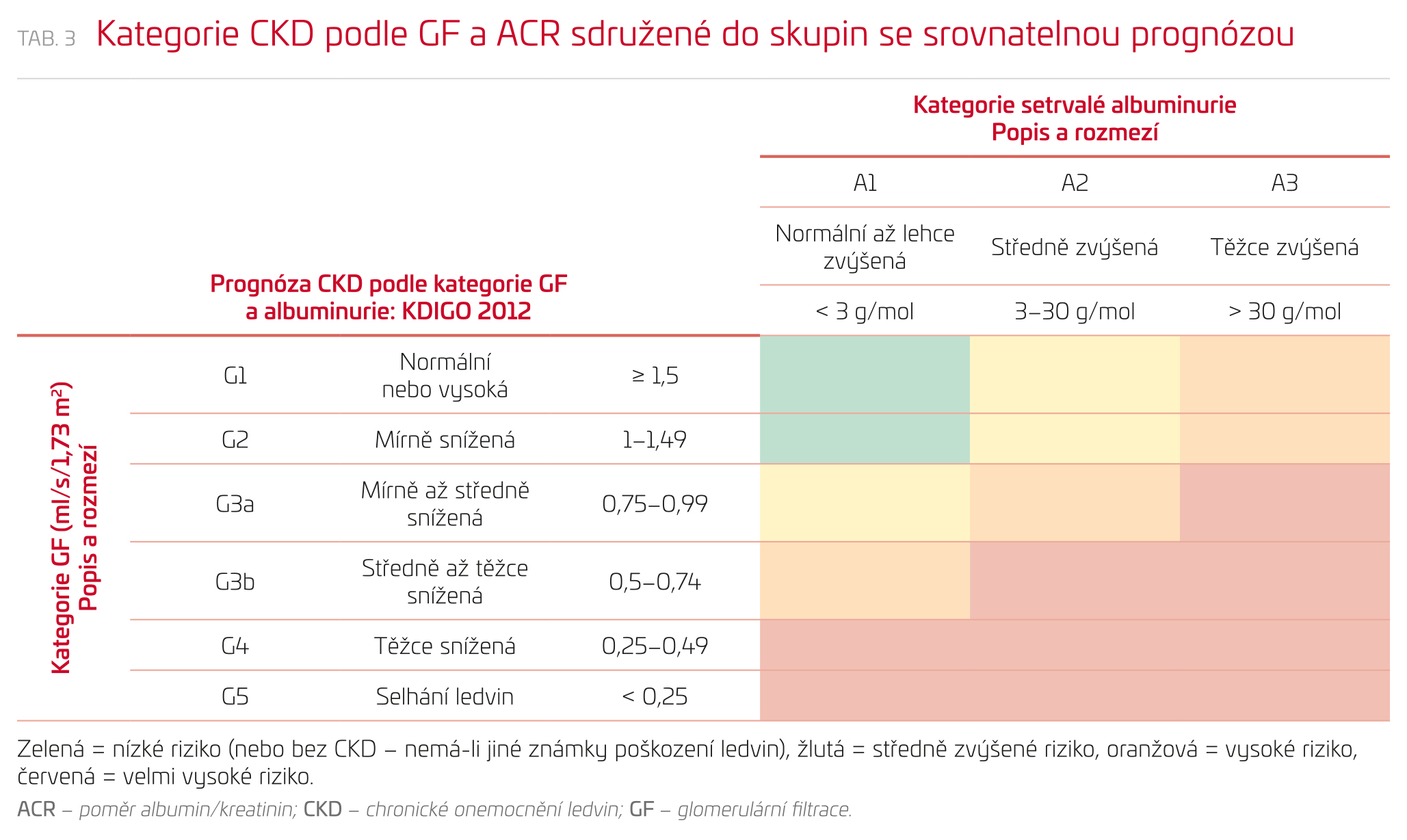
Riziko stoupá kontinuálně s klesající GF a stoupající albuminurií, kategorie jsou zvoleny pro zjednodušení a snazší klinickou aplikaci (tab. 3). Jde o orientační souhrnné riziko celkové mortality, mortality z kardiovaskulárních příčin, prognózy CKD a dalších specifických rizik. Při odhadu rizika jednotlivého pacienta je zásadní brát v úvahu (kromě GF a albuminurie) také příčinu CKD a ev. další komorbidity.
Průměrná glomerulární filtrace u zdravého mladého člověka ve věku do 40 let je 1,78 ml/s/1,73 m2. Od věku 40 let nastává pozvolný pokles GF (přibližně o 0,17 ml/s/1,73 m2 za deset let života), která ve věku 80 až 90 let dosahuje přibližně poloviční hodnoty proti jedincům ve věku mezi 20 a 30 roky. Tento pokles GF je zřejmě důsledkem poklesu průtoku krve ledvinou. U jedinců velmi pokročilého věku nemusí glomerulární filtrace pod 1,0 ml/s/1,73 m2 znamenat přítomnost onemocnění ledvin. Vedle neschopnosti ledvin starších jedinců vytvářet dostatečně hypertonickou moč je nutno přihlédnout k další důležité skutečnosti, že nejsou schopni dostatečně rychle vyloučit podanou vodní nálož.
1.1 Vyšetření u nemocných s chronickým onemocněním ledvin
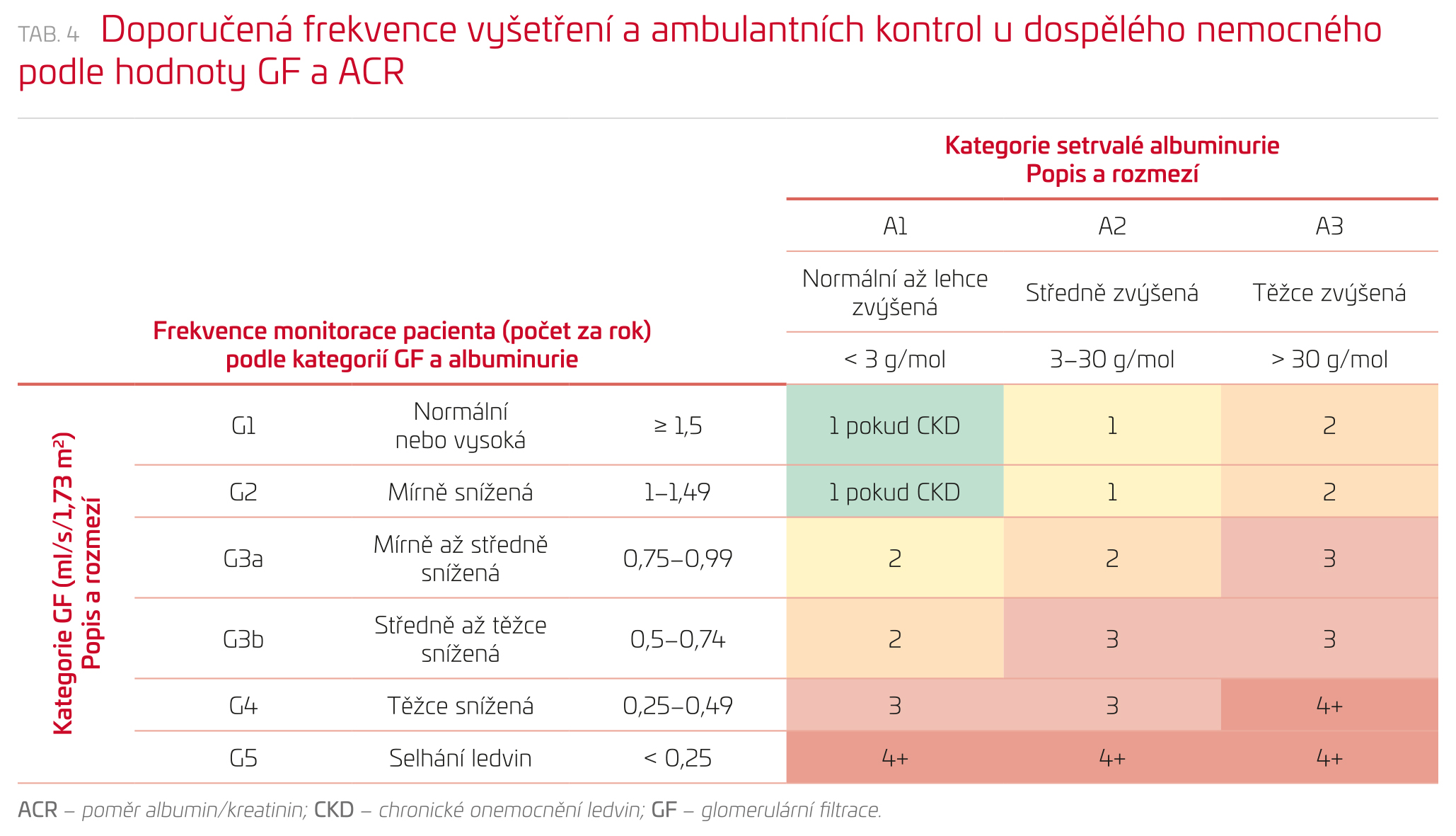
Dlouhodobé monitorování funkce u nemocných s CKD je velmi důležité z hlediska určení rychlosti progrese onemocnění i úspěšnosti léčebných postupů (tab. 4). Vzhledem k možnosti nepřesností při sběru moči doporučujeme užít metod výpočtových. Vyšetření reziduální GF u pacientů v predialyzačním období a u dialyzovaných a transplantovaných pacientů má být prováděno na specializovaných pracovištích.
Při vyšetření u pacientů po transplantaci si musíme být vědomi, že vyšetřujeme pouze jednu ledvinu (reziduální funkce vlastních ledvin bývá většinou velmi nízká a je přítomna pouze u časných a preemptivních transplantací). Po transplantaci ledviny běžně postačuje stanovení sérové koncentrace kreatininu, protože se sledují trendy jeho změn. Po transplantaci se kreatinin stanovuje denně v průběhu první hospitalizace a následně při každé ambulantní kontrole. V delším odstupu od transplantace provádíme vyšetření GF podobně jako u jiných nemocných s CKD.
Zvláštní pozornost je třeba věnovat přesnému vyšetření glomerulární filtrace u živého potenciálního dárce. Při vyšetření renální funkce u žijícího dárce ledvin je třeba ověřit, že je GF > 1,33 ml/s/1,73 m2 u dárců mladších než 50 let. Pro posouzení funkce ledvin u žijících dárců má být používána rovnice Chronic Kidney Disease Epidemiology Collaboration (CKD‑EPI) pro kreatinin. Při hraničních nálezech je nutné vyšetřit GF metodami nezávisejícími na stanovení hodnoty kreatininu. Bližší informace jsou k dispozici v práci Lentine a spol.
Přesné stanovení GF je rovněž nezbytné pro indikaci kombinovaných transplantací ledviny s dalším orgánem, kdy metody závisející na kreatininu nejsou vhodné.
2. Vyšetření glomerulární filtrace
2.1 Úvod
V současné době určujeme GF pomocí clearance endogenního nebo exogenního markeru filtrace. Všechny metody pro určení clearance jsou dosti složité, hlavním limitujícím faktorem je správný sběr moči. Proto je v klinické praxi GF nejčastěji odhadována ze sérové koncentrace kreatininu, popřípadě sérové koncentrace cystatinu C.
2.2 Metody vyšetření glomerulární filtrace
2.2.1 Metody určení GF bez sběru moči
2.2.1.1 Koncentrace kreatininu v séru
Měření koncentrace kreatininu v séru (plazmě) je standardizované. Referenční systém, základ standardizace, sestává z referenčního měřicího postupu založeného na metodě ID‑GC(LC)/MS a na certifikovaném referenčním materiálu NIST 967. Referenční systém umožňuje metrologickou návaznost kalibrace měření kreatininu v rutinních laboratořích jako podmínku pro pravdivost a harmonizaci výsledků měření jak kreatininu samotného, tak i následného výpočtu eGF. Metrologická návaznost kalibrace stanovení je obecně popsána v materiálech JCTLM (Joint Committee of Laboratory Medicine), uvedených na webových stránkách www.bipm.org nebo www.ifcc.org a v nové normě ISO17511:2020. Standardizace stanovení kreatininu v séru (plazmě) je navíc dostatečně popsána na webových stránkách www.niddk.nih.gov. Standardizace umožňuje dosahovat hodnot bias v intervalu ±3 % pro koncentrace u populace ve stavu zdraví s hodnotami kreatininu 60–90 µmol/l a ještě nižších u zvýšených koncentrací. Uvedená studie také ukazuje, že výsledky enzymatických metod různých výrobců jsou již zcela srovnatelné.
Ideální pro rutinní laboratoře je použití enzymatické fotometrické metody, která vykazuje nejlepší preciznost, nejnižší bias a nízké zatížení interferencemi. Alternativně lze použít i méně specifickou Jaffého metodu, pokud je její kalibrace metrologicky návazná a pokud je matematicky korigovaná odečtením hodnoty pseudokreatininových chromogenů (glukóza, kyselina močová, kyselina askorbová, acetoacetát, pyruvát, cefalosporiny, trimetoprim).
Také enzymové stanovení kreatininu může být zatíženo lékovými interferencemi, které vedou k falešnému snížení výsledků: při přímé kontaminaci vzorku infuzí při podávání katecholaminů (dopamin, dobutamin, adrenalin a noradrenalin) nebo metamizolu je nutné provést odběr vzorků před jejich podáním. V terapeutických koncentracích mohou interferovat rifampicin, levodopa, metyldopa, etamsylát (Dicynone), N‑acetylcystein.
Doporučení International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) k zlepšení kvality a snížení nejistoty hodnot výpočtu eGF předpokládá nezbytnost dosažení preciznosti měření referenční meze (cut‑off value, CV) ≤ 2,2 % a hodnoty bias < 4,4 µmol/l pro interval koncentrací 80 až 133 µmol/l; pak nejistota stanovení hodnoty odhadované glomerulární filtrace (eGF) nepřesáhne 10 %.
Doporučuje se vydávat výsledky kreatininu zaokrouhlené na celá čísla. Výsledky eGF (ml/s/1,73 m2) mají být vydávány zaokrouhlené na dvě desetinná místa. Výsledky eGF nižší než 1 ml/s/1,73 m2 mají být v laboratorním výsledkovém protokolu označeny slovním komentářem snížená hodnota.
Hodnota kreatininu v séru sama o sobě není dostatečně citlivá pro určení GF (má hodnotu klinické senzitivity pouze asi 60 %), avšak slouží k základnímu nefrologickému vyšetření a vysoké hodnoty spolurozhodují o zahájení dialyzační léčby.
Problémy standardizace stanovení kreatininu v séru a výpočtu eGF jsou v podstatě vyřešeny. Harmonizace výsledků získaných použitím diagnostik různých výrobců jsou při aplikaci enzymové fotometrické metody nebo u Jaffého metody s odečtem pseudokreatininu v souladu s požadavky doporučení kliniků v nefrologii a diabetologii.
Při stanovení hodnoty kreatininu v moči lze enzymatické a Jaffého metody považovat za rovnocenné.
Referenční intervaly koncentrace kreatininu v séru
Ke stanovení jejich hodnot byla použita metaanalytická studie. Byly vyhodnoceny údaje databáze MEDLINE za posledních dvacet let. Autoři vybrali z velkého počtu dat jen ty studie, které měly exaktně definované soubory referenčních jedinců a které používaly metody s prokázanou návazností na referenční metodu ID‑GC(LC)‑MS.
Hodnoty byly určeny pro věk 18 až 64 let:
Muži: 64 (63–66) až 104 (99–107) µmol/l
Ženy: 49 (46–55) až 90 (83–103) µmol/l
Hodnoty v závorkách představují 90% intervaly spolehlivosti referenčních mezí určené z 2,5. a 97,5. percentilu.
U dětí a dorostu se běžně používá odhad tzv. maximální koncentrace kreatininu v séru pro jedince dané tělesné výšky Skr(max) – to je poslední ještě normální koncentrace kreatininu v séru při dolní hranici glomerulární filtrace (což je 1,5 ml/s/1,73 m2), počítané rovnicí podle Schwartze – viz R3. Výška se používá v cm.
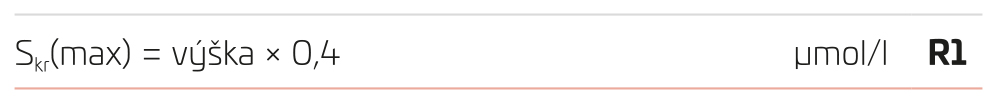
Pro orientační odhad GF u dětí má znalost Skr(max) značný praktický význam, např. u tříletého dítěte s výškou 100 cm je maximální hodnota Skr pouze 40 µmol/l, u dítěte dvouletého s výškou 86 cm ale pouze 34,4 µmol/l. Hodnoty kreatininu po narození jsou vysoké a rychle klesají; avšak do 1,5 až 2 let špatně reflektují skutečnou GF, která v této době dozrává. U dětí ve věku do dvou let je vhodnější odhadovat GF pomocí cystatinu C (viz dále).
Přestože jsou enzymatické a neenzymatické metody obecně považovány za přijatelné pro stanovení kreatininu, u pediatrických pacientů jsou enzymatické metody jednoznačně preferovány, protože použití neenzymatické metody nadhodnocuje hodnotu GF o 20 až 40 procent.
2.2.1.2 Odhad GF pomocí vzorců
Odhad GF pomocí vzorců je praktickým způsobem, jak se přiblížit k reálné GF v klinické praxi. Musíme ale zdůraznit, že rovnice pro odhad GF dobře fungují jen na „průměrného“ pacienta. Při hodnocení konkrétního odhadu je nutné interpretovat jej v kontextu všech případných limitů u daného pacienta. Hodnoty bias a preciznosti se liší u různých rovnic a v různých populacích, avšak je pravidlem, že 10–20 % odhadů je od skutečné hodnoty GF vzdáleno o více než 30 % a 40–50 % odhadů se od reálné GF liší o více než 10 %. I proto doporučení KDIGO z roku 2012 prospektivně nabádají k přijetí nových rovnic pro odhad GF, které budou mít menší bias a lepší preciznost (než CKD‑EPI, viz níže) a budou validovány na reprezentativních populacích (včetně dětí a seniorů). Nejlepší bias a preciznosti dosahují kombinované rovnice s kreatininem a cystatinem C.
2.2.1.2.1 Odhad pomocí koncentrace kreatininu v séru
Hodnota odhadované glomerulární filtrace počítaná pomocí Skr podléhá stejným analytickým (interference) a biologickým (neadekvátní svalová hmota, malnutrice, jaterní postižení) limitům jako stanovení koncentrace kreatininu v séru. Výpočtové metody pro eGF vycházející ze stanovení koncentrace kreatininu v séru je možno užít jen za podmínek stabilizované plazmatické koncentrace kreatininu. Při náhlých změnách renální funkce (např. v akutních stavech) jsou nepoužitelné.
V minulosti používané rovnice (podle Cockcrofta a Gaulta a rovnice MDRD) byly v doporučeních KDIGO z roku 2012 nahrazeny rovnicí CKD‑EPI, která poskytuje výsledky bližší reálné GF a je vhodná i pro zdravou populaci.
Ve všech následujících rovnicích je věk udáván v rocích a výška v cm. Pokud je za koeficientem poznámka v závorce – např. (ženy) nebo (černošská populace), použije se koeficient jen pro příslušnou populaci.
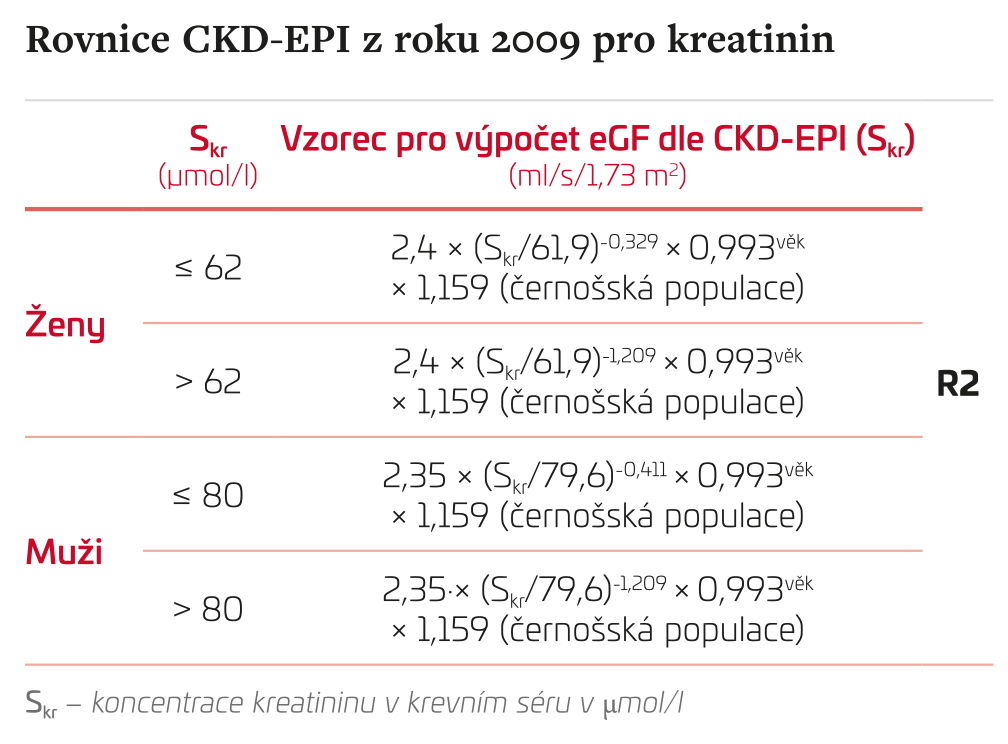
Rovnice CKD‑EPI z roku 2009 pro kreatinin
Odhad GF pomocí vzorce CKD‑EPI není vhodné používat u dětí a těhotných.
Pro odhad GF z koncentrace kreatininu v séru u dětí ve věku od dvou let a mladistvých je doporučeno používat rovnici podle Schwartze z roku 2009:

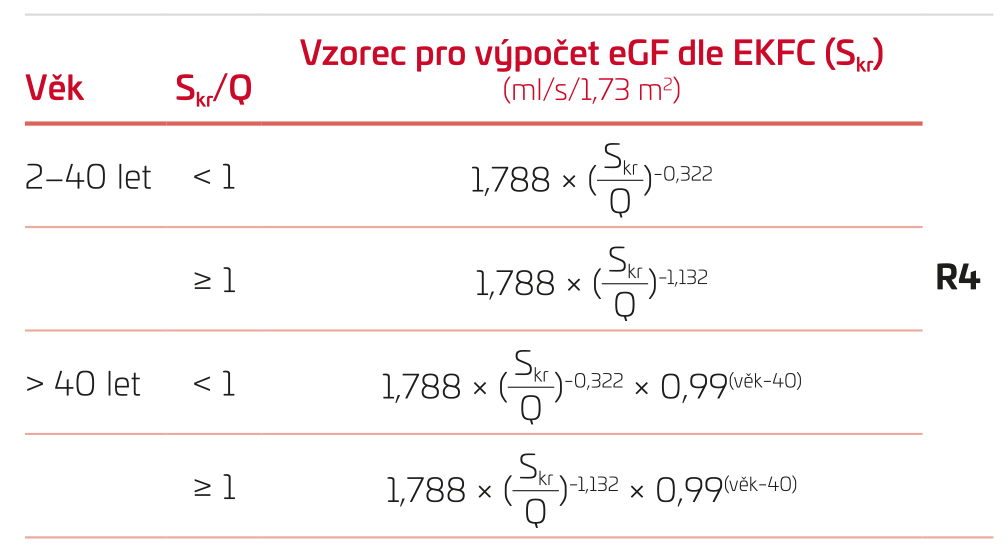
Výška dítěte na žádance často chybí a s každou hodnotou Skr by laboratoře měly vydávat i odhad GF. Proto byly vyvinuty rovnice, které výšku nevyžadují. Příkladem je rovnice Full Age Spectrum (FAS) a její poslední modifikace European Kidney Function Consortium (EKFC, R4),9 která byla odvozena z hodnot od více než 11 tisíc jedinců, je validována pro věkové rozmezí od 2 do 90 let a zahrnuje hodnoty Skr od 40 do 490 µmol/l (tab. 5). Logika odhadu je založena na porovnání Skr u pacienta s mediánem Skr u zdravých pro daný věk a pohlaví a na výše zmíněném faktu, že GF do 40 let je 1,78 ml/s/1,73 m2 a následně fyziologicky klesá o 0,17 ml/s/1,73 m2 za deset let. Prozatím publikované údaje svědčí o srovnatelném nebo lepším bias a preciznosti, než má Schwartzova rovnice a rovnice CKD‑EPI. Nezanedbatelnou výhodou je i kontinuum odhadů při přechodu mezi věkovými kategoriemi, protože návaznost odhadů ze Schwartzovy rovnice na odhady CKD‑EPI je velmi špatná. Další výhodou je validace rovnice pro seniorský věk. Rovnice EKFC může být proto považována za rozumnou alternativu pro Schwartzovu rovnici i rovnici CKD‑EPI.
2.2.1.2.2 Odhad pomocí koncentrace cystatinu C v séru
Cystatin C je mikroprotein (Mr 13,5 kDa), který patří do velké rodiny inhibitorů cysteinových proteáz. Tato látka je vytvářena všemi jadernými buňkami, volně prochází glomerulární membránou a je zachycována tubulárními buňkami. Molekuly cystatinu C, které pronikly do nitra tubulárních buněk, jsou v jejich nitru metabolizovány, takže do peritubulární tekutiny žádný cystatin C nepřechází. Očišťování extracelulární tekutiny od cystatinu C je tedy přímo úměrné GF. Sérové koncentrace cystatinu C (Scyst) jsou v průběhu dne téměř konstantní. Cystatin C je lepším prediktorem kardiovaskulárních příhod a mortality než kreatinin. Řada prací nasvědčuje tomu, že koncentrace cystatinu C v séru se zvyšují při malém poklesu GF dříve než Skr, a proto je tato látka považována za citlivější indikátor mírného poklesu GF. Za normálních okolností se veškerý profiltrovaný cystatin zpětně vstřebává, jeho nález v definitivní moči ukazuje na tubulopatii.
Validní klinická interpretace výsledků stanovení cystatinu C a eGF z něj vypočtené vyžaduje potřebnou úroveň analytické harmonizace výsledků jeho měření v séru (plazmě). Nezbytnou podmínkou této úrovně je metrologická návaznost kalibrace měření na certifikovaný evropský referenční materiál ERM DA‑471/IFCC. To je také důrazně vyjádřeno na webu www.niddk.nih.gov. Výsledky multicentrických studií nezbytnost tohoto požadavku jasně demonstrují a ukazují důsledky stavu, kdy není metrologická návaznost u metod některých výrobců dostatečná. Prakticky vždy při nesouladu výsledku stanovení cystatinu C a očekávaných hodnot eGF lze hledat příčinu v kalibrátoru metody a úrovni jeho metrologické návaznosti.
Jako míra analytické kvality hodnot eGF vypočtených z koncentrací cystatinu C se používá hodnota P30 (%). To je hodnota, při které se výsledek eGF neliší od referenčních metod stanovení GF (viz odstavec 2.2.1.3) o více než 30 %. U dobře standardizované metody cystatinu C se hodnoty P30 (%) pohybují v intervalu 75–85 %. Nejsou významné diference mezi imunoturbidimetrickými a imunonefelometrickými metodami stanovení. Pokud se diference naleznou, je problém v kalibraci metod.
Cystatin C by měl být využit zejména v následujících situacích:
- u pacientů, kteří ztratili svalovou hmotu (nemají adekvátní svalovou hmotu vzhledem ke svému věku, pohlaví a rase), např. při dlouhodobé imobilizaci, svalové dystrofii, malnutrici či ztrátě významné části končetiny,
- k potvrzení chronického onemocnění ledvin: GF < 1,0 ml/s/1,73 m2 podle odhadu z koncentrace kreatininu v séru, zejména nejsou‑li přítomny markery poškození ledvin,
- u stavů, kde koncentrace kreatininu v séru je významně ovlivněna (těhotné, generalizované otoky, malé děti – zejména ve věku do dvou let, rychlé změny stavu aj.).
Výpočet GF pomocí koncentrace cystatinu C v séru nelze použít v následujících situacích:
- při podávání glukokortikoidů (zvyšují koncentraci cystatinu C v závislosti na dávce),
- u pacientů s nekompenzovanou hypertyreózou (zvýšení koncentrace cystatinu C) či hypotyreózou (snížení koncentrace cystatinu C),
- a u pacientů s nádory (zvýšení koncentrace cystatinu C).
Pro stanovení cystatinu C a odhadu GF podle jeho sérové koncentrace platí:
- hodnota eGF má vyšší výpovědní hodnotu než samotná hodnota cystatinu C,
- výsledky stanovení cystatinu C v séru a hodnoty eGFcys by se měly vydávat společně,
- k výpočtu eGFcys se má používat rovnice CKD‑EPI 2012,
- výsledky koncentrace cystatinu C a eGF se mají uvádět na dvě desetinná místa.
Pro odhad glomerulární filtrace z koncentrace cystatinu C v séru u dospělých lze využít rovnici CKD‑EPI z roku 2012 (R5), cystatin C musí být stanoven metodou metrologicky navázanou na evropský referenční materiál ERM DA 471/IFCC. Další možností je použití hodnot kreatininu i cystatinu C v jedné rovnici (R6).

V pediatrii lze pomocí cystatinu C posoudit funkci ledvin už u plodu v děloze – cystatin C totiž oproti kreatininu neprochází fetoplacentární bariérou (krev plodu je možno získat kordocentézou při amnioskopii). Výhodou stanovení cystatinu C u dětí je nezávislost jeho hodnoty na věku nebo tělesné výšce, což je zásadní rozdíl proti koncentraci kreatininu v séru.
V pediatrii lze aplikovat výpočet eGF z cystatinu C (rovnice R7).1

2.2.1.3 Izotopové metody vyšetření GF – 99mTc‑DTPA (diethyltriaminopentaoctová kyselina), 51Cr‑EDTA (ethylendiaminotetraoctová kyselina), 125I‑thalamát
Radionuklidové metody používané k vyšetření renálních funkcí umožňují posoudit vylučování izotopem značených látek z organismu ledvinami. Rychlost poklesu aktivity v plazmě je dána velikostí GF, resp. tubulární sekrece. Při dynamické scintigrafii je také možnost posoudit odděleně funkci pravé a levé ledviny. V klinické praxi se tyto metody nyní využívají k přesnému změření GF a posouzení stranové rozdílnosti u zdravých dárců ledvin nebo pro posouzení rozsahu resekčního operačního výkonu na ledvinách.
2.2.2 Metody měření GF se sběrem moči
2.2.2.1 Renální clearance endogenního kreatininu (včetně korigované hodnoty)
U zdravého dospělého člověka clearance kreatininu (Ckr) pouze lehce přesahuje GF (o 10 až 20 %) v důsledku nevelké tubulární sekrece kreatininu v proximálním tubulu. U jedinců s chronickým renálním onemocněním (CKD 4 až 5) se tubulární sekrece kreatininu relativně zvyšuje (vzhledem k velmi snížené glomerulární filtraci) a v konečných stadiích chronického selhání ledvin může Ckr přesahovat GF o 100 i více procent. Renální clearance kreatininu se určuje na podkladě měření močového vylučování kreatininu (Ukr × V) ve sledovaném období a sérové koncentrace kreatininu Skr. Výpočet se provádí dle

Hodnoty Ckr se přepočítávají na ideální tělesný povrch (1,73 m2). Jak je zřejmé ze vzorce, je pro stanovení této veličiny nutný přesný sběr moči. Tato okolnost je v denní praxi často velkým problémem a chyby v neúplném sběru moči znemožňují správně posoudit Ckr. To je jedním z hlavních důvodů, proč se v klinice raději volí odhad GF na podkladě hodnocení Skr nebo se užije výpočtová metoda.
2.2.2.2 Clearance inulinu
Nyní je tato metoda využívána jenom ve výzkumu, i když se ještě vyskytuje v doporučeních KDIGO pro vyšetřování zvažovaných dárců ledviny.
2.2.3 Závěr
2.2.3.1 Doporučený postup pro odhad GF u dospělých
Na základě současných poznatků Česká nefrologická společnost a Česká společnost klinické biochemie ČLS JEP doporučují pro výpočet odhadu glomerulární filtrace používat rovnici CKD‑EPI pro kreatinin (R2).
2.2.3.2 Doporučený postup pro odhad GF u dětí
Na základě současných poznatků Česká pediatrická společnost ČLS JEP, Česká nefrologická společnost a Česká společnost klinické biochemie ČLS JEP doporučují pro výpočet odhadu glomerulární filtrace u dětí používat rovnici podle Schwartze, kterou je možné použít do věku 18 let (R3, R7).
3. Vyšetření proteinurie
3.1 Úvod
Vyšetření močových bílkovin stále zůstává jedním ze základních vyšetření v nefrologii. Nezastupitelné místo má jak v časné diagnostice nemocí ledvin, tak v monitorování jejich aktivity, odpovědi na léčbu a odhadu rizika vývoje selhání ledvin i kardiovaskulárního rizika. Současná diagnostika je založena na vyšetření celkové bílkoviny a albuminu v moči. V poslední době se doporučuje stanovovat poměr bílkovina/kreatinin (PCR) nebo častěji albumin/kreatinin (ACR) v náhodném vzorku moči (nejlépe v prvním ranním vzorku) – viz tabulku 2. Pro včasné odhalení počínajícího postižení ledvin u diabetiků a hypertoniků má význam stanovení albuminu v moči. Pojem mikroalbuminurie je již irelevantní, protože kvantita vylučování albuminu močí má hranice pouze arbitrární a jakákoliv naměřená albuminurie představuje zvýšené renální i kardiovaskulární riziko.
3.2 Fyziologie vylučování bílkovin do moči
Glomerulární kapilární stěna (zejména glomerulární bazální membrána) efektivně brání průniku bílkovin do moči. Do moči proniká jen malá část bílkovin, a to v závislosti na jejich molekulové hmotnosti (velikosti), náboji (usnadňuje vylučování kationických a znesnadňuje vylučování anionických bílkovin) a tvaru. Bílkoviny s molekulovou hmotností větší než albumin (69 kD, efektivní průměr 3,6 nm) pronikají do moči velmi omezeně, zatímco se snižující se molekulovou hmotností a menším efektivním průměrem se filtrace dané molekuly progresivně zvyšuje (selektivita podle velikosti, ev. tvaru molekuly).
Většina plazmatických bílkovin včetně albuminu se za fyziologického pH chová jako polyanionty, jejichž filtraci brání negativní náboj bazální membrány glomerulů. Většina profiltrovaného albuminu (99 %) je reabsorbována v tubulech, takže močí se fyziologicky vyloučí méně než 30 mg albuminu denně.
Nízkomolekulární bílkoviny, které jsou volně filtrovány v glomerulech, jsou účinně resorbovány a následně katabolizovány v proximálním tubulu a jejich koncentrace v moči jsou minimální. Nejvýznamnější součástí tzv. fyziologické proteinurie je uromodulin (dříve Tammův–Horsfallův protein) – mukoprotein, který je secernován tubulárními buňkami v tlusté části vzestupného raménka Henleovy kličky (přibližně 30–50 mg/24 h). Dalšími složkami jsou albumin, imunoglubulin (Ig) G a sekreční IgA a volné polyklonální lehké řetězce imunoglobulinů.
Při běžné svalové aktivitě nepřesáhne fyziologická proteinurie 50–80 mg/24 h, při větší svalové aktivitě, prolongované ortostáze a sníženém příjmu tekutin může být vyšší – horní hranice fyziologické proteinurie je arbitrárně definována na 150 mg/24 h.
3.3 Klasifikace zvýšeného vylučování bílkovin do moči
Z hlediska etiologie lze proteinurii dělit do několika základních skupin:
- Funkční proteinurie je přechodná proteinurie, která se může vyskytnout u osob se zdravými ledvinami, např. při těžší práci nebo cvičení, při emočním stresu. Mechanismus této glomerulární proteinurie je pravděpodobně hemodynamický, je tedy nejspíše glomerulárního původu. Hemodynamickou příčinu má zřejmě také tzv. ortostatická proteinurie, která se vyskytuje u asi 2–5 % mladých, jinak zdravých jedinců, častěji mužů, a je charakterizována malou proteinurií (zpravidla menší než 1 g/24 h) vstoje a nezvýšenou proteinurií vleže. Je‑li zvýšena i proteinurie v nočním vzorku (tj. z doby, kdy pacient ležel), je nutno vyloučit organické onemocnění ledvin.
- Prerenální proteinurie je vyvolána zvýšenou plazmatickou koncentrací nízkomolekulárních, snadno filtrovatelných proteinů, jejichž filtrace překročí resorpční kapacitu proximálního tubulu, např. vylučováním lehkých řetězců imunoglobulinů u některých monoklonálních gamapatií, myoglobinu u rhabdomyolýzy, hemoglobinu u akutní hemolýzy apod.
- Glomerulární proteinurie je způsobena poškozením glomerulární filtrační bariéry. Dá se rozdělit na selektivní s převahou albuminu a vylučováním některých menších proteinů a neselektivní, kdy jsou v moči i proteiny s vyšší molekulovou hmotností. Toto rozdělení nelze spolehlivě použít k diagnostice jednotlivých glomerulárních onemocnění, a má tedy jen omezený význam.
- Tubulární proteinurie vzniká při porušené zpětné resorpci profiltrovaných nízkomolekulárních bílkovin v proximálním tubulu.
- Postrenální proteinurie je způsobena sekrecí bílkovin do moči ve vývodných močových cestách (krvácení, zánět); typická je přítomnost α2‑makroglobulinu a IgM.
- Arteficiální proteinurie je charakterizována přítomností cizorodé bílkoviny, kterou z nějakého důvodu pacient do moči přidal. Nejčastěji se jedná pro snadnou dostupnost o vaječný bílek. Průkaz se provádí elektroforeticky, případně imunochemicky.
Podle velikosti ztrát bílkovin do moči za 24 h se proteinurie dělí na malou (0,15–1,5 g/24 h), střední (1,5–3,5 g/24 h) a velkou, nefrotickou (> 3,5 g/24 h).
U dětí rozlišujeme tyto typy proteinurie: normální (< 150 mg/m2/den), lehká (150–1 000 mg/m2/den) a nefrotická (> 1 000 mg/m2/den). U novorozenců se považuje za normální proteinurie až do hodnoty 300 mg/m2/den.
3.4 Analytika a výsledky stanovení proteinů v moči
3.4.1 Základní pravidla
Podle doporučení KDIGO 2012 přichází v úvahu k diagnóze chronické renální choroby a k její klasifikaci a léčbě následující stanovení:
- kvantitativní stanovení albuminu a albumin‑kreatininového kvocientu (ACR) v moči,
- kvantitativní stanovení celkového proteinu a protein‑kreatininového kvocientu (PCR) v moči,
- ev. orientační semikvantitativní stanovení proteinu testovacími proužky v moči.
Tyto tři základní uvedené testy jsou seřazeny podle klesající výpovědní schopnosti.
Několik základních pravidel k používání těchto vyšetření:
- Výsledky albuminu je doporučeno uvádět jako poměr ACR (g/mol) i jako koncentrace (mg/l).
- Výsledky celkového proteinu je doporučeno uvádět jako PCR (g/mol) i jako koncentrace (g/l).
- Preferují se jednorázové vzorky močí před vzorky časovanými.
- Pozitivní výsledky semikvantitativních stanovení albuminu a celkového proteinu je nezbytné potvrdit opakovanou kvantitativní analýzou v klinické laboratoři.
- Pokud se u náhodného vzorku stanoví hodnota ACR ≥ 3 g/mol, je zapotřebí vyšetření opakovat nejlépe s použitím vzorku první ranní moči.
- Časované vzorky jsou zatíženy prakticky neodstranitelnou chybou sběru. Doporučuje se je používat pouze v indikovaných případech, zejména pokud se na jejich základě rozhoduje o další léčbě (KDIGO 2019).
- Nejvyšší výpovědní hodnotu a současně nejnižší biologickou variabilitu vykazují vzorky první ranní moči.
3.4.2 Stanovení albuminu a ACR
Dominantní roli v analýze proteinů u chronické renální choroby zaujímá stanovení albuminu v moči. Albumin v moči je citlivějším a specifičtějším ukazatelem změn glomerulární permeability než celkový protein. Hodnoty ACR stratifikují populaci s CKD do tří kategorií podle stupně renální choroby (viz výše).
U zdravé populace nepřesahuje koncentrace albuminu v moči 30 mg/24 hodin, a proto také může být patologické zvýšení hodnoty albuminu v moči (ACR) detekováno i při nezvýšeném množství celkového proteinu v moči, jehož stanovení je mnohem méně analyticky citlivé. Albumin vykazuje ve srovnání s celkovým proteinem významně vyšší analytickou citlivost a větší analytickou specifičnost. Hodnota ACR vykazuje nižší biologickou variabilitu než hodnoty albuminu v časovaných vzorcích a má rovněž vyšší výpovědní hodnotu. Doporučuje se zaokrouhlovat výsledek ACR na jedno desetinné místo.
Imunochemické metody stanovení albuminu (imunoturbidimetrie/imunonefelometrie) vykazují mez detekce 2 až 10 mg/l (pro srovnání: mez detekce celkového proteinu v moči pomocí stanovení testovacími proužky je asi 150 mg/l). Požadovaná mezilaboratorní reprodukovatelnost měření je CV < 15 %.
V roce 2013 byla publikována studie, která srovnává výsledky stanovení albuminu v moči dosažené imunoanalytickými metodami všech hlavních výrobců s metodou LC‑MS/MS. Diference jsou významné. Přesahují 10 % u vzorků se zvýšenými koncentracemi albuminu a dosahují až 35 % u vzorků s koncentracemi albuminu kolem 15 mg/l.
Stav referenčního systému měření albuminu v moči je v úplnosti popsán od roku 2013. Referenční metodou je stanovení vybraných peptidů vzniklých tryptickou digescí vzorku a jejich kvantifikace metodou kapalinové chromatografie s hmotnostní spektrometrií (LC‑MS)/MS (metoda modifikovaná a validovaná na Mayo Clinic). Referenčním materiálem pro zajištění metrologické návaznosti rutinních metod může být:
- naředěný vzorek ERM DA 470 k/IFCC;
- NIST‑SRM 2925 (lidský sérový albumin);
- 15N albumin (není komerčně přístupný).
Validace referenční metody zjistila hodnotu CV 1–4 %, bias (recovery) 97–104 %.
Rutinní imunochemické a imunonefelometrické metody, kalibrované pomocí referenční metody a standardního referenčního materiálu NIST SRM 2925, nevykazují signifikantní diference.
Pro rutinní měření albuminurie je nejvhodnější skladování vzorků před analýzou v lednici při +2 až +8 °C a temperování vzorků před měřením na pokojovou teplotu k odstranění případných precipitací. Stabilita při této teplotě je minimálně 7 dní. Zamrazování se nedoporučuje, protože není dostatečně prostudovaná případná sorpce na stěny odběrových zkumavek ani jiné ovlivňující faktory.
3.4.3 Stanovení celkových proteinů a PCR
Metody stanovení celkového proteinu nejsou dostatečně standardizované. Není k dispozici mezinárodní referenční materiál. Výsledky měření jsou silně závislé na složení vzorku. Obecně ke stanovení používané turbidimetrické a fotometrické metody vykazují mnohem vyšší analytickou citlivost k albuminu než ke globulinům. Metody také postrádají dostatečnou preciznost v oblastech nižších koncentrací a vykazují nižší úroveň mezilaboratorní preciznosti v důsledku diferencí výsledků mezi výrobci testovacích souprav, kterých je velké množství. V indikovaných případech je však zapotřebí preferovat stanovení PCR před ACR (například u monoklonálních gamapatií). Dostatečně podrobný přehled analytických metod je obsažen v práci Lamba a spol.
3.4.4 Semikvantitativní stanovení albuminu a celkových proteinů testovacími proužky
Semikvantitativní stanovení celkového proteinu testovacími proužky má jen orientační význam. Je málo citlivé, s nestandardizovanými barevnými škálami, rozdílnými u různých výrobců. Albumin vykazuje mnohem vyšší citlivost při reakcích testovacích proužků než globuliny, což způsobuje velkou závislost výsledků měření na složení analyzovaných vzorků. Dalším zdrojem chybných výsledků je alkalické pH vzorku moči. Při vizuálním odečtu proteinurie testovacími proužky může navíc silně interferovat intenzivní zbarvení vzorku moči.
U pacientů s pozitivním nálezem při vyšetření testovacím proužkem má být přítomnost proteinurie nebo albuminurie vždy ověřena kvantitativním stanovením poměru ACR nebo PCR.
3.4.5 Vyšetření dalších proteinů v moči
Kvalitativní pohled na proteinurii poskytují elektroseparační techniky, většinou založené na principu elektroforézy, ev. v kombinaci s monoklonálními protilátkami. Kvalitativní stanovení nezohledňuje míru koncentrace moči; hraniční nálezy mohou být u některých nemocných s koncentrovanou močí falešně pozitivní, naopak s velmi zředěnou močí falešně negativní. V klinice mají tyto charakteristiky jen malý význam, nejsou součástí doporučených postupů a jsou dostupné většinou jen ve výzkumných laboratořích.
Literatura
- Bachmann LM, Nilsson G, Bruns DE, et al. State of the Art for Measurement of Urine Albumin: Comparison of Routine Measurement Procedures to Isotope Dilution Tandem Mass Spectrometry. Clin Chem 2014;60:471–480.
- Bargnoux AS, Piéroni L, Crtistol JP, et al. Multicenter evaluation of Cystatin C Measurement after Assay Standardization. Clin Chem 2017,63:833–841.
- Ceriotti F, Boyd JC, Klein G, et al. Reference intervals for serum creatinine concentrations: assessment of available data for global application. Clin Chem 2008;54:559–566.
- Chen Y, Liu H, Loh TP, et al. Measurement of urine albumin by liquid chromatography‑isotope dilution tandem mass spectrometry and its application to value assignment of external quality assessment samples and certification of reference materials. Clin Chem Lab Med 2020 Oct 20:cclm‑2020‑0969. doi: 10.1515/cclm‑2020‑0969. Epub ahead of print. PMID: 33079695.
- Delanghe JR, Cobbaert C, Harmoinen A, et al. Focusing on the clinical impact of standardization of creatinine measurements: a report by the EFCC Working Group on Creatinine Standardization. Clin Chem Lab Med 2011;49:977–982.
- Floege J, Barbour SJ, Cattran DC, et al. Management and treatment of glomerular diseases (part 1): conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int 2019;95:268–280.
- Friedecký B, Zima T, Kratochvíla J, Springer D. Diabetes mellitus – laboratorní diagnostika a sledování stavu pacientů. Klin Biochem Metab Časopis Čes Spol Klin Biochem 2012;20:97–107.
- Greenberg N, Roberts WL, Bachmann LM, et al. Specificity Characteristics of 7 Commercial Creatinine Measurement Procedures by Enzymatic and Jaffe Method Principles. Clin Chem 2012;58:391–401.
- Grubb A, Blirup‑Jensen S, Lindström V, et al. First certified reference material for cystatin C in human serum ERM‑DA471/IFCC. Clin Chem Lab Med 2010;48:1619–1621.
- Guder WG, Hofmann W. Differentiation of proteinuria and haematuria by single protein analysis in urine. Clin Biochem 1993;26:277–282.
- Hofmann W, Guder WG. A diagnostic programme for quantitative analysis of proteinuria. J Clin Chem Clin Biochem 1989;27:589–600.
- Ibsen H, Olsen MH, Wachtell K, et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: losartan intervention for endpoint reduction in hypertension study. Hypertension 2005;45:198–202.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl 2013;3:1–150.
- Lamb EJ, MacKenzie F, Stevens PE. How should proteinuria be detected and measured? Ann Clin Biochem 2009;46(Pt 3):205–217.
- Lentine KL, Kasiske BL, Levey AS, et al. KDIGO Clinical Practice Guideline on the Evaluation and Care of Living Kidney Donors. Transplantation 2017;101(8S Suppl. 1):S1–S109.
- Lieske JC, Bondar O, Miller WG, et al. A reference system for urinary albumin: current status. Clin Chem Lab Med 2013;51:981–989.
- Miller WG, Bruns DE, Hortin GL, et al. Current issues in measurement and reporting of urinary albumin excretion. Clin Chem 2009;55:24–38.
- Molinario R, Pocine K, Dante Deloise P, et al. Urinary albumin detection: comparison of two different methods. J Clin Lab Anal 2016;30:688–691.
- Myers GL, Miller WG, Coresh J, et al. Recommendations for improving serum creatinine measurement: a report from the Laboratory Working Group of the National Kidney Disease Education Program. Clin Chem 2006;52:5–18.
- Myers GL. Standardization of serum creatinine measurement: theory and practice. Scand J Clin Lab Investig Suppl 2008;241:57–63.
- Ohisa N, Kanemitsu K, Matsuki R, et al. Evaluation of hematuria using the urinary albumin‑to‑total‑protein ratio to differentiate glomerular and nonglomerular bleeding. Clin Exp Nephrol 2007;11:61–65.
- Pottel H, Björk J, Courbebaisse M, et al. Development and Validation of a Modified Full Age Spectrum Creatinine‑Based Equation to Estimate Glomerular Filtration Rate. Ann Intern Med 2021;174:183–191.
- van der Hagen EAE, Weykamp C, Sandberg S, et al. Feasibility for aggregation of commutable external quality assessment results to evaluate metrological traceability and agreement among results. Clin Chem Lab Med 2021,59:117–125
- Kategorie: Doporučené postupy
- Klíčová slova: glomerulární filtrace; chronické onemocnění ledvin; proteinurie