Srdeční selhání a chronické onemocnění ledvin
Souhrn
Chronické srdeční selhání a chronické selhání ledvin často koexistují, navzájem se ovlivňují a mají aditivní vliv na prognózu. Již od počátků výzkumu moderní léčby srdečního selhání je zjevné, že integrita oběhu je udržována společně koordinovanými činnostmi srdce a ledvin, které od sebe nelze úplně oddělit. Přítomnost selhání druhého orgánu zásadně ovlivňuje volbu léčebných postupů. V krátkém přehledu jsou shrnuta témata, která často řeší kardiolog s nefrologem při péči o tyto komplikované pacienty.
Klíčová slova: chronické onemocnění ledvin – chronické srdeční selhání – kardionefrologie – kardiorenální syndrom
Chronické srdeční selhání (CHSS) je časté a bude ještě častější. Aktuální data ukazují, že prevalence CHSS v české populaci je 2,7 % a mezi lety 2010 až 2017 se zdvojnásobila.1 Srdeční selhání je často doprovázeno komorbiditami a chronické onemocnění ledvin (chronic kidney disease, CKD) je jednou z nejčastějších. V neselektované populaci pacientů s CHSS přijatých do nemocnice pro dekompenzaci jich má normální funkci ledvin (odhadovaná glomerulární filtrace [eGFR] > 90 ml/min/1,73 m2) jen 9 %; naopak terminální stadium selhání ledvin (ESRD) (eGFR ≤ 30 ml/min/1,73 m2) má přes 20 % pacientů.2 Společný vysoký výskyt obou nemocí je podmíněn sdílenými rizikovými faktory, jako jsou diabetes a hypertenze, vlivem nízkého srdečního výdeje či neurohumorální aktivace na ledviny, a naopak vlivem hypervolemie a retence toxinů na funkci srdce. CKD nezávisle predikuje progresi srdečního selhání, což naznačuje aktivní roli této komorbidity v progresi klinického syndromu. Pacienti s CHSS a závažným CKD představují na mapě kardiovaskulárních nemocí jedno z posledních „hic sunt leones“ míst; tito pacienti byli totiž bohužel vyřazeni z téměř všech klinických studií testujících efektivní terapie CHSS.
Při klinickém přístupu k těmto pacientům záleží na tom, zda hlavní diagnózou je srdeční selhání a CKD je přidruženou poruchou, nebo naopak.
Srdeční selhání doprovázené nefropatií
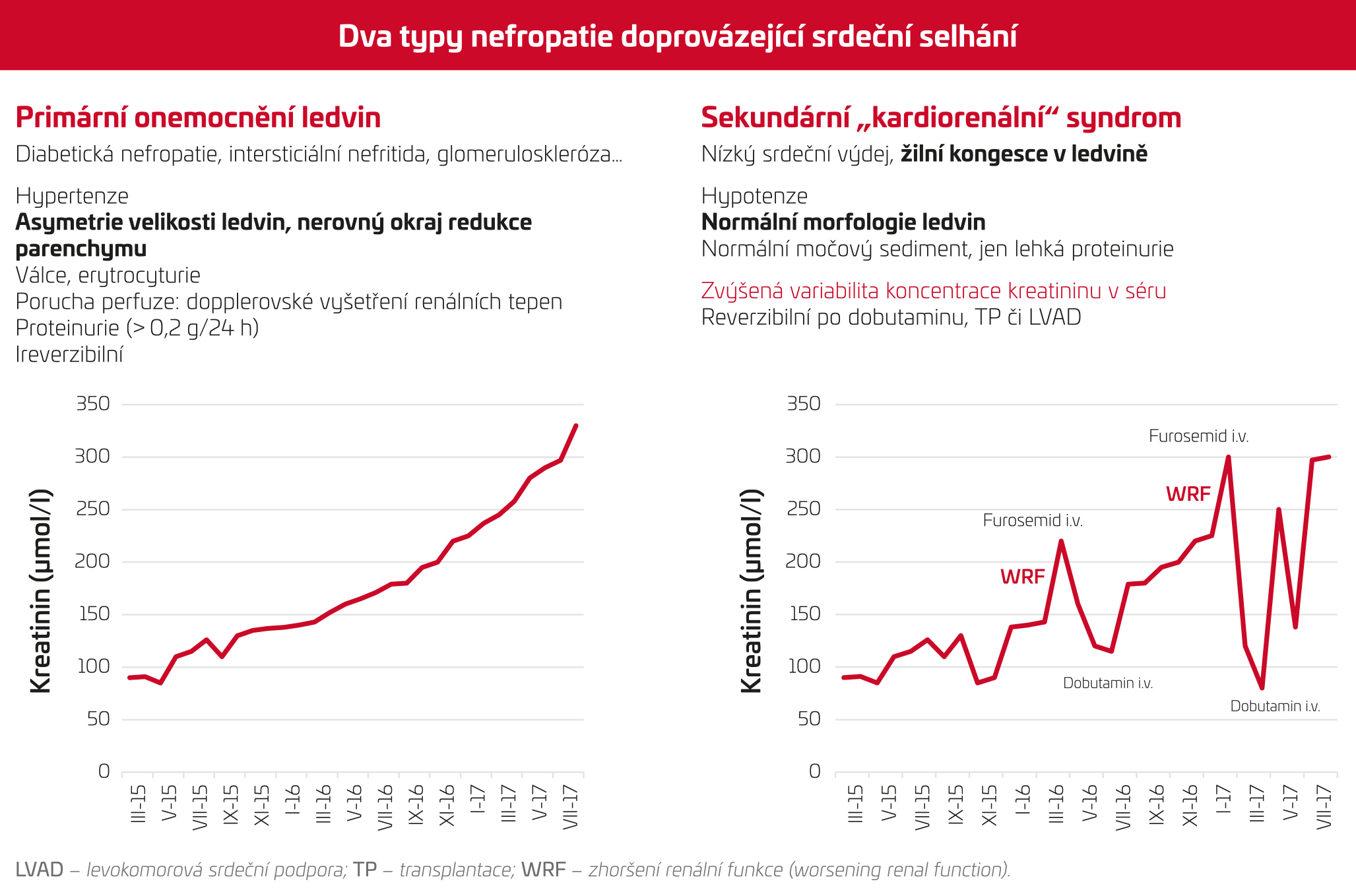
U pacientů s dominujícím CHSS se CKD rozvíjí buď v důsledku souběžného „primárního onemocnění ledvin“, nebo je funkce ledvin nepříznivě ovlivněna srdečním selháním a rozvíjí se „sekundární kardiorenální syndrom“. Odlišení těchto dvou forem nefropatií doprovázejících CHSS je důležité při plánování léčby srdeční dysfunkce a je často cílem konzilia nefrologa na kardiologii. Existuje několik triků, jak tyto dvě jednotky rozlišit (obr. 1). Pacienti s primárním onemocněním ledvin obvykle vykazují abnormální velikost či strukturu ledvin při ultrazvukovém vyšetření, mívají abnormální nález v močovém sedimentu a často mají systémovou hypertenzi. Tato forma renálního postižení obvykle nereaguje na zlepšení funkce srdce, a CKD tak může představovat bariéru k chirurgickým postupům léčby CHSS, jako jsou transplantace, implantace dlouhodobé mechanické podpory srdce či chirurgická korekce vad.
OBR. 1 Diferenciální diagnóza poruchy funkce ledvin u pacienta s dominujícím srdečním selháním
Na druhou stranu pacienti se sekundárním kardiorenálním syndromem v důsledku těžké srdeční dysfunkce mívají obvykle hypotenzi, hypervolemii (hepatomegalie, ascites, RTG kongesce plic, dilatace a snížená kompresibilita dolní duté žíly), zatímco morfologie ledvin bývá normální. Zhoršení funkce ledvin je často spojeno i se zvýšením hodnot jaterních transamináz jako projevem multiorgánové dysfunkce v důsledku závažně snížené funkční rezervy srdce. V močovém sedimentu může být přítomna lehká reverzibilní proteinurie. Užitečným ukazatelem, který odliší obě jednotky, je dlouhodobý časový trend koncentrace kreatininu. Plynule progredující elevace kreatininu svědčí pro primární onemocnění ledvin, naopak vysoce variabilní koncentrace kreatininu, popř. výrazný ústup renální dysfunkce po několikadenní inotropní léčbě (dobutamin, milrinon) svědčí pro sekundární kardiorenální syndrom, který nepředstavuje kontraindikaci radikálního řešení příčiny dysfunkce srdce.
K optickému zhoršení funkce ledvin u pacientů s CHSS může přispět farmakoterapie CHSS. Použití kličkových diuretik u dekompenzovaných pacientů může zvyšovat koncentraci kreatininu, ale současně vede k ústupu kongesce, která je sama o sobě ještě více nepříznivá. Americká studie DOSE porovnávající strategii kompenzace srdečního selhání pomocí vyšší nebo nižší dávky kličkových diuretik ukázala benefit vysokodávkovaného furosemidu bez ohledu na to, zda byl podáván kontinuálně, či bolusově.3 Pacienti s kardiální dekompenzací, u nichž došlo ke zhoršení funkce ledvin během léčby dekompenzace, mají špatnou prognózu pouze tehdy, pokud kromě zhoršení funkce ledvin přetrvávala i hypervolemie.4 Je zjevné, že ledviny „ledacos snesou“, a bývá chybou nepodat dostatečnou dávku diuretik v obavě ze zhoršení renální dysfunkce – nedostačená dekongesce totiž ovlivňuje prognózu více. Příčinou zhoršené funkce ledvin u CHSS není ani tolik hypoperfuze jako zvýšený tlak žil vedoucí k renální kongesci a tento parametr je právě diuretiky příznivě ovlivněn. Diuretika jsou popelkou kardiovaskulární farmakoterapie a bývají obvykle považována za méně důležité léky neovlivňující prognózu CHSS, ačkoliv tato otázka nebyla nikdy patřičně testována.5 Nedávné studie využívající agresivnější adaptabilní diuretickou léčbu řízenou dle tlaku v plicnici odečítaného implantovaným senzorem (studie COMPASS, GUIDE‑IT) ukázaly pokles počtu hospitalizací pro srdeční selhání a ukazují nevyužitý potenciál diuretické léčby.6
Zhoršení funkce ledvin taktéž vyvolávají antagonisté renin‑angiotenzinového systému (RAS), tedy inhibitory angiotenzin konvertujícího enzymu (ACE) sakubitril/valsartan, blokátory angiotenzinového receptoru (ARB) či antagonisté mineralokortikoidních receptorů (MRA). Farmaky navozené zhoršení bývá obvykle malé a je prognosticky nevýznamné, pokud ovšem není projevem nerozpoznaného renovaskulárního postižení. Nové doporučené postupy ESC (European Society od Cardiology, Evropská kardiologická společnost) pro léčbu CHSS (Supplementary tables 2–6) poskytují dobrý návod na to, jak titrovat blokádu RAS u pacientů s hraniční funkcí ledvin, jaké zhoršení lze tolerovat a jakými postupy pacienty udržet na léčbě. Často může pomoci vysazení souběžné nefrotoxické medikace (nesteroidní antiflogistika, sulfonamidy), snížení dávky kličkových diuretik nebo přechodná redukce antagonistů RAS trvající do odeznění příčiny vyvolávající pokles glomerulární filtrace (GFR), jako je infekce či expozice kontrastní látce. Pokud u pacienta s CHSS uvažujeme o přerušení blokády RAS, musíme si vždy uvědomit, že pacienti s CHSS bez neurohumorálních antagonistů mají o 44 % vyšší riziko dekompenzace či úmrtí v následujícím roce,8 neuvážené vysazení těchto léků může přispět k nepříznivé prognóze těchto nemocných.
Extrémně zajímavou lékovou skupinou ovlivňující kardiorenální interakce jsou inhibitory sodíko‑glukózového kotransportéru 2 (SGLT2) neboli glifloziny. Tyto léky navozující glykosurii zlepšují kompenzaci diabetu, ale též zpomalují progresi renální insuficience a mají současně kardioprotektivní účinek vedoucí k redukci rizika vzniku či progrese CHSS (včetně srdečního selhání se zachovanou ejekční frakcí [heart failure with preserved ejection fraction, HFpEF]) bez ohledu na přítomnost diabetu.9 Nefroprotektivní a kardioprotektivní efekty gliflozinů jsou vzájemně aditivní10 a nelze je vysvětlit antihyperglykemickým či diuretickým účinkem. Zřejmě nejvíce se uplatňuje hemokoncentrace, osmotická dekongesce extravaskulárního kompartmentu, zvýšení hodnoty hematokritu a tkáňové dodávky kyslíku,11 jakož i efekt na obnovení tubuloglomerulární zpětné vazby a efekt na substrátový metabolismus v podobě zvýšené jaterní ketogeneze.
Doporučené postupy pro léčbu srdečního selhání, jež právě vydala ESC, zařadily inhibitory SGLT2 do základní čtyřkombinace léků „Fabulous Four“, která by měla být u pacientů s CHSS zavedena (obr. 2), což představuje malou revoluci ve farmakoterapii srdečního selhání.7
OBR. 2 Základní čtyřkombinace farmakoterapie srdečního selhání se sníženou ejekční frakcí podle nových guidelines ESC 2021.
Dalším slibným přípravkem, který příznivě ovlivňuje kardiorenální interakce, je nový nesteroidní MRA finerenon. Jak ukázala právě publikovaná studie FIGARO‑DKD, tento přípravek díky příznivým farmakokinetickým vlastnostem zásadně méně často vyvolává hyperkalemii, a přitom prokazatelně zpomaluje progresi diabetické nefropatie a současně snižuje kardiovaskulární morbiditu, a to hlavně díky nižšímu výskytu srdečního selhání de novo.12 Je tedy potenciálně vhodným lékem u starších osob s vrozenými srdečními vadami (congenital heart diseases, CHD) a diabetem – tedy pro populaci nemocných, u kterých se typicky vyskytuje HFpEF. Efekt finerenonu na kardiovaskulární příhody u pacientů s HFpEF je v současnosti testován v rozsáhlé studii FINEARTS. Dalším lékem, který v blízké budoucnosti rozšíří léčebné možnosti u pacientů s CHSS a CKD, je vericiguat – stimulátor solubilní guanylátcyklázy, který aktivuje signální cestu oxidu dusnatého. Tento přípravek, speciálně vyvinutý pro pacienty se srdečním selháním, má převažující antiproliferativní a antihypertrofické účinky, minimální hypotenzní účinek a lze jej použít i při významné redukci GFR (až do eGFR > 15 ml/min/1,73 m2). Léčba vericiguatem vedla v populaci pacientů se závažným progredujícím srdečním selháním k poklesu rizika hospitalizace a může představovat novou alternativu pro pacienty s CHSS trpící pokročilým kardiorenálním postižením, u kterých konvenční inhibice RAS musí být redukována či vysazena pro hypotenzi či pokles GFR.13
Renální selhání doprovázené srdečním selháním
Skupinou, o které se píše daleko méně a u níž téměř neexistují randomizované studie, jsou pacienti z opačného konce kardiorenálního spektra, kteří mají jako hlavní diagnózu terminální stadium selhání ledvin (end‑stage renal disease, ESRD) a u nichž později došlo k rozvoji srdečního selhání.14
Diagnóza CHSS je i u těchto pacientů s ESRD postavena na typických obtížích, klinických známkách a evidenci o systolické či diastolické dysfunkci srdce při echokardiografickém vyšetření. Často je ale obtížné až nemožné odlišit hypervolemii z důvodu srdečního selhání od hypervolemie z renálních příčin. Nelze se spolehnout na natriuretické peptidy, jejichž hodnoty jsou při ESRD zvýšeny i u pacientů bez srdečního selhání, i když změna trendu má jistou výpovědní hodnotu. Ne všichni pacienti s CHSS mají sníženou ejekční frakci levé komory, protože až polovina pacientů má srdeční selhání se zachovanou ejekční frakcí; nepřítomnost snížené ejekční frakce levé komory nevylučuje srdeční selhání.
Odstranění vyvolávající příčiny je nejlepším způsobem léčby srdečního selhání. Etiologicky je při CHSS doprovázejícím ESRD nutno myslet na časnou a rychle progredující koronární aterosklerózu, časný výskyt kalcifikačně‑degenerativních chlopenních vad (aortální stenóza, mitrální insuficience), neblahý vliv rychlé fibrilace síní či tlakové přetížení myokardu nekontrolovanou hypertenzí a hypervolemií, jež vedou k hypertrofii myokardu. Tyto procesy jsou potenciálně ovlivnitelné farmaky, úpravou dialýzy či intervenčním výkonem na srdci.
Část pacientů v chronickém dialyzačním programu má i přes pravidelnou dialýzu trvalou hypervolemii, a to v důsledku nevhodně nastavené suché váhy, neefektivní dialýzy nebo v důsledku non‑compliance. Chronická uremie či neefektivní dialýza mohou vést k poklesu systolické funkce levé komory, která je ale často reverzibilní prodloužením dialýzy, zvýšením frekvence dialýz či korekcí dysfunkce atrioventrikulárního (AV) zkratu. U některých pacientů s pokročilým CKD a CHSS může retence vody představovat větší problém než retence dusíkatých látek; nezvládnutá dlouhodobá hypervolemie může vyvolat dysfunkci jater a gastrointestinálního traktu a vést ke kardiální kachexii. Časné zahájení dialýzy může situaci rapidně zlepšit.
Léčba inhibitory RAS po zahájení dialýzy může zlepšit kontrolu hypertenze a vést k ústupu projevů srdečního selhání. Koronární ateroskleróza je ovlivnitelná chirurgickou či perkutánní revaskularizací. U chlopenních vad nabývají na významu perkutánní korekce vad pomocí transkatétrové náhrady aortální chlopně (TAVI), jejíž životnost se blíží chirurgicky implantovaným chlopním, použití mitrální svorky (MitraClip) u některých typů mitrální regurgitace nebo nově použití u minimálně invazivní implantace mitrální náhrady.
U pacientů se založeným AV zkratem může shunt během doby spontánně dilatovat (často až po provedené transplantaci ledviny), vést k hyperkinetické cirkulaci a postupně navodit srdeční selhání s vysokým výdejem, které, pokud není léčeno, má stejně nepříznivou prognózu jako srdeční selhání s nízkým výdejem.15 Při tomto typu srdečního selhání je systolická funkce levé komory často zcela normální, ale hodnoty srdečního výdeje, které lze změřit i neinvazivně z průtoku aortální chlopní, jsou zvýšené (srdeční index ≥ 4 l/min). Hyperkinetická cirkulace vede k abnormální distribuci srdečního výdeje mezi orgány, k relativní hypoperfuzi ledvin, ke vzniku plicní hypertenze, k dysfunkci pravé komory a k rozvoji symptomů; tyto nálezy bývají řešitelné reverzibilní redukcí nebo uzavřením píštěle.16
Protože většina pacientů s ESRD zemře na kardiovaskulární komplikace, aktivní řešení srdečního problému, včetně CHSS, může zásadně prodloužit život těchto nemocných. Tato skupina pacientů nesmírně profituje ze spolupráce nefrologa s poučeným kardiologem, který se ale musí orientovat v problematice nefrologie, v technikáliích léčby ESRD, cévních zkratů a kardiálních komplikací dialýzy.17 Bylo by velmi prospěšné pro oba obory, kdyby se oblast kardionefrologie dále rozvíjela a kardiorenální poradny vznikaly ve většině českých kardiocenter.
Literatura
- Táborský M, Skála T, Lazárová M, et al. Trends in the treatment and survival of heart failure patients: a nationwide population‑based study in the Czech Republic. ESC Heart Fail 2021 Aug 19. doi: 10.1002/ehf2.13559. Epub ahead of print.
- Heywood JT, Fonarow GC, Costanzo MR, et al. High prevalence of renal dysfunction and its impact on outcome in 118,465 patients hospitalized with acute decompensated heart failure: a report from the ADHERE database. J Card Fail 2007;13:422–430.
- Felker GM, Lee KL, Bull DA, et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med 2011;364:797–805.
- Metra M, Davison B, Bettari L, et al. Is worsening renal function an ominous prognostic sign in patients with acute heart failure? The role of congestion and its interaction with renal function. Circ Heart Fail 2012;5:54–62.
- Ellison DH, Felker GM. Diuretic Treatment in Heart Failure. N Engl J Med 2017;377:1964–1975.
- Lindenfeld J, Zile MR, Desai AS, et al. Haemodynamic‑guided management of heart failure (GUIDE‑HF): a randomised controlled trial. Lancet 2021 Aug 26:S0140‑6736(21)01754‑2. doi: 10.1016/S0140‑6736(21)01754‑2. Epub ahead of print.
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021 Aug 27:ehab368. doi: 10.1093/eurheartj/ehab368. Epub ahead of print.
- Gilstrap LG, Fonarow GC, Desai AS, et al. Initiation, Continuation, or Withdrawal of Angiotensin‑Converting Enzyme Inhibitors/Angiotensin Receptor Blockers and Outcomes in Patients Hospitalized With Heart Failure With Reduced Ejection Fraction. J Am Heart Assoc 2017;6:e004675.
- Zannad F, Ferreira JP, Pocock SJ, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta‑analysis of the EMPEROR‑Reduced and DAPA‑HF trials. Lancet 2020;396:819–829.
- Zelniker TA, Wiviott SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta‑analysis of cardiovascular outcome trials. Lancet 2019;393:31–39.
- Inzucchi SE, Zinman B, Fitchett D, et al. How Does Empagliflozin Reduce Cardiovascular Mortality? Insights From a Mediation Analysis of the EMPA‑REG OUTCOME Trial. Diabetes Care 2018;41:356–363.
- Pitt B, Filippatos G, Agarwal R, et al. FIGARO‑DKD Investigators. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. N Engl J Med 2021 Aug 28. doi: 10.1056/NEJMoa2110956. Epub ahead of print.
- Armstrong PW, Pieske B, Anstrom KJ, et al. Vericiguat in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2020;382:1883–1893.
- Rangaswami J, Bhalla V, Blair JEA, et al. Cardiorenal Syndrome: Classification, Pathophysiology, Diagnosis, and Treatment Strategies: A Scientific Statement From the American Heart Association. Circulation 2019;139:e840–e878.
- Reddy YNV, Melenovsky V, Redfield MM, et al. High‑Output Heart Failure: A 15‑Year Experience. J Am Coll Cardiol 2016;68:473–482.
- Reddy YNV, Obokata M, Dean PG, et al. Long‑term cardiovascular changes following creation of arteriovenous fistula in patients with end stage renal disease. Eur Heart J 2017;38:1913–1923.
- Malík J a kol. Úvod do kardionefrologie. Praha: Maxdorf, 2018
- Kategorie: Přehledové články
- Klíčová slova: chronické onemocnění ledvin; kardionefrologie; kardiorenální syndrom; srdeční selhání