Jak dlouho přetrvává imunitní odpověď po prodělané infekci SARS CoV 2 u dialyzovaných nemocných?
Clarke CL, Prendecki M, Dhutia A, et al. Longevity of SARS‑CoV‑2 immune responses in hemodialysis patients and protection against reinfection. Kidney Int 2021;99:1470–1477.
Při současné pandemii SARS‑CoV‑2 byla onemocněním postižena značná část pacientů s terminálním stadiem selhání ledvin (end‑stage kidney disease, ESKD) léčených v rámci hemodialyzačních středisek (in‑center haemodialysis, IC‑HD), přičemž průběh onemocnění byl často spojen s velmi nepříznivou prognózou v porovnání s běžnou populací. Proto je mimořádně důležité se u těchto pacientů cíleně zaměřit na možnosti preventivních a léčebných opatření. Po prodělané infekci se často vyvíjejí cirkulující protilátky proti SARS‑CoV‑2 i u pacientů s asymptomatickým průběhem. V současnosti však není zřejmé, jaká je u této populace délka trvání detekovatelné imunitní odpovědi na infekci a zda přítomnost protilátek proti SARS‑CoV‑2 má protektivní účinek proti reinfekci. V této studii byl sledován longitudinální sérologický status široké kohorty pacientů léčených v rámci IC‑HD.
Cílem studie bylo porovnat dobu přetrvávání protilátek proti různým antigenním cílům SARS‑CoV‑2, konkrétně proti nukleokapsidovému proteinu (anti‑NP) a proti receptor vázající doméně spikového proteinu (anti‑RBD) po prodělané infekci. U pacientů, u kterých došlo k vymizení protilátkové odpovědi, byla také zkoumána celulární imunitní odpověď. Konečně byla posuzována míra protekce, kterou poskytuje imunitní odpověď způsobená infekcí SARS‑CoV‑2 proti následné reinfekci.
Do souboru bylo zařazeno celkem 356 pacientů léčených IC‑HD ve dvou londýnských centrech. Pacienti byli sledováni v období od 24. února 2020 do 1. ledna 2021. Všechny vzorky (n = 356) byly v čase 0 testovány na přítomnost anti‑NP a anti‑RBD protilátek. Po šesti měsících (6 M) byly všechny dostupné vzorky (n = 301) retestovány na přítomnost anti‑NP (komerčně dostupná imunoesej společnosti Abbott), a navíc byly vybrané vzorky (u anti‑NP+ pacientů v době 6 M, pacientů s nejednoznačným výsledkem anti‑NP či anti‑NP– pacientů v době 6 M, kteří však byli anti‑NP+ a/nebo anti‑RBD+ v době 0) retestovány na přítomnost anti‑RBD (imunoesej Imperial SARS‑CoV‑2 Hybrid DABA). V případě detekce protilátek anti‑NP a anti‑RBD byly stanoveny hodnoty, resp. index protilátek. Klinický průběh, včetně zaznamenání nových infekcí SARS‑CoV‑2, potvrzených detekcí viru reverzní polymerázovou řetězovou reakcí (PCR) z výtěrů z nazofaryngu, byl sledován do 1. ledna 2021. U pacientů, kteří se stali po 6 M séronegativními jak na přítomnost anti‑NP, tak anti‑RBD, byl proveden screening zaměřený na specifickou T buněčnou odpověď proti SARS‑CoV‑2 (za použití eseje T‑SPOT Discovery SARS‑CoV‑2).
Výsledky ukázaly, že v čase 0 mělo 129/356 (36 %) pacientů prokazatelné anti‑NP (anti‑NP+) protilátky, přičemž 127 z uvedených 129 anti‑NP+ pacientů mělo také prokazatelné anti‑RBD (anti‑RBD+) protilátky (tab. 1). Rozpor mezi detekcí protilátek anti‑NP a anti‑RBD byl zjištěn pouze u 9/356 (0,3 %) pacientů. Hodnoty anti‑NP a anti‑RBD protilátek v čase 0 byly významně vyšší u pacientů, kteří byli symptomatičtí, ve srovnání s pacienty asymptomatickými. Po šesti měsících byly k dispozici vzorky od 301 pacientů, z toho 190 ve skupině pacientů původně anti‑NP– a 111 ve skupině původně anti‑NP+. Ve skupině 190 pacientů, kteří byli anti‑NP– v čase 0, došlo po 6 M u šesti (3,2 %) pacientů k sérokonverzi na anti‑NP+, přičemž u tří z šesti pacientů byla v mezidobí prokázaná infekce SARS‑CoV‑2 potvrzena metodou PCR. Po 6 M došlo k významnému snížení počtu pacientů původně séropozitivních – v této skupině mělo 71/111 (64 %) pacientů nadále prokazatelné anti‑NP, resp. 99/116 (85,3 %) pacientů mělo prokazatelné anti‑RBD protilátky. Sérologická pozitivita anti‑RBD měla prokazatelně delší dobu trvání (p = 0,0002) než sérologická pozitivita anti‑NP. U pacientů, kteří byli nadále séropozitivní, došlo po šesti měsících k významnému poklesu hodnot jak anti‑NP, tak anti‑RBD protilátek. U 11 pacientů, kteří byli anti‑NP séropozitivní v čase 0, nebyly prokazatelné protilátky po šesti měsících; z toho u 8/11 byla prokazatelná T buněčná odpověď proti SARS‑CoV‑2. Z hlediska klinického dopadu imunitní odpovědi získané po infekci SARS‑CoV‑2 byla u pacientů se vstupní SARS‑CoV‑2 sérologickou pozitivitou (jak anti‑NP, tak anti‑RBD protilátek) významně nižší pravděpodobnost průkazu infekce metodou PCR v následujících šesti měsících. Z uvedených údajů vyplývá, že u většiny pacientů léčených v rámci IC‑HD se po prodělané SARS‑CoV‑2 vyvíjí imunitní odpověď přetrvávající nejméně po dobu šesti měsíců a pouze 3 % pacientů nevykazují známky humorální, ale ani celulární imunity.
Závěrem autoři konstatují, že bylo prokázáno, že imunitní odpověď na prodělanou infekci SARS‑CoV‑2 přetrvává u velké většiny pacientů léčených IC‑HD nejméně 6 M, a to i u pacientů, kteří prodělali mírnou či asymptomatickou infekci. Tato imunitní odpověď přispívá ke snížení rizika infekce, resp. reinfekce ve střednědobém horizontu, což může být klinicky významné např. v období před podáním vakcíny proti SARS‑CoV‑2. Autoři zdůrazňují, že se jedná o první práci, která se věnovala longitudinálnímu sledování sérologického statusu mimořádně ohrožené skupiny pacientů. Určitý nedostatek spatřují především v tom, že nebylo možno stanovit virovou zátěž a virovou genotypizaci u pacientů s prodělanou infekcí SARS‑CoV‑2.
Komentář
- Prof. MUDr. Romana Ryšavá, CSc., Klinika nefrologie 1. LF UK a Všeobecné fakultní nemocnice v Praze
Literatura
- Clarke CL, Prendecki M, Dhutia A. Longevity of SARS‑CoV‑2 immune responses in hemodialysis patients and protection against reinfection. Kidney Int 2021;99:1470–1477.
- Alcázar‑Arroyo R, Portolés J, López‑Sánchez P, et al. Rapid decline of anti‑SARS‑CoV‑2 antibodies in patients o haemodialysis: the COVID‑FRIAT study. Clin Kidney J 2021;14:1835–1844.
- Ikizler TA, Coates PT, Rovin BH, et al. Immune response to SARS‑CoV‑2 infections and vaccination in patients receiving kidney replacement therapy. Kidney Int 2021;99:1275–1279.
- Forbes S, Davari M, Gnanasampanthan S. Persistence of antibody response to SARS‑CoV‑2 in a cohort of haemodialysis patients with COVID‑19. Nephrol Dial Transplant 2021 Mar 15:gfab066. doi: 10.1093/ndt/gfab066. Epub ahead of print.
- Anft M, Blazquez‑Navarro A, Paniskaki K. SARS‑CoV‑2–reactive cellular and humoral immunity in hemodialysis population. Kidney Int 2021;99:1489–1490.
- Torreggiani M, Blanchi S, Fois A. Neutralizing SARS‑CoV‑2 antibody response in dialysis patients after the first dose of the BNT162b2 mRNA COVID‑19 vaccine: the war is far from being won. Kidney Int 2021;99:1494–1496.
- Billany RE, Selvaskandan H, Adenwalla SF. Seroprevalence of antibody to S1 spike protein following vaccination against COVID‑19 in patients on hemodialysis: a call to arms. Kidney Int 2021;99:1492–1494.
- Attias P, Sakhi H, Rieu P. Antibody response to the BNT162b2 vaccine in maintenance hemodialysis patients. Kidney Int 2021;99:1490–1492.
- Simon B, Rubey H, Treipl A, et al. Hemodialysis patients show a highly diminished antibody response after COVID‑19 mRNA vaccination compared to healthy controls. Nephrol Dial Transplant 2021 May 17:gfab179. doi: 10.1093/ndt/gfab179. Epub ahead of print.
- Berar Yanay N, Freiman S, Shapira M. Experience with SARS‑CoV‑2 BNT162b2 mRNA vaccine in dialysis patients. Kidney Int 2021;99: 1496–1498.
- Boyarsky BJ, Werbel WA, Avery RK. Immunogenicity of a single dose of SARS‑CoV‑2 messenger RNA vaccine in solid organ transplant recipients. JAMA 2021;325:1784–1786.
- Benotmane I, Gautier‑Vargas G, Cognard N. Weak anti–SARS‑CoV‑2 antibody response after the first injection of an mRNA COVID‑19 vaccine in kidney transplant recipients. Kidney Int 2021;99:1487–1489.
- Benotmane I, Gautier‑Vargas G, Cognard N. Low immunization rates among kidney transplant recipients who received 2 doses of the mRNA‑1273 SARS‑CoV‑2 vaccine. Kidney Int 2021;99:1498–1500.
- Speer C, Morath C, Töllner M, et al. Humoral responses to single‑dose BNT132b2 mRNA vaccination in dialysis patients previously infected with SARS‑CoV‑2. Front Med (Lausanne) 2021;8:721286. doi: 10.3389/fmed.2021.721286.
- Kategorie: Komentované články
- Klíčová slova: COVID-19; dialyzační léčba

Pandemie SARS‑CoV‑2 představuje pro nefrology mimořádnou výzvu jak po stránce klinické, tak výzkumné. Komentovaná studie je jednou z prvních, která se systematicky zabývá imunitní odezvou na infekci SARS‑CoV‑2 u pacientů léčených hemodialýzou. Výsledky studie naznačují, že prodělaná infekce SARS‑CoV‑2 navozuje poměrně robustní imunitní odpověď, pokud je tato odpověď hodnocena komplexněji, s ohledem na její různé komponenty. Lze považovat za velkou přednost komentované studie, že byly posuzovány nejen protilátkové produkce proti dvěma odlišným antigenním strukturám SARS‑CoV‑2 (NP, RBD), ale že získané nálezy byly doplněny o údaje týkající se celulární imunitní odpovědi. Ačkoliv korelace mezi sérologickou produkcí anti‑NP a anti‑RBD byla ve studii vysoká, ukázalo se, že imunitní odpověď proti RBD je ve srovnání s tvorbou anti‑NP protilátek intenzivnější. Observační charakter studie neumožnil získat některé přesnější klinické či laboratorní údaje, které by jistě mohly přispět k lepšímu chápání klinicko‑laboratorních korelací. Je například poněkud překvapivé, že ve skupině pacientů, kteří byli při vstupu do studie (v době 0) anti‑NP– (n = 227), došlo po 6 M k sérokonverzi na anti‑NP+ pouze u šesti (0,3 %) pacientů, a to přesto, že infekce SARS‑CoV‑2 byla potvrzena PCR nejméně u 30 pacientů. To může případně ukazovat na skutečnost, že určitá část této populace nemocných není schopna si vytvořit protilátky ani po opakovaném vystavení infekci.
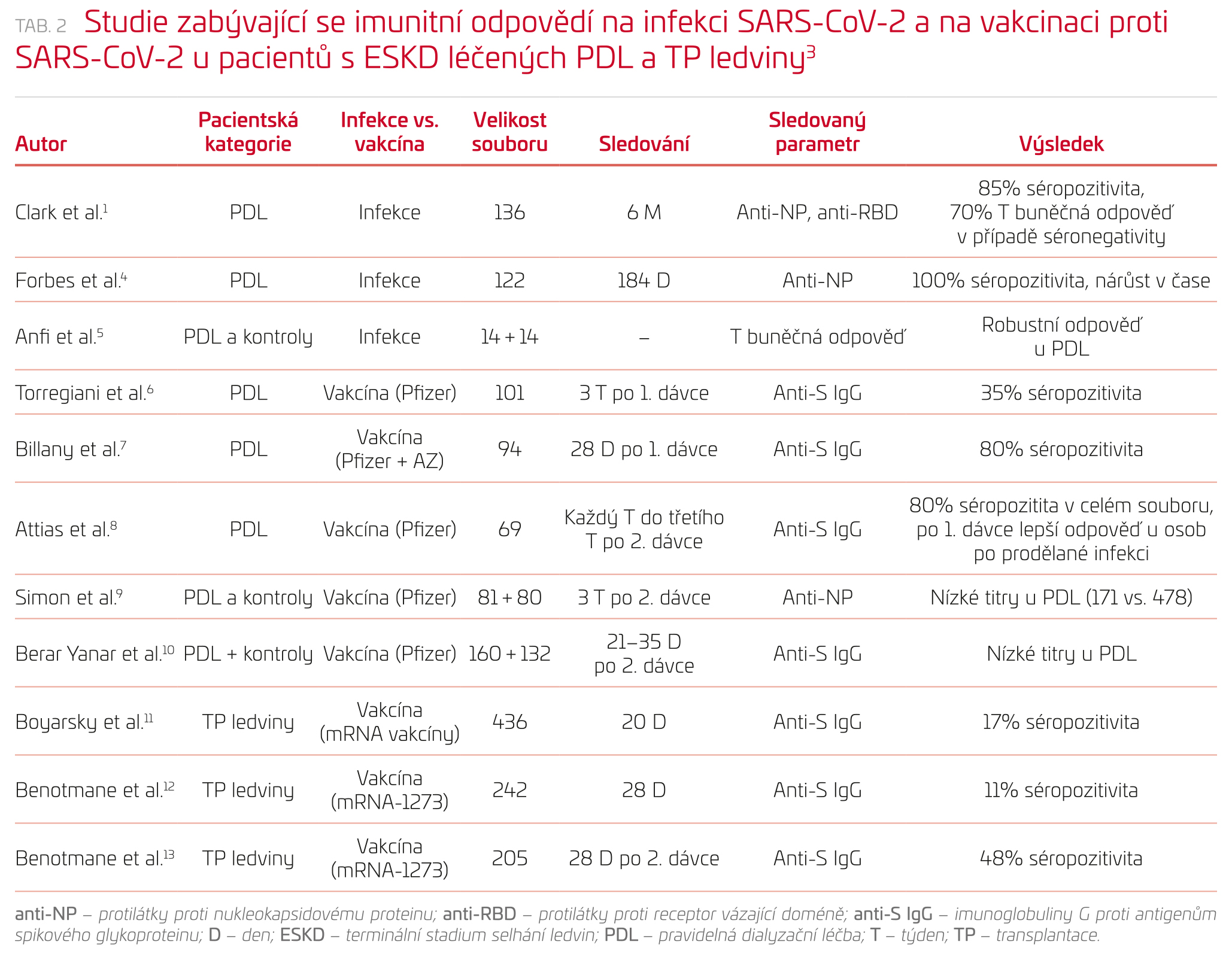
Je zajímavé, že prakticky ke stejnému datu publikace komentované studie1 byla publikována COVID‑FRIAT,2 studie, jež řeší prakticky totožné téma, tedy délku přetrvávání anti‑SARS‑CoV‑2 protilátek u pacientů léčených IC‑HD a infikovaných SARS‑CoV‑2; její závěry jsou ale poněkud odlišné. Do studie COVID‑FRIAT bylo v období od 1. března do 15. dubna 2020 primárně zařazeno 808 pacientů z 10 madridských IC‑HD, kteří byli sledováni pro klinické a laboratorní projevy infekce SARS‑CoV‑2 a u nichž bylo vstupně a pak po čtyřech týdnech (4 T) provedeno vyšetření protilátek proti SARS‑CoV‑2 (použita ELISA esej Vircell s antigeny ze spikového glykoproteinu a z NP). Vstupně bylo se symptomatickou infekcí COVID‑19 (PCR+) diagnostikováno 136/808 (16,8 %) pacientů, z nichž 42 zemřelo; 69/91 (75,8 %) přeživších symptomatických pacientů mělo pozitivní protilátky, přičemž po dalších 4 T se 10/65 (15,4 %) pacientů stalo negativními. U nemocných asymptomatických z hlediska COVID‑19 mělo vstupně 9/672 (1,3 %) pacientů PCR+ a 101/672 (15 %) pacientů mělo prokázánu pozitivitu protilátek. Po 4 T došlo v této skupině k vymizení protilátek u 72,1 % pacientů. Celkově se adekvátní sérologická odpověď (definovaná jako pozitivní protilátky přetrvávající po 4 T od infekce COVID‑19) prokázala u 54/60 (90 %) symptomatických pacientů a u 21/40 (52,5 %) pacientů s asymptomatickým průběhem. Pokud tedy vezmeme v úvahu skutečnost, že ve studii COVID‑FRIAT se zásadní útlum protilátkové produkce týkal především asymptomatických pacientů, spočívá významná slabina tvrzení o rychlém vymizení protilátek v období 4 T od jejich přechozího stanovení především ve skutečnosti, že z uspořádání studie nelze vyvodit, v jakém odstupu od (asymptomaticky) prodělané infekce SARS‑CoV‑2 se pacienti nacházeli v době stanovení protilátek; pacienti navíc byli sledováni jen po krátkou dobu. Ikizler a spol.3 zasadili komentovanou práci Clarka a spol.1 do širšího rámce současných poznatků o imunitní odpovědi na infekci SARS‑CoV‑2 a na vakcinaci proti SARS‑CoV‑2 u pacientů s ESKD léčených pravidelnou dialýzou a transplantací (TP) ledviny (tab. 2). Předběžné výsledky naznačují, že u těchto pacientů se imunitní odpověď na infekci SARS‑CoV‑2 a na vakcinaci postupně vyvíjí, a byť tato odpověď nemusí být okamžitá, může narůstat v čase.4 Dále je třeba připustit, že publikované údaje nás dostatečně neinformují o tom, zda imunitní odpověď u pacientů s ESKD je srovnatelná s imunitní odpovědí osob bez onemocnění ledvin. V této souvislosti je třeba si uvědomit, že velká část pacientů s ESKD má další komorbidity, které mohou významně ovlivnit jejich imunitní reakce, takže za odlišnou imunitní aktivitu pacientů s ESKD nemusí být vždy odpovědné samotné onemocnění ledvin. Zatímco v prvních publikovaných studiích byly často použity metody hodnotící pouze vybrané úseky imunitní odpovědi (např. stanovení tvorby celkového imunoglobulinu G proti antigenům spikového glykoproteinu), perspektivní cestu představuje komplexní imunofenotypizace pacienta, která postihuje jednotlivé složky humorální, ale i celulární odpovědi. Konečně z hlediska účinnosti vakcinace u pacientů léčených dialýzou a po TP ledviny je třeba získat ucelenější data o vývoji humorální reakce po podání vakcín. Neuspokojivá humorální imunitní reakce byla pozorována nejen po podání jedné dávky vakcíny,6,8,9,11 ale i po podání dvou dávek vakcíny.13 Naopak velmi dobrá imunitní odpověď se ukázala u nemocných, kteří infekci SARS‑CoV‑2 prodělali a kteří byli následně vakcinováni, byť jen jednou dávkou vakcíny.14 U této populace nemocných byly koncentrace protilátek anti‑S1 IgG 15–34× vyšší než u jedinců po prodělané infekci bez vakcinace či u jedinců vakcinovaných, kteří infekci neprodělali. Všechny tyto nálezy by měly nepochybně být silným impulsem pro přijetí takové vakcinační strategie pro pacienty s eskd, která by respektovala specifický a mimořádně vulnerabilní charakter této kategorie nemocných. Je zřejmé, že v rámci vakcinačních schémat by pacienti s ESKD měli být očkováni proti SARS‑CoV‑2 velmi brzy, mělo by být dodrženo plné schéma očkování (s přeočkováním v případě potřeby) a měla by být systematicky monitorována jejich imunitní reakce. Závěrem lze, co se týká budoucnosti zvládnutí pandemie SARS‑CoV‑2, zřejmě vyjádřit opatrný optimismus, který můžeme čerpat z nečekaně rychlého vývoje vakcín proti SARS‑CoV‑2 i z jejich rychlé implementace do rutinní praxe, což představuje zásadní přelom v boji proti SARS‑CoV‑2.