Statinem indukovaná rhabdomyolýza s akutním renálním poškozením
Úvod
Statiny jsou lékem první volby ke snížení sérové koncentrace cholesterolu v rámci primární a sekundární prevence kardiovaskulárních onemocnění.
Statiny jsou efektivní a obecně bezpečné. Jejich vzácným, ale obávaným nežádoucím účinkem však je svalová toxicita. Těžká myonekróza, která vede ke klinicky významné rhabdomyolýze, je raritní a postihuje asi 0,1 % léčených pacientů.1,2
Patogeneze rozvoje svalové toxicity či se statiny asociovaných svalových symptomů (SAMS) není stále detailněji vysvětlena. Termín SAMS se používá k vyjádření faktu, že tyto příznaky nejsou vždy skutečně způsobeny užíváním statinu. Nicméně v posledních letech došlo k pokroku pochopení některých etiopatogenetických faktorů, včetně výsledků genetických studií.3,4
Kazuistika
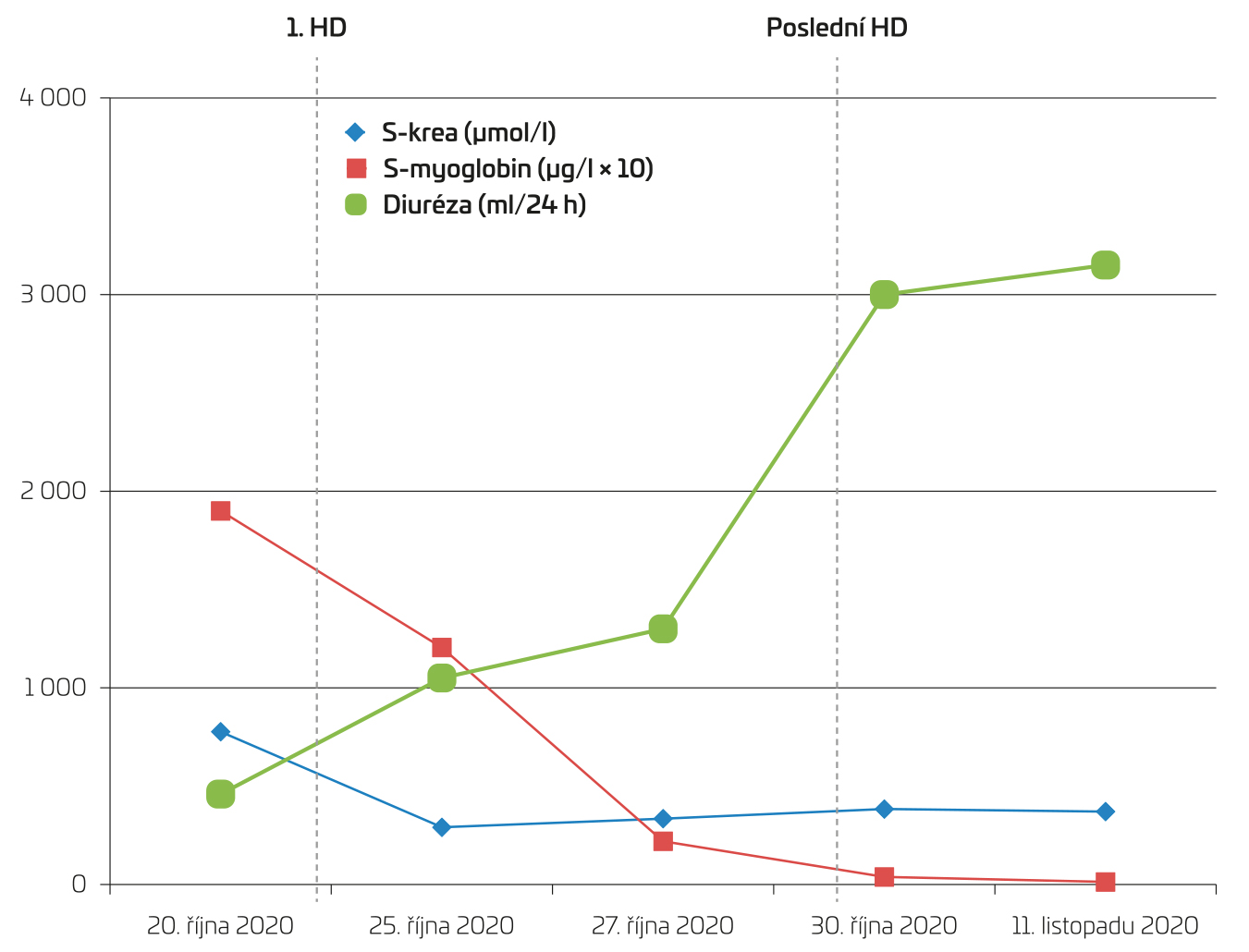
Třiasedmdesátiletá pacientka s anamnézou diabetes mellitus a hyperlipoproteinemie, jinak bez komorbidit, byla ošetřena ambulantní cestou pro týdenní progresi svalové slabosti dolních končetin a neschopnost chůze, nechutenství a sníženou diurézu. Pacientka byla dlouhodobě léčena pouze metforminem a statiny. Původně užívala atorvastatin v dávce 10 mg denně, ale přibližně měsíc před naším prvním vyšetřením byla tato léčba změněna na rosuvastatin v dávce 40 mg denně pro nedostatečný pokles hodnoty LDL‑cholesterolu v séru (s). Laboratorně bylo zjištěno těžké akutní renální poškození s hodnotou kreatininu v séru 832 µmol/l, se sérovou koncentrací myoglobinu zvýšenou na 1 2051 µg/l a s hodnotou kreatinkinázy 18,35 µkat/l, proto byla pacientka odeslána na naše pracoviště a zde hospitalizována na jednotce intezivní nefrologické péče. U pacientky jsme nezjistili žádné jiné rizikové faktory pro vznik rhabdomyolýzy než užívání statinu a iontovou dysbalanci, konkrétně sérové koncentrace sodíku (s‑Na) 126 mmol/l a draslíku (s‑K) 2,7 mmol/l. Neužívala jiné léky, nejevila známky infekce, dehydratace, užívání toxinů včetně alkoholu, nebyla přítomna anamnéza křečí, traumatu ani imobilizace, sérové koncentrace vápníku (s‑Ca), fosforu (s‑P), hořčíku (s‑Mg), chloru (s‑Cl) byly normální. Vstupně po přijetí byla pacientka hypertenzní, afebrilní, její index tělesné hmotnosti (BMI) byl 20,9, s klinicky vyjádřenou svalovou slabostí s maximem na dolních končetinách, s dominujícím postižením proximálního svalstva. U nás změřená sérová koncentrace myoglobinu činila více než 20 000 µg/l, hodnota kreatinkinázy byla vyšší než 130 µkat/l, ALT (alaninaminotransferáza) 11,83 µkat/l, AST (asparátaminotransferáza) 16,57 µkat/l, v močovém sedimentu byla přítomna erytrocyturie neglomerulárního původu, proteinurie (poměr proteinu a kreatininu 677 mg/mmol, měřeno při oligurii), hodnota glykovaného hemoglobinu (HbA1c) činila 54 mmol/mol. Byla laboratorně vyloučena intoxikace metforminem a koncentrace protilátek anti‑3‑hydroxy‑3‑methyl‑glutaryl‑koenzymu A reduktázy (HMGCR) byla v normě. Sonografický nález svědčil pro akutní poškození ledvin. Okamžitě po přijetí byla přerušena léčba metforminem a rosuvastatinem, byla zahájena masivní infuzní hydratační terapie, avšak pro oligurii bylo rozhodnuto o zahájení akutního hemodialyzačního léčení (celkem provedeno osm procedur). Došlo k významnému poklesu hodnot markerů svalového poškození a k rozvoji polyurické fáze akutního renálního poškození (obr. 1).
OBR. 1 Vývoj hodnot sérového kreatininu, myoglobinu a diurézy u pacientky s AKI při rhabdomyolýze.
Upozorňujeme na nezvyklou hodnotu použitou pro potřebu přehlednosti grafu, hodnoty myoglobinu v grafu odpovídají desetinásobně klasické jednotce (μg/l).
AKI – akutní poškození ledvin; HD – hemodialýza; S‑krea – sérová koncentrace kreatininu.
Po stabilizaci stavu byla provedena renální biopsie, která proběhla bez komplikací s histopatologickým nálezem akutní tubulární nekrózy s vločkovitými válci charakteru myoglobinu, diabetické poškození nebylo morfologicky zřetelné. Vzhledem k tomu, že došlo k postupnému obnovení renálních funkcí a panel autoimunitních chorob byl zcela negativní, nebyla zahájena kortikoterapie.
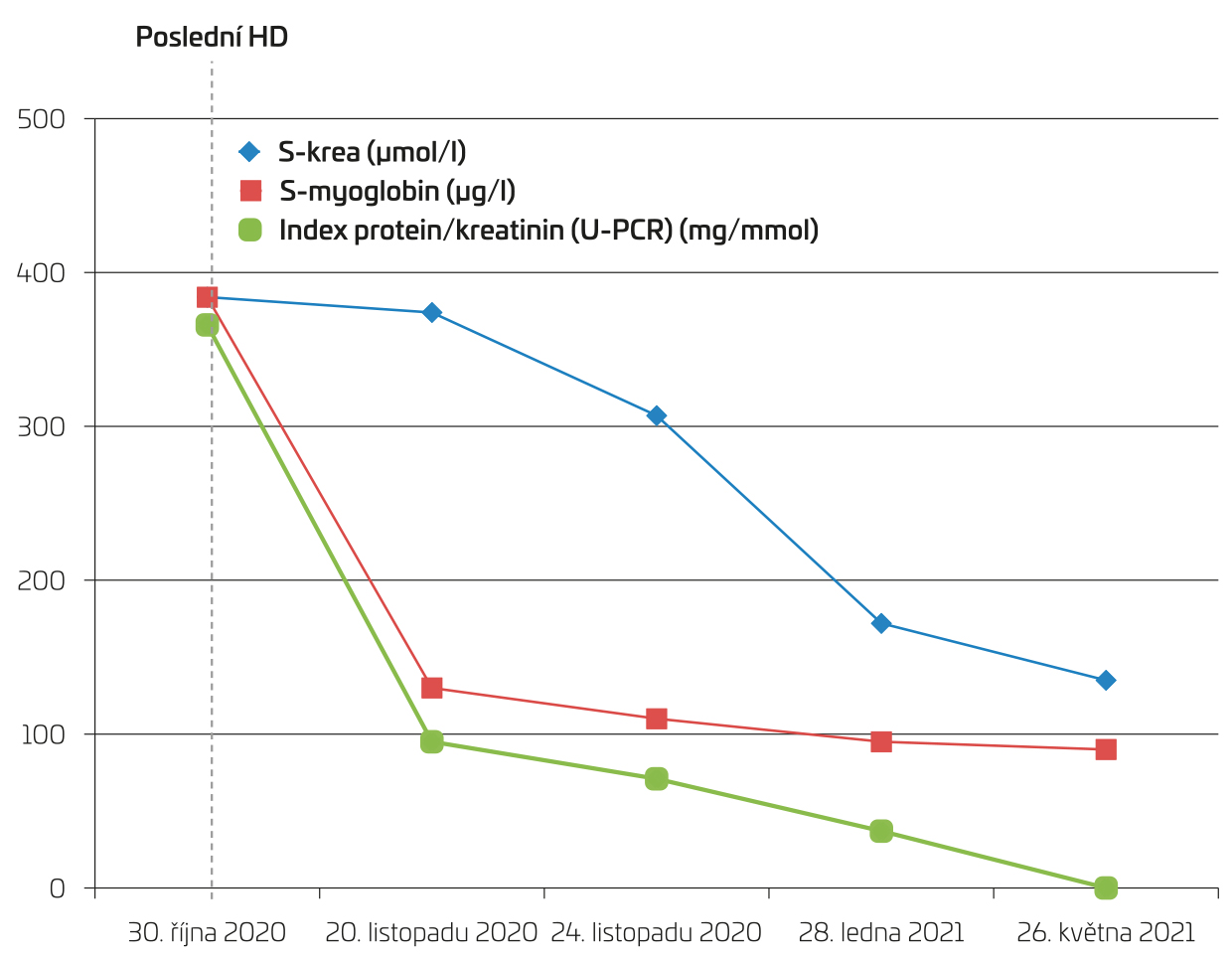
Poslední ambulantní kontrola proběhla za sedm měsíců od prvotní hospitalizace, laboratorní výsledky ukazují přetrvávající příznivý trend se známkami přetrvávající mírné až středně těžké renální dysfunkce (s‑urea 12 mmol/l, s‑kreatinin 135 µmol/l), s‑kreatinkináza je 1,87 µkat/l, s‑myoglobin 90 µg/l, močový sediment je již zcela neaktivní (obr. 2).
OBR. 2 Vývoj hodnot sérového kreatininu, myoglobinu a poměru protein/kreatinin v moči (protein creatinine ratio, U‑PCR) u stejné pacientky při sedmiměsíčním ambulantním sledování.
HD – hemodialýza; S‑krea – sérová koncentrace kreatininu.
Komentář
Literatura
- Grundy SM. Can statins cause chronic low‑grade myopathy? Ann Intern Med 2002;137:617–618.
- Graham DJ, Staffa JA, Shatin D, et al. Incidence of hospitalized rhabdomyolysis in patients treated with lipid‑lowering drugs. JAMA 2004;292:2585–2590.
- Brunham LR, Baker S, Mammen A, et al. Role of genetics in the prediction of statin‑associated muscle symptoms and optimization of statin use and adherence. Cardiovasc Res 2018;114:1073–1081.
- Mammen AL. Statin‑Associated Autoimmune Myopathy. N Engl J Med 2016;374:664–669.
- Mayer O. Je reálný důvod k obavám z bezpečnosti léčby statinem ve vysoké dávce? Med praxi 2017;14:25–27.
- Long B, Koyfman A, Gottlieb M. An evidence‑based narrative review of the emergency department evaluation and management of rhabdomyolysis. Am J Emerg Med 2019;37:518–523.
- Esposito P, Estienne L, Serpieri N, et al. Rhabdomyolysis‑associated acute kidney injury. Am J Kidney Dis 2018;71:A12–A14.
- Norman DJ, Illingworth DR, Munson J, Hosenpud J. Myolysis and acute renal failure in a heart‑transplant recipient receiving lovastatin. N Engl J Med 1988;318:46–47.
- East C, Alivizatos PA, Grundy SM, et al. Rhabdomyolysis in patients receiving lovastatin after cardiac transplantation. N Engl J Med 1988;318:47–48.
- Pierce LR, Wysowski DK, Gross TP. Myopathy and rhabdomyolysis associated with lovastatin‑gemfibrozil combination therapy. JAMA 1990;264:71–75.
- Kategorie: Kazuistiky
- Klíčová slova: akutní renální selhání; rhabdomyolýza; statiny
Terapie statinem je již léta součástí primární prevence kardiovaskulárních onemocnění u rizikových pacientů. Naše pacientka, která v anamnéze měla diabetes mellitus a dyslipidemii, byla oprávněně považována za vysoce rizikovou stran možného rozvoje kardiovaskulárního onemocnění, proto byla správně nasazena terapie statinem a posléze navýšena dávka k dosažení cílové hodnoty LDL‑cholesterolu.
Statiny mají všeobecně excelentní bezpečnostní profil, což potvrdily randomizované studie na statisícových souborech pacientů i metaanalýzy klinických studií. Zdaleka „nejznámějším“ a nejobávanějším nežádoucím účinkem léčby statinem je rhabdomyolýza. Ta může mít těžkou formu charakterizovanou extrémní sérovou koncentrací svalových enzymů a myoglobinu ve spojení s akutním poškozením ledvin a s myoglobinurií. Je to závažný stav, který se naštěstí v souvislosti s léčbou statiny vyskytuje zcela ojediněle. V běžné praxi častěji zjišťujeme mírnější formu tohoto nežádoucího účinku, tzv. statinem indukovanou myozitidu, která je charakterizována jako perzistující svalové bolesti v kombinaci s alespoň desetinásobným zvýšením hodnot svalových enzymů bez poškození ledvin.5
Hlavním terapeutickým postupem u rhabdomyolýzy je expanze intravaskulárního objemu a odstranění základní příčiny. Měla by být zahájena včasná a agresivní objemová resuscitace zaměřená na dosažení diurézy 200–300 ml/h. V současné době neexistují žádné důkazy o tom, že vyvážené krystaloidy jsou v této indikaci lepší než fyziologický roztok, ale volíme je raději, protože fyziologický roztok může přispívat ke vzniku metabolické acidózy, a tím teoreticky ke snížení clearance myoglobinu. Zvažujeme i alkalizaci moči podáváním hydrogenuhličitanu sodného, ačkoli to není založeno na důkazech. Forsírovaná diuréza mannitolem nebo furosemidem se obecně nedoporučuje. Pokud pacient zůstane anurický nebo se u něj rozvinou jiné život ohrožující komplikace akutního poškození ledvin (acute kidney injury, AKI), měla by být zahájena terapie náhradou funkce ledvin (renal replacement therapy, RRT). Obvykle 4–20 % pacientů s AKI v důsledku rhabdomyolýzy vyžaduje RRT.6,7
V publikovaných velkých klinických studiích nebyl u pacientů bez přítomnosti rizikových faktorů zaznamenán výskyt rhabdomyolýzy s AKI. Mezi rizikové faktory rozvoje AKI patří konkomitantní medikace (cyklosporin, gemfibrozil, inhibitory proteázy, glukokortikoidy, niacin, makrolidová antibiotika, digoxin, antifungika, warfarin), preexistující muskulární onemocnění, hypotyreóza, akutní či chronické onemocnění ledvin, cholestatická jaterní onemocnění.8–10
U naší pacientky jsme neodhalili jiný rizikový faktor rhabdomyolýzy než užívání statinu a hypokalemii, která mohla však být již důsledkem akutního tubulárního poškození. Nemůžeme vyloučit genetickou predispozici nebo jiné neznámé individuální rizikové faktory.