Doporučené postupy ČNS a ČHS ČLS JEP pro diagnostiku a léčbu akutního poškození ledvin u jaterní cirhózy
Souhrn
Hepatorenální syndrom (HRS) představuje jednu z nejzávažnějších komplikací péče o pacienty s pokročilou jaterní cirhózou. Během posledního desetiletí došlo k významnému pokroku v diagnostice různých forem akutního poškození ledvin (acute kidney injury, AKI) u jaterní cirhózy, který následně vedl k přehodnocení původních diagnostických kritérií HRS.
Autoři předkládají společnou publikaci doporučených postupů České nefrologické společnosti a České hepatologické společnosti zaměřených na diagnostiku a léčbu akutního poškození ledvin u jaterní cirhózy.
Klíčová slova: AKI – doporučené postupy – hepatorenální syndrom – HRS – jaterní cirhóza
Úvod a terminologie
Hepatorenální syndrom představuje jednu z nejzávažnějších komplikací péče o pacienty s pokročilou jaterní cirhózou se současně se vyskytujícím ascitem. Problematice snížené funkce a poškození ledvin u jaterní cirhózy nebyla v minulosti věnována dostatečná pozornost, a proto se všechny formy deteriorace funkce ledvin shrnovaly pod jednotný pojem hepatorenální syndrom (HRS). Během posledního desetiletí došlo k významnému pokroku v diagnostice různých forem akutního poškození ledvin (acute kidney injury, AKI) u jaterní cirhózy, který následně vedl k přehodnocení původních diagnostických kritérií HRS.
HRS 1. typu byl tradičně definován rychlým rozvojem renálního selhání s velmi špatnou prognózou a vysokou mortalitou, s mediánem přežití jeden měsíc. Původní klasifikace HRS 1. typu byla založena na dosažení konkrétní koncentrace kreatininu v séru (SCr), a tak vedla k opožděné diagnostice renálního poškození při již velmi snížené glomerulární filtraci (SCr ≥ 1,5 mg/dl, resp. SCr ≥ 133 µmol/l odpovídající zhruba eGFR 30 ml/min/1,73 m2, resp. 0,5 ml/s/1,73 m2). Použití absolutních hodnot SCr ke stanovení HRS navíc nezohledňovala premorbidní koncentrace SCr, a tedy stupeň preexistujícího chronického snížení renální funkce.
HRS 2. typu byl naopak charakterizován pozvolným zhoršováním renální funkce a lepší prognózou, typicky u pacientů s refrakterním ascitem. HRS 2. typu však v současné době nereflektuje definici HRS‑AKI, ale řadí se spíše mezi formy chronického onemocnění ledvin (chronic kidney disease, CKD, tedy HRS‑CKD),1 proto se v těchto doporučeních problematice HRS 2. typu nebudeme věnovat.
V současné době došlo u HRS 1. typu ke změně diagnostických kritérií, která lépe zohledňují dynamiku rozvoje, a došlo ke změně terminologie – tento stav by se měl nyní správně nazývat HRS‑AKI, ale v literatuře se i nyní setkáme se starším označením HRS 1. typu.
Akutní poškození ledvin u jaterní cirhózy
AKI je častou komplikací u nemocných s jaterní cirhózou a je popisováno u 20–50 % pacientů přijatých k hospitalizaci pro známky dekompenzace jaterního onemocnění.2 Rozvoj jakékoliv formy AKI u cirhózy je nepochybně spojován s horší prognózou v závislosti na příčině AKI. Může se jednat o AKI se vstupně normální renální funkcí nebo o AKI nasedající na preexistující CKD s již přítomnou sníženou glomerulární filtrací a eventuálně současně s přítomnými známkami parenchymového poškození ledvin, tj. s výskytem glomerulární hematurie či proteinurie. U jaterní cirhózy byl zaznamenán častější výskyt depozice IgA v ledvinách u nefropatie asociované s kryoglobulinemií při chronické hepatitidě C nebo jiných forem chronických onemocnění ledvin vázaných na další, současně přidružená onemocnění (např. diabetické poškození ledvin).
Jednoznačně nejčastější formou AKI u pacientů s jaterní cirhózou je AKI prerenální etiologie, které je přítomno u téměř 70 % těchto případů AKI. Mezi nejčastější vyvolávající faktory patří např. předávkování diuretiky, velkoobjemová paracentéza ascitu bez následné aplikace albuminu, krvácení do gastrointestinálního systému, bakteriální infekce. Samozřejmě se AKI může vyvinout i v souvislosti s běžnými typy dehydratace, např. při průjmu, febrilním stavu, vysokých zevních teplotách atd.
Po AKI z prerenálních příčin je další častou příčinou AKI na podkladě akutní tubulární nekrózy (ATN). ATN je nejčastěji způsobena ischemickým poškozením tubulů následkem hypotenze (tzv. postischemická ATN), např. z důvodu proběhlého krvácení z jícnových varixů nebo sepse. Klinická manifestace je velmi podobná HRS‑AKI, a tak rutinní vyšetření velmi často tyto dvě klinické jednotky neodliší. V této souvislosti stoupá zájem o studie zkoumající úlohu močových biomarkerů v diferenciální diagnostice AKI.
AKI jako projev hepatorenálního syndromu (HRS‑AKI) tvoří menšinu forem AKI u jaterní cirhózy (8–12 % případů), která je spojena se sekundárně navozenou vazokonstrikcí v ledvinách, jež vzniká v důsledku komplexních cirkulačních změn spojených s portální hypertenzí.
V současné době je v hepatologii velká pozornost věnována problematické klinické jednotce akutního zhoršení chronického jaterního selhání – acute‑on‑chronic liver failure (ACLF). ACLF je charakterizováno akutním jaterním selháním a současně přítomným jedním nebo vícečetným extrahepatálním orgánovým selháním, jež vzniká v důsledku dysregulace imunitní odpovědi na známý či dosud nepoznaný spouštěcí faktor, dále se současným podílem systémové zánětlivé reakce. Přítomnost AKI je jednou ze součástí definice ACLF, nejčastějším samostatným orgánovým postižením a hlavní komponentou v hodnocení závažnosti ACLF. Stupeň renální dysfunkce u ACLF koreluje s hodnotami prozánětlivých mediátorů interleukinu 6 (IL‑6), interleukinu 8 (IL‑8), naopak nereflektuje koncentraci plazmatického reninu, markeru poruchy v systémové cirkulaci. Tyto nálezy potvrzují klíčovou úlohu zánětu v patogenezi ACLF.3
Hodnocení renální funkce u jaterní cirhózy a biomarkery AKI
Výpočet odhadu glomerulární filtrace s použitím hodnoty SCr je u jaterní cirhózy značně limitován. Koncentrace kreatininu v séru je snížena v důsledku snížené syntézy kreatininu při redukci svalové hmoty. Dále je koncentrace SCr ovlivněna zvýšenou tubulární sekrecí kreatininu při snížené renální funkci, navíc může být však také významně modifikována retencí tekutin a soli, s následným zvýšením distribučního objemu, který vede k dilučnímu efektu. A tak už i malá změna koncentrace SCr může reflektovat i větší změnu renální funkce. Avšak vzhledem k výrazné intraindividuální variabilitě a významné chybě měření (až 30 %) se o vzestupu Scr lze při jeho malém zvýšení spolehlivě přesvědčit jen opakovaným měřením a sledováním trendu jeho hodnot. Často používaná frakční exkrece sodíku v moči není rovněž pro diagnostiku HRS‑AKI relevantní, neboť je zkreslena již zmíněnou retencí tekutin a soli a především současným užíváním diuretik, kdy zcela ztrácí výpovědní hodnotu.4
Citlivějším markerem v hodnocení glomerulární filtrace se zdá být využití stanovení koncentrace cystatinu C v séru – neglykosylovaného nízkomolekulárního proteinu z rodiny inhibitorů cysteinových proteáz, jenž je filtrovaný glomeruly a plně reabsorbovaný tubuly ledvin. Koncentrace cystatinu C není zkreslena věkem, množstvím svalové hmoty a přítomností hyperbilirubinemie. Je však ovlivněna sníženou koncentrací albuminu v séru, zvýšeným počtem bílých krvinek a hodnotou C‑reaktivního proteinu (CRP). Mnohé studie poukazují na výhody současného stanovování koncentrací kreatininu v séru a cystatinu C v hodnocení odhadu glomerulární filtrace.5
Studie z posledních let se soustřeďují na výzkum ostatních močových biomarkerů v diferenciální diagnostice forem AKI u jaterní cirhózy. Zatím nejčastěji vyšetřovaným a nejslibnějším markerem se jeví NGAL (neutrophil gelatinase‑associated lipocalin) – protein lipokalinové rodiny vázaný na gelatinázu ve specifických granulech leukocytů. NGAL se zdá přínosný v diagnostice zejména ATN, u které byly zaznamenány výrazně zvýšené hodnoty.6 Mezi další biomarkery AKI patří interleukin 18 (IL‑18), KIM‑1 (kidney injury molecule‑1) a L‑FABP (liver‑type‑fatty‑acid binding protein), jejich přínos nebyl adekvátně validován a jejich rozsáhlejší použití je však stále kontroverzní. Podobně jako NGAL je IL‑18 také mediátorem zánětu exprimovaným v ledvinných tubulech a makrofázích a uvolňovaným do moči při tubulárním poškození.7 Zavedení stanovování močových biomarkerů do rutinní klinické praxe zabraňují kromě vysokých nákladů se zavedením jednotlivých laboratorních metod také nejasná interpretace nálezů v důsledku chybění dostatečně velkých validačních studií a jasných hraničních hodnot, které jsou navíc u AKI závislé na čase od vzniku AKI.
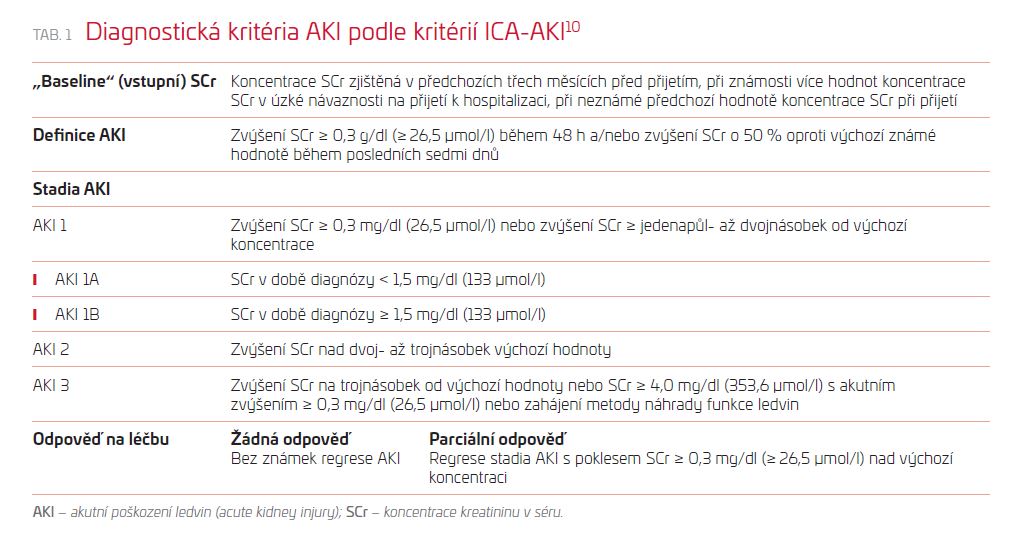
Diagnostická kritéria AKI u jaterní cirhózy
V roce 2015 byla společností ICA (International Club of Ascites) publikována diagnostická kritéria AKI u jaterní cirhózy (ICA‑AKI). Na rozdíl od guidelines RIFLE (Risk, Injury, Failure, Loss, and End‑Stage Renal Failure) a AKIN (Acute Kidney Injury Network) není v kritériích ICA‑AKI zařazeno hodnocení diurézy, která je u pacientů s jaterní cirhózou značně ovlivněna retencí tekutin, diuretickou léčbou a obecně i obtížně hodnotitelná pro všeobecný problém se správným sběrem moči. Současná diagnostická kritéria jsou založena na malých změnách hodnot SCr v krátké časové periodě, zdůrazněna je potřeba znalosti a hodnocení předchozích (,,baseline“/„vstupních“) koncentrací SCr, včetně její dynamiky. Vstupní SCr je definována jako koncentrace SCr známá v posledních třech měsících před přijetím, při známosti více hodnot je nejvíce vypovídající koncentrace SCr v úzké návaznosti na přijetí k hospitalizaci. Při neznámé předchozí koncentraci je za vstupní SCr považována hodnota při přijetí. Tato modifikace vedla k časnějšímu záchytu akutního renálního poškození a k lepšímu odhadu prognózy.8
Podle ICA‑AKI je AKI definováno jako zvýšení koncentrace SCr ≥ 0,3 mg/dl (≥ 26,5 µmol/l) během 48 hodin nebo její vzestup o 50 % oproti známým výchozím hodnotám během posledních sedmi dnů. Tato kritéria stratifikují AKI do tří stadií s ohledem na míru vzestupu koncentrace SCr. Stadia AKI umožňují stratifikovat prognózu pacientů s cirhózou a AKI.9 Výsledky studií ukázaly výraznou heterogenitu skupiny nemocných s AKI 1. stadia, proto byla tato skupina rozdělena do dvou skupin s výrazně odlišnou prognózou (tab. 1). Ke skupině pacientů stadia 1B je doporučováno přistupovat jako k pacientům s pokročilejším stadiem AKI.10
Diagnostická kritéria HRS‑AKI
Diagnóza HRS‑AKI je stanovena při současném splnění diagnostických kritérií ICA‑AKI a dalších bodů (tab. 2). Sporné je vyloučení parenchymových změn v ledvinách u pacientů s výrazně sníženou funkcí ledvin, u kterých lze očekávat významné glomerulární změny, poškození cév a tubulointersticiálního prostoru. Z důvodu omezené možnosti histologické verifikace renální biopsií nelze také opominout možnost poškození ledvin při jiných přidružených onemocněních.
Patogeneze HRS‑AKI
Během uplynulých let došlo k výrazné změně v pohledu na patogenezi HRS‑AKI, které ještě do nedávné doby bylo považováno za čistou formu funkčního selhání ledvin vznikající v důsledku komplexu cirkulačních změn při portální hypertenzi. Velká úloha je nyní přisuzována vlivu zánětlivých změn, které významně ovlivňují terapeutické výsledky s běžně používanými vazokonstriktory ve splanchnickém řečišti.
Při rozvoji HRS‑AKI se uplatňuje několik patofyziologických mechanismů (tab. 3):
Vazodilatace ve splanchnickém řečišti
V důsledku změn při portální hypertenzi dochází k celému komplexu cirkulačních změn s následnými změnami ve splanchnické a systémové hemodynamice, jež vedou v konečné fázi k renální vazokonstrikci. Nadprodukce oxidu dusnatého a dalších vazoaktivních působků vede k vazodilataci ve splanchnickém řečišti a ve většině periferního řečiště. Důsledkem je hyperkinetická cirkulace, která představuje kompenzační mechanismus pro udržení krevního tlaku. Hyperkinetická cirkulace však později nedokáže kompenzovat arteriální hypovolemii, a tak v důsledku arteriální hypotenze dochází k aktivaci sympatického nervového systému, systému renin‑angiotenzin‑aldosteron (RAS) a později také ADH (antidiuretický hormon, vazopresin), s následnou retencí sodíku a vody a vznikem diluční hyponatremie. Krevní tlak se udržuje zejména v důsledku vazokonstrikce v některých orgánech, např. v ledvinách. Při extrémně vystupňované renální vazokonstrikci dochází k poklesu glomerulární filtrace a rozvoji HRS‑AKI. O aktivaci vazopresinu vypovídají zvýšené hodnoty kopeptinu – fragmentu prekurzoru vazopresinu, které jsou typicky zvýšené u dekompenzované cirhózy s ascitem. Zvýšené hodnoty kopeptinu korelují s tíží hemodynamických změn u cirhózy a jsou prediktorem rozvoje AKI s horší prognózou.11,12 Současná terapie HRS‑AKI je založena na ovlivnění cirkulujícího objemu aplikací albuminu a splanchnických vazokonstriktorů. Roli jiných patofyziologických mechanismů nebo podíl tubulárního poškození potvrzuje skutečnost, že pouze 40 % případů HRS‑AKI je reverzibilních.13
Kardiální dysfunkce
U více než 50 % pacientů s jaterní cirhózou je popsána abnormální nebo snížená kardiální odpověď na fyziologický nebo patologický stres označovaná jako cirhotická kardiomyopatie. Ta společně se sníženým srdečním výdejem přispívá k rozvoji HRS‑AKI. V případě již přítomné hyperkinetické cirkulace je naopak srdeční výdej zvýšen a „pseudonormalizace“ při kardiomyopatii může být příčinou rozvoje HRS. Preskripce neselektivních betablokátorů u pacientů s ascitem může predisponovat k rozvoji HRS‑AKI, a tím k horší prognóze. Dávka těchto léků by měla být titrována k udržení středního arteriálního tlaku (MAP) a současně k zabránění rozvoji HRS‑AKI.14
Insuficience nadledvin
Relativní insuficience nadledvin je popisována u 20 % nemocných s dekompenzovanou jaterní cirhózou, s vyšším zastoupením u pokročilých forem cirhózy. Relativní adrenální insuficience může přispívat k cirhotické kardiomyopatii snížením počtu β‑adrenergních receptorů v srdci a ovlivněním účinku katecholaminů na srdeční kontraktilitu a napětí cévní stěny.15
Úloha zánětu
Systémová zánětlivá odpověď (systemic inflammatory response syndrome, SIRS) představuje další z důležitých aspektů v patogenezi dekompenzace jaterní cirhózy a hraje klíčovou roli v rozvoji orgánové dysfunkce asociované s ACLF.16 Konečně i přítomnost spontánní bakteriální peritonitidy může hrát roli. SIRS a sepse vedou k redistribuci průtoku krve v ledvinách (zhoršený průtok zevní částí dřeně) navozující ischemii a posléze poškození tubulů ve formě ATN.
Další mechanismy
V experimentálních studiích byla prokázána zvýšená exprese toll‑like receptoru 4 (TLR4) v ledvinách u pacientů s AKI a cirhózou, pravděpodobně v reakci na zánětlivý inzult.17 Endotoxiny (nebo lipopolysacharidy, LPS) jsou za normálních okolností obsaženy ve střevě jako rozpadové produkty gramnegativních bakterií, jejichž stěny jsou součástí. Portální hypertenze zvyšuje permeabilitu střevní stěny pro endotoxiny, endotoxemie koreluje přibližně s tíží portální hypertenze. Endotoxiny mají silný prozánětlivý účinek a stimulují tvorbu tumor nekrotizujícího faktoru α (TNFα) v jaterních makrofázích prostřednictvím TLR4. Dlouhodobá stimulace neutrofilů vlivem TNFα vede k jejich exhausci a zvýšenému riziku závažných bakteriálních infekcí u cirhotiků s portální hypertenzí, s rizikem dalšího zvýšení produkce TNFα. U jaterní cirhózy pak vysoké hodnoty TNFα, např. u spontánní bakteriální peritonitidy či sepse, mohou způsobit nekrózu hepatocytů s následným navozením obrazu akutní jaterní dekompenzace.18 Nelze ani vyloučit podíl tubulárního renálního postižení indukovaného žlučovými kyselinami.
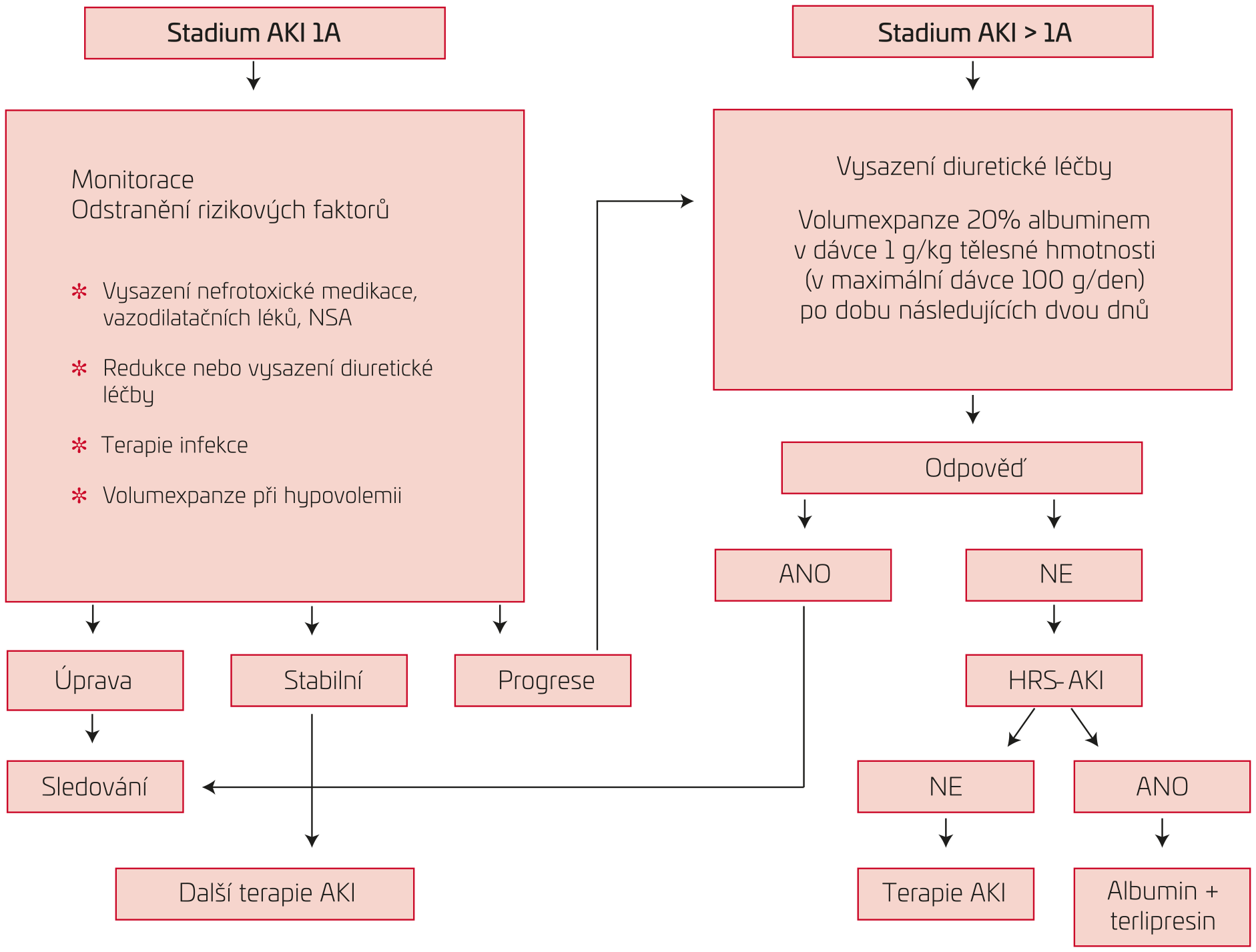
Vedení léčby AKI u jaterní cirhózy
Základem léčebné strategie u jakékoliv formy a stadia AKI je včasná identifikace a eliminace potenciálního spouštěcího faktoru.
Měly by být dodrženy následující postupy (viz obr. 1):
- pečlivá monitorace vývoje renálních parametrů, sledování diurézy, eliminace rizikových faktorů vedoucích k hypovolemii;
- vysazení diuretik a dalších léků, které mohou vyvolat či zhoršit arteriální hypotenzi (vazodilatátory, neselektivní betablokátory);
- po každé velkoobjemové paracentéze ascitu je nutné aplikovat albumin i.v. cestou (u punkcí více než pět litrů ascitu), avšak u rozvíjejícího se HRS-AKI paracentézu raději neprovádět;
- vysazení potenciálně nefrotoxické medikace – nesteroidní antiflogistika;
- nefrotoxická antibiotika podávat jen v případě, že není jiná volba z hlediska citlivosti;
- při podezření na bakteriální infekci provést diagnostickou punkci ascitu k vyloučení spontánní bakteriální peritonitidy (SBP) a ihned zahájit empiricky antibiotickou léčbu;
- po vyloučení jiného spouštěcího faktoru je již od stadia AKI 1B indikována aplikace 20% albuminu i.v. v dávce 1 g/kg tělesné hmotnosti (v maximální dávce 100 g/den) po dobu následujících dvou dnů.
OBR. 1 Vedení léčby AKI u jaterní cirhózy10
AKI – akutní poškození ledvin (acute kidney injury); HRS‑AKI – hepatorenální syndrom‑akutní poškození ledvin; NSA – nesteroidní antiflogistika.
Vedení léčby HRS‑AKI
Již od stadia AKI 1B při současně splněných kritériích HRS‑AKI je od počátku základním pilířem léčby ovlivnění alterované cirkulace s docílením zvýšení nízkého srdečního výdeje a MAP zvýšením efektivního cirkulujícího objemu aplikací albuminu v kombinaci se systémovým vazokonstriktorem.
- U rozvinutého HRS‑AKI má být pacient umístěn na monitorované lůžko se sledováním vitálních funkcí, diurézy, bilance tekutin, ideálně i s monitorací centrálního žilního tlaku.
- Zahájit podání vazokonstriktoru s albuminem v doporučené dávce:
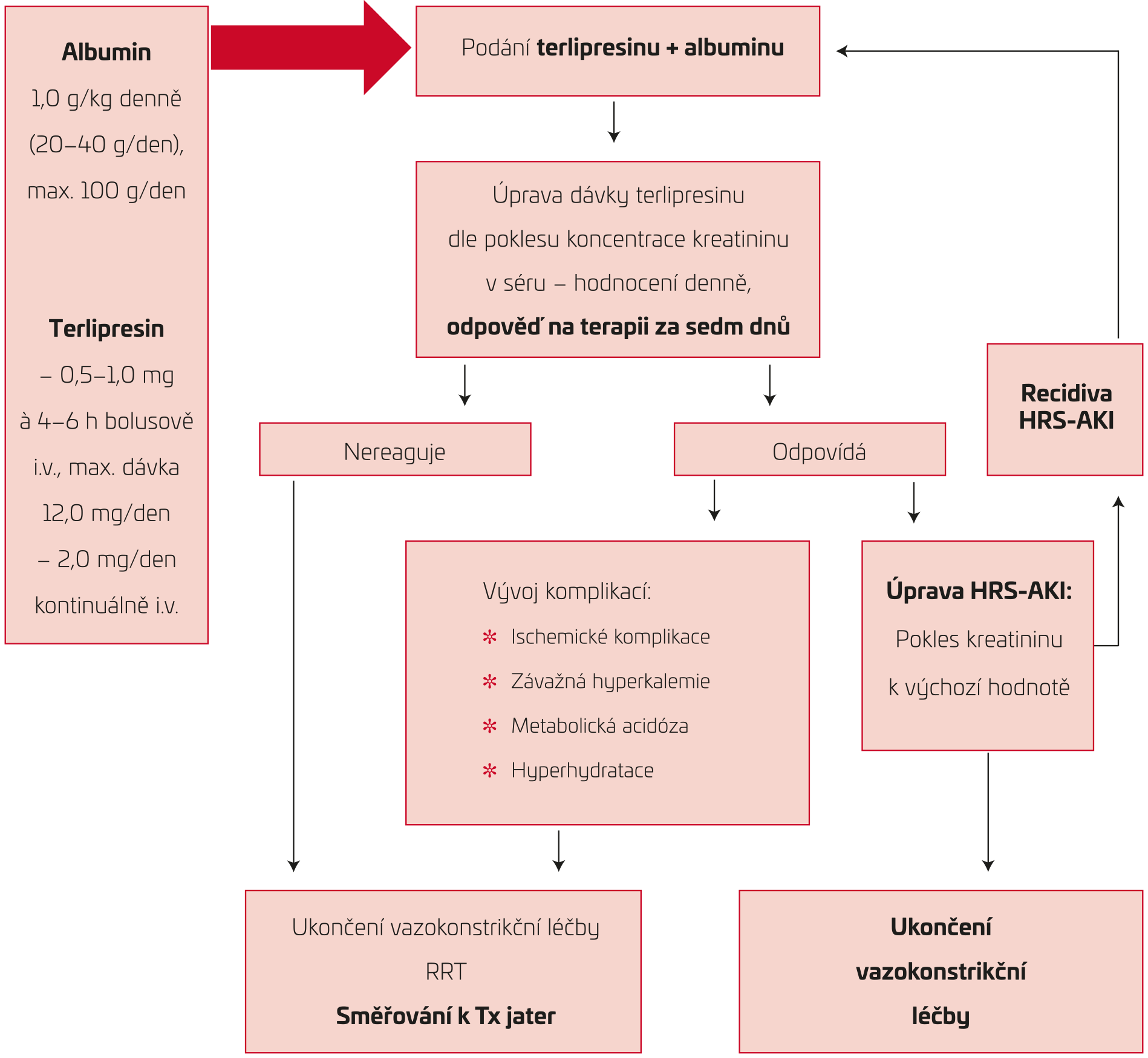
Z vazoaktivních látek je v randomizovaných studiích nejlépe dokumentován efekt léčby terlipresinem, a to jak na zlepšení renálních funkcí, tak na snížení mortality. Terlipresin (N‑triglycyl‑8‑lyzin‑vazopresin), syntetický analog vazopresinu s biologickým poločasem 3,5 hodiny, má afinitu k V1 i V2 receptorům. Stimulace V1 receptorů působí arteriolární vazokonstrikci převážně ve splanchnickém řečišti, aktivace V2 receptorů stimuluje transport ve sběrných kanálcích zvýšením počtu akvaporinových (vodních) kanálů. Kromě potlačení aktivity jednotlivých vazokonstrikčních mechanismů (sympatického nervového systému, RAS) dochází zvýšením efektivního cirkulujícího objemu a síňového plnicího tlaku ke zvýšení sekrece atriálního natriuretického peptidu (ANP) a jeho účinkem ke zvýšení natriurézy. Terlipresin se podává bolusově v iniciální dávce 0,5–1 mg i.v. po 4–6 hodinách s postupným navyšováním dle klinické odpovědi za sledování možných nežádoucích účinků (NÚ) až na 2 mg/den do maximální dávky 12 mg/d. Recentní studie ukázala nižší výskyt nežádoucích účinků a dosažení stejného účinku při aplikaci terlipresinu v kontinuální infuzi (2,0 mg terlipresinu ředěného v 250 ml roztoku 5% glukózy), navíc s podáním nižší celkové kumulativní dávky.19,20 Aplikace terlipresinu by měla být vždy v kombinaci s parenterálním albuminem, a to v dávce 1,0 g/kg/den, první 2 dny léčby, maximálně v dávce 100 g/den, poté pokračovat v dávce 20–40 g/den. Z výsledků studií je zřejmé, že efekt parenterální aplikace albuminu v prevenci a léčbě HRS‑AKI koreluje s dávkou, s lepšími výsledky při vyšší kumulativní dávce.21,22 Praktický postup při terapii terlipresinem a albuminem je znázorněn na obrázku 2.
OBR. 2 Praktický postup při terapii terlipresinem a albuminem20
HRS‑AKI – hepatorenální syndrom‑akutní poškození ledvin; i.v. – intravenózně; RRT – metoda nahrazující funkci ledvin (renal replacement therapy); Tx –
transplantace.
Alternativu k léčbě terlipresinem představuje léčba noradrenalinem, u kterého byl v randomizovaných studiích prokázán srovnatelný efekt a náklady za léčbu.23 Naopak mnohem menší úspěšnost léčby je dokumentována u léčby midodrinem společně s oktreotidem, jež jsou běžně používány v zemích s nedostupností terlipresinu.24
- Monitorovat výskyt komplikací při terapii vazokonstriktorem:
Terlipresin by měl být s opatrností podáván u pacientů s kardiovaskulárním onemocněním, neboť může navodit celou řadu ischemických komplikací (ischemické srdeční příhody, střevní ischemie, ischemie akrálních částí končetin, cévní mozkové příhody), závažné arytmie či minerálový rozvrat ve formě těžké hyponatremie. Z těchto důvodů se před nasazením terlipresinu doporučuje podrobné klinické vyšetření včetně EKG.
- Sledovat odpověď na terapii stanovením SCr denně, dále po sedmi dnech zhodnocení celkové odpovědi na léčbu:
Léčebná odpověď je definována snížením koncentrace SCr o minimálně 25 % oproti výchozí hodnotě, při níž byla léčba terlipresinem zahajována. Prediktory příznivé odpovědi na léčbu terlipresinem jsou efekt na dosažení zvýšení systémového krevního tlaku a současná přítomnost systémové zánětlivé reakce. Za negativní prognostické faktory v úspěšnosti léčby jsou naopak považovány vysoké vstupní hodnoty SCr a bilirubinu (pravděpodobně jako projev selhávání jaterní funkce).
Podávání by mělo trvat do dosažení kompletní remise (dosažení hodnoty SCr < 1,5 mg/dl) nebo maximálně v celkové délce po dobu 14 dnů při dosažení parciální remise (pokles hodnoty SCr ≥ 50, s konečnou hodnotou SCr ≥ 1,5 mg/dl) či u non‑respondérů.
- U pacientů s HRS‑AKI (zvláště při ACLF) lze zvážit podání širokospektrých antibiotik i bez průkazu zřejmé bakteriální infekce.
- V případě recidivy HRS‑AKI je možné léčbu terlipresinem opakovat.
- Transjugulární intrahepatální portosystémová spojka (TIPS) může za určitých podmínek zlepšit renální funkce a prodloužit přežití u pacientů s HRS-AKI. Ukázala to metaanalýza celkem devíti prací, které hodnotily vliv TIPS na osud pacientů s diagnózou HRS 1. typu dle původních kritérií.25 V běžné klinické praxi je nicméně využití TIPS většinou limitováno pokročilostí jaterního onemocnění.
- RRT a transplantace jater u HRS‑AKI:
Metoda nahrazující funkci ledvin (renal replacement therapy, RRT) u HRS‑AKI v celé řadě studií neprokázala vliv na prognózu a mortalitu nemocných. RRT by měla být zvažována pouze jako přemosťující léčba k transplantaci jater, která představuje jedinou kurativní léčbu HRS‑AKI v pokročilém stadiu jaterní cirhózy. Kombinovaná transplantace jater a ledvin by měla být indikována v případě nutnosti RRT pro HRS‑AKI po dobu více než 12 týdnů.26
- Prevence HRS‑AKI:
Prevence HRS‑AKI se týká především pacientů s ascitem a spontánní bakteriální peritonitidou. Výskyt HRS‑AKI u těchto pacientů může snížit použití intravenózního albuminu v léčbě SBP a také dlouhodobé podávání norfloxacinu v rámci prevence SBP. Podle některých studií může frekvenci renálního selhání u pacientů s cirhózou snížit podávání pentoxifylinu; k obecnému doporučení k jeho podávání by však bylo potřeba více údajů.
Dalším opatřením v prevenci HRS-AKI je důsledné vyloučení nefrotoxických léků (např. NSA) z léčby pacientů s refrakterním ascitem.
Závěr
Problematika akutního poškození ledvin u jaterní cirhózy představuje jednu z nejzávažnějších komplikací péče o pacienty s pokročilou jaterní cirhózou, zejména při přítomnosti ascitu. Tomuto tématu nebyla v minulosti věnována patřičná pozornost a poslední doporučení v České republice byla publikována v roce 2005.27 Současně došlo v poslední dekádě ke změně v terminologii a v diagnostických kritériích renálního selhání při jaterní cirhóze. Proto jsme považovali za důležité provést inovaci těchto doporučení a pevně věříme, že z toho budou profitovat jak naši kolegové léčící tuto skupinu komplikovaných pacientů, tak vlastní pacienti, jejichž prognóza i tak je obvykle velmi závažná.
Literatura
- Angeli P, Ginès P, Wong F, et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. J Hepatol 2015;62:986–994.
- Huelin P, Piano S, Solà E, et al. Validation of a staging system for acute kidney injury in patients with cirrhosis and association with acute‑on‑chronic‑liver failure. Clin Gastroenterol Hepatol 2017;15:438–445.
- Davenport A, Sheikh MF, Lamb E, et al. Acute kidney injury in acute‑on chronic liver failure: where does hepatorenal syndrome fit? Kidney Int 2017 92:1058–1070.
- Bucsics T, Krones E. Renal dysfunction in cirrhosis: acute kidney injury and the hepatorenal syndrome. Gastroenterology Report 2017;5:127–137
- Krones E, Fickert P, Zitta S, et al. The chronic kidney disease epidemiology collaboration equation combining creatinine and cystatin C accurately assesses renal function in patients with cirrhosis. BMC Nephrol 2015;16:1–10.
- Barreto R, Elia C, Solà E, et al. Urinary neutrophil gelatinase‑associated lipocalin predicts kidney outcome and death in patients with cirrhosis and bacterial infections. J Hepatol 2014;61:35–42.
- Belcher JM, Sanyal AJ, Peixoto AJ, et al. Kidney biomarkers and differential diagnosis of patients with cirrhosis and acute kidney injury. Hepatology 2014;60:622–632.
- Solé C, Pole E, Solà E, et al. Hepatorenal syndrome in the era of acute kidney injury. Liver Int 2018;38:1891–1901.
- Belcher JM, Garcia‑Tsao G, Sanyal AJ, et al. Association of AKI with mortality and complications in hospitalized patients with cirrhosis. Hepatology 2013;57:753–762.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018;69:406–460.
- Sola E, Kerbert AJ, Verspaget HW, et al. Plasma copeptin as biomarker of disease progression and prognosis in cirrhosis. J Hepatol 2016;65:914–920.
- Kerbert AJ, Verbeke L, Chiang FW, et al. Copeptin as an Indicator of Hemodynamic Derangement and Prognosis in Liver Cirrhosis. PloS One 2015;10:e0138264.
- Adebayo D, Morabito V, Davenport A, et al. Renal dysfunction in cirrhosis is not just a vasomotor nephropathy. Kidney Int 2015;87:509–515.
- Mandorfer M, Bota S, Schwabl P, et al. Nonselective beta blockers increase risk for hepatorenal syndrome and death in patients with cirrhosis and spontaneous bacterial peritonitis. Gastroenterology 2014;146:1680–1690.
- Theocharidou E, Krag A, Bendtsen F, et al. Cardiac dysfunction in cirrhosis – does adrenal function play a role? A hypothesis. Liver Int 2012;32:1327–1332.
- Weichselbaum L, Gustot T. The Organs in Acute‑on‑Chronic Liver Failure. Semin Liver Dis 2016;36:174–180.
- Shah N, Mohamed PE, Jover‑Cobos M, et al. Increased renal expression and urinary excretion of TLR4 in acute kidney injury associated with cirrhosis. Liver Int 2013;33:398–409.
- Gustot T, Durand F, Lebrec D, et al. Severe sepsis in cirrhosis. Hepatology 2009;50:2022–2033.
- Cavallin M, Piano S, Romano A, et al. Terlipressin given by continuous intravenous infusion versus intravenous boluses in the treatment of hepatorenal syndrome: a randomized controlled study. Hepatology 2016;63:983–992.
- Nadim MK, Durand F, Kellum JA, et al. Management of the critically ill patients with cirrhosis: A multidisciplinary perspective. J Hepatol 2016;64:717–735.
- Afinogenova Y, Tapper EB. The efficacy and safety profile of albumin administration for patients with cirrhosis at high risk of hepatorenal syndrome is dose dependent. Gastroenterol Rep (Oxf) 2015;3:216–221.
- Salerno F. Albumin treatment regimen for type 1 hepatorenal syndrome: a dose‑response meta‑analysis. BMC Gastroenterol 2015;55:1–11.
- Singh V, Ghosh S, Singh B, et al. Noradrenaline vs. terlipressin in the treatment of hepatorenal syndrome: a randomized study. J Hepatol 2012;56:1293–1298.
- Cavallin M, Kamath PS, Merli M, et al. Terlipressin plus albumin versus midodrine and octreotide plus albumin in the treatment of hepatorenal syndrome: A randomized trial. Hepatology 2015;62:567–574.
- Song T, Rössle M, He F, et al. Transjugular intrahepatic portosystemic shunt for hepatorenal syndrome: A systematic review and meta‑analysis. Dig Liver Dis 2018;50:323–330.
- European Association for the Study of the Liver. EASL clinical practise guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010;53:397–417.
- ČHS ČLS JEP. Doporučený postup ČHS pro diagnostiku a léčbu hepatorenálního syndromu (6. 12. 2005). https://www.ces‑h...nalni‑syndrom.pdf.
Článek vyšel v časopise Aktuality v nefrologii, ročník 27, 2021, číslo 1 a v časopise Gastroenterologie a hepatologie, ročník 75, 2021, číslo 2.
- Kategorie: Doporučené postupy
- Klíčová slova: akutní poškození ledvin; guideliny; hepatorenální syndrom; jaterní cirhóza