Acidóza a chronické onemocnění ledvin
Souhrn
Metabolická acidóza je častou komplikací u pacientů s chronickým onemocněním ledvin (CKD). Její důsledky na funkci orgánových systémů jsou mnohočetné a většinou negativní. Acidóza zhoršuje prognózu pacientů s CKD. Nerandomizované studie prokázaly rela-tivně dobré efekty léčby acidózy, které se ale většinou nepodařilo reprodukovat v randomizovaných studiích. Standardní léčba bi-karbonátem má negativní důsledky, zejména nežádoucí přísun sodíku nebo draslíku. V poslední době je snaha o nalezení nových látek, v pokročilé fázi klinických studií se nachází veverimer.
Úvod
U pacientů se sníženou glomerulární filtrací v důsledku chronického onemocnění ledvin (CKD) dochází k nedostatečnému vylučování kyselin, které se tvoří v organismu. U pacientů s CKD nastává nedostatečné vylučování protonů již v době, kdy koncentrace bikarbonátu v séru je ještě v normě, a snižuje se vylučování amonných iontů a citrátu močí. Postupně klesají koncentrace bikarbonátu v séru a později klesá i pH. K posouzení metabolické acidózy se většinou používá hodnota bikarbonátu v séru. Tato hodnota však nedokáže postihnout úvodní stadia hromadění vodíkových iontů a neodlišuje pacienty s normálním a nízkým pH krve.
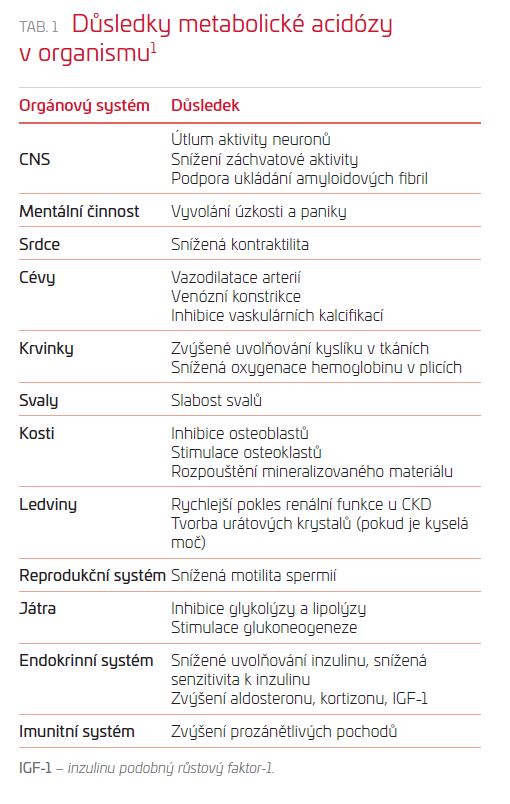
Důsledky metabolické acidózy
Většina metabolických dějů v organismu funguje optimálně za fyziologického pH. Důsledky acidózy nebo alkalózy se projeví ve většině orgánových systémů (tab. 1).
V literatuře je možno najít více přehledových článků z poslední doby, jeden z nejnovějších vyšel v Biochemical Pharmacology a je volně dostupný.1 U pacientů s CKD je hlavní pozornost upřena na důsledky pro kardiovaskulární systém, cévy a kosti. Zatímco škodlivý vliv na svaly včetně myokardu a odvápnění kostí je obecně znám, vliv na cévy už není tak jednoznačný. Acidóza pravděpodobně chrání proti ukládání kalcia do cév, a to jak do hladkého svalu,2 tak do intimy v případě aterosklerózy.3
Vliv metabolické acidózy na prognózu pacientů
Už v roce 2006 byla publikována analýza více než 56 000 dialyzovaných pacientů z USA,4 kde po adjustaci na case‑mix a parametry mikrozánětu vyšla nejnižší mortalita v hodnotách bikarbonátu nad 22 mmol/l, zatímco nižší hodnoty byly spojeny s vyšší mortalitou. Křivka má však tvar obráceného J, při alkalóze začíná mortalita opět stoupat.
Analýza pacientů ze studie NHANES III,5 která mapovala stav americké populace začátkem 90. let, prokázala nejvyšší mortalitu u pacientů s hodnotou bikarbonátu méně než 22 mmol/l v populaci téměř 16 000 jedinců. U subpopulace s CKD bylo riziko 2,5krát vyšší proti referenční skupině s hodnotou bikarbonátu v rozsahu 26–30 mmol/l. U pacientů bez CKD vycházelo riziko více než 1,5násobné, ale nebylo statisticky signifikantní vzhledem k malému počtu osob.
Analýza pacientů ze studie SPRINT zjistila vyšší incidenci kardiovaskulárních fatálních a nefatálních příhod u pacientů s koncentrací bikarbonátu nižší než 22 mmol/l. Křivka srdečního selhání a celkové mortality měla také tvar písmene J, i když statisticky nebyly mezi skupinami signifikantní rozdíly bez ohledu na adjustaci.6
Možnosti léčby metabolické acidózy
Možnosti léčby spočívají na několika principech: (a) snížení čisté nálože kyselin úpravou diety, (b) podávání bikarbonátu a (c) vazba protonů v trávicím traktu a jejich vylučování stolicí.
Zdrojem kyselin jsou v dietě převážně bílkoviny, zejména živočišné, které obsahují síru. V analýze studie Chronic Kidney Disease: Modification of Diet in Renal Disease (MDRD) závisela koncentrace bikarbonátu na glomerulární filtraci a předepsané dietě, přičemž dieta s obsahem bílkovin 0,575 g/kg tělesné hmotnosti zvýšila koncentraci bikarbonátu v séru o téměř 1 mmol/l oproti standardní dietě s 1,3 g bílkovin/kg tělesné hmotnosti.7 Dieta bohatá na ovoce a zeleninu snižuje denní nálož kyselin a veganská dieta je v poměru kyselin a zásad téměř neutrální.
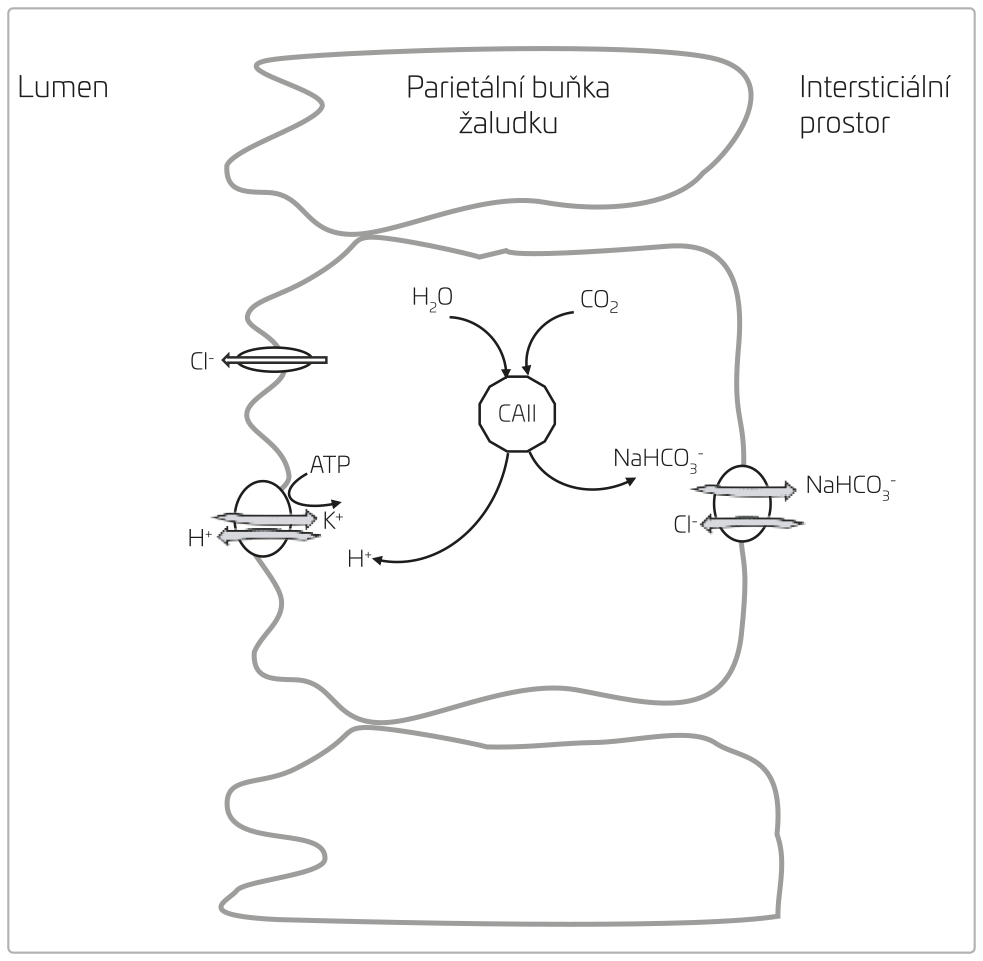
Perorální léky využívají vazbu kyseliny chlorovodíkové (HCl) v žaludku. Parietální buňky sliznice žaludku secernují HCl do lumen a za každou molekulu se zpět do intersticia vrací jedna molekula bikarbonátu (obr. 1). Látky, které neutralizují HCl v žaludku, vedou ke zvýšené sekreci parietálními buňkami, a tím ke zvýšené generaci bikarbonátu, který se vrací do oběhu.
OBR. 1 Sekrece HCl a bazolaterální produkce bikarbonátu v parietálních buňkách žaludeční sliznice.
ATP – adenosintrifosfát; CAII – karboanhydráza typu II; NaHCO3 – hydrogenuhličitan sodný.
Standardní léčbou acidózy je podání bikarbonátu sodného nebo draselného. Perorálně podaný bikarbonát působí nepřímo. V kontaktu se žaludeční kyselinou dochází k následující reakci:
HCl + NaHCO3 ® NaCl + H2O + CO2
V gastrointestinálním traktu tak zůstává chlorid sodný (NaCl), který po vstřebání zatěžuje organismus sodíkem. Oxid uhličitý (CO2) může způsobovat nadýmání a byly po něm popsány i akutní ruptury žaludku. Jde o komplikaci sice extrémně vzácnou, ale s vysokou mortalitou.8
Bikarbonát se dá podávat i ve formě draselné soli, což však zvyšuje zátěž organismu draslíkem. Další látkou, kterou lze podávat, je citrát, ze kterého se tvoří bikarbonát v játrech.
Novou látkou v léčbě acidózy je veverimer (také označovaný jako TRC101).9 Na rozdíl od bikarbonátu se léčivo ani částečně nevstřebává. Jde o částici o velikosti zhruba 100 µm, která je tvořena polyaminy o vysoké molekulové hmotnosti. Amoniak (NH3) na povrchu částice naváže vodík a posléze i atom chloru a celá částice se pak vylučuje stolicí. Tím se organismus nezatěžuje sodíkem. Je sporné, zda veverimer může být účinný při léčbě inhibitory protonové pumpy (PPI) nebo při achlorhydrii. Pacienti léčení PPI nebyli z dosavadních studií vyloučeni.
Vliv léčby na prognózu
Modifikace diety lze randomizovat, ale jen těžko zaslepit, zejména z toho důvodu, že se doporučuje používat suroviny co nejméně zpracované. V malé randomizované studii se 108 pacienty10 byla testována dieta bohatá na ovoce a zeleninu tak, aby snížila nálož kyselin na polovinu, podávání bikarbonátu na 0,3 mg/kg tělesné hmotnosti/den nebo byla uplatňována obvyklá péče bez těchto intervencí. Pacienti v ramenech s modifikací diety měli vyšší koncentraci bikarbonátu a nižší pokles glomerulární filtrace než kontrolní pacienti. Pacienti s modifikací diety měli navíc nižší systolický krevní tlak a nižší hodnoty LDL lipoproteinů, lipoproteinů(a) a vyšší hodnoty vitaminu K než pacienti v rameni s bikarbonátem.
Doporučení KDIGO (Kidney Disease: Improving Global Outcomes) z roku 201211 navrhují léčbu bikarbonátem u všech pacientů s koncentrací bikarbonátu v séru nižší než 22 mmol/l. Toto doporučení mělo však sílu pouze 2D z důvodu nedostatku důkazů. Malé a nerandomizované studie však celkem konzistentně prokazovaly zlepšení nutričního stavu a zpomalení poklesu glomerulární filtrace.
Od té doby přibylo randomizovaných klinických studií, které zkoumaly vliv acidózy na prognózu pacientů s CKD. Ne všechny se ale zabývaly vlivem na funkci ledvin.
The Use of Bicarbonate in CKD Study12 byla italská studie, která randomizovala 795 pacientů s koncentrací bikarbonátu v séru 18–24 mmol/l k podávání bikarbonátu nebo k obvyklé péči. Studie nebyla zaslepená a cílová hodnota bikarbonátu dosahovala 24–28 mmol/l. Průměrná hodnota bikarbonátu v léčené skupině byla přibližně 26 mmol/l, v kontrolní 22 mmol/l. Léčená skupina měla menší riziko zdvojnásobení koncentrace kreatininu v séru, zhruba poloviční riziko zahájení náhrady funkce ledvin (RRT), a dokonce nižší mortalitu (3,1 % vs. 6,8 %) během 36 měsíců sledování.
BiCARB13 byla britská randomizovaná studie kontrolovaná placebem, která se zaměřila na pacienty starší 60 let s koncentrací bikarbonátu nižší než 22 mmol/l. Hodnotilo se zlepšení fyzické výkonnosti, kvalita života a náklady, sledování trvalo dva roky. Většina parametrů nevykazovala statisticky významný rozdíl, trend byl ale vždy ve prospěch placeba. Nedostatkem studie bylo, že hodnocení primárního cílového ukazatele zahrnovalo jen 187 pacientů, 18 pacientů v placebovém rameni ukončilo studii a bylo převedeno na podávání nestudijního bikarbonátu, rozdíl mezi koncentrací bikarbonátu v séru byl po třech měsících 1,7 mmol/l a pak se dále zmenšoval a po dvou letech již nebyl zaznamenán žádný rozdíl.
V USA proběhla studie se 149 pacienty s koncentrací bikarbonátu v séru 20–26 mmol/l, kde primární výsledný ukazatel představovala kostní denzita krčku femuru a „sit‑to‑stand time“ (čas, za který se pacient pětkrát postaví ze sedu a zpět). Dále byly hodnoceny parametry svalového metabolismu a funkce. Pacienti byli sledováni dva roky, po dvou měsících byly hodnoty bikarbonátu 26,4 mmol/l v léčené skupině vs. 23,6 mmol/l v kontrolní skupině, ale tento rozdíl také postupně klesal a rozdíly mezi skupinami jak ve výsledcích, tak v nežádoucích účincích nebyly signifikantní. Nelišila se ani odhadovaná glomerulární filtrace (eGFR), ale studie neměla dostatečnou sílu k jejímu hodnocení.
Další americká studie (VA BiCARB)14 hodnotila 74 veteránů s diabetickým onemocněním ledvin bez acidózy. Po šesti měsících se posuzovaly koncentrace transformujícího růstového faktoru β1 (TGFβ1) a fibronektinu/kreatininu v moči a NGAL/kreatininu v moči, které se po této době nelišily, stejně tak nebyla ovlivněna hodnota poměru albumin/kreatinin v moči.
Studie Bicarbonate Administration to Stabilize eGFR Pilot Trial (Base Pilot Trial)15 si kladla za cíl zjistit, zda je možné provést studii s cílem hodnotit vliv podávání bikarbonátu na renální insuficienci – tedy zda je možné předpokládat dostatečnou adherenci k terapii a alespoň 25% dávku na konci studie. Druhým cílem bylo nalézt dávku bikarbonátu, která by se v takové studii měla podávat. Zvolené dávky bikarbonátu byly 0,5 a 0,8 mmol/kg beztukové hmotnosti/den. Hodnoceno bylo celkem 194 pacientů (90 pacientům byla podávána vyšší dávka, 52 pacientům nižší dávka a 52 pacientů dostávalo placebo). Sledování trvalo 32 týdnů. Obě dávky byly zhodnoceny jako bezpečné a tolerovatelné. Překvapením byl vzestup poměru albumin/kreatinin v moči o 30 % ve skupině s vyšší dávkou a o 12 % ve skupině s nižší dávkou, který nebyl pozorován v jiných studiích.
S veverimerem byly provedeny zatím jen tři malé studie.16–18 Přesto byla publikována již i jejich metaanalýza,19 která však trpí tím, že započítala pacienty všech tří studií dohromady, ačkoliv studie17 je pouze prodloužením studie18 se stejnými pacienty.
Momentálně probíhá studie VALOR‑CKD (NCT03710291),20 která plánuje zařadit 1 600 pacientů s maximální dobou sledování šest let a bude testovat vliv na primární cílový ukazatel – pokles eGFR o 40 % a více, terminální stadium selhání ledvin (ESRD) a úmrtí z renálních příčin. Zařazeni budou dospělí pacienti s eGFR 20–40 ml/min/1,73 m2 a koncentrací bikarbonátu v séru 12–20 mmol/l. Studie je „event‑driven“, ukončena bude po dosažení předdefinovaného počtu primárních událostí. Výsledky se očekávají v roce 2024.
Závěr
Metabolická acidóza je u CKD častá a zhoršuje prognózu pacientů, včetně celkové mortality. Pokud jde o léčbu, máme k dispozici modifikaci diety, podávání bikarbonátu a v nejbližší době patrně i veverimeru. Dosud provedené studie však nepřinášejí přesvědčivý důkaz o tom, že by léčba měla zásadní vliv na zlepšení prognózy pacientů. Navíc nejsou jednoznačně definovány parametry, podle kterých by se měla léčba zahajovat. Také není jasné, jaká je optimální cílová hodnota koncentrace bikarbonátu, protože vysoké hodnoty způsobující metabolickou alkalózu také nejsou žádoucí.
Literatura
- Quade BN, Parker MD, Occhipinti R. The therapeutic importance of acid‑base balance. Biochem Pharmacol 2021;183:114278.
- Zhang S, Xu J, Feng Y, et al. Extracellular acidosis suppresses calcification of vascular smooth muscle cells by inhibiting calcium influx via L‑type calcium channels. Clin Exp Hypertens 2018;40:370–377.
- Cochran M. Would acetazolamide inhibit progression of atheromatous vascular calcification? Med Hypotheses 2019;132:109354.
- Wu DY, Shinaberger CS, Regidor DL, et al. Association between serum bicarbonate and death in hemodialysis patients: is it better to be acidotic or alkalotic? Clin J Am Soc Nephrol 2006;1:70–78.
- Raphael KL, Zhang Y, Wei G, et al. Serum bicarbonate and mortality in adults in NHANES III. Nephrol Dial Transplant 2013;28:1207–1213.
- Dobre M, Pajewski NM, Beddhu S, et al. Serum bicarbonate and cardiovascular events in hypertensive adults: results from the Systolic Blood Pressure Intervention Trial. Nephrol Dial Transplant 2020;35:1377–1384.
- Gennari FJ, Hood VL, Greene T, et al. Effect of dietary protein intake on serum total CO2 concentration in chronic kidney disease: Modification of Diet in Renal Disease study findings. Clin J Am Soc Nephrol 2006;1:52–57.
- Vásquez A, Domínguez C, Perdomo CF. Spontaneous gastric rupture after Sodium Bicarbonate consumption: A case report. Radiography (Lond) 2017;23:e62–e64.
- Brady C, Chemaly ER, Lohr JW, Parker MD. Veverimer: an advance in base therapy for metabolic acidosis. Ann Transl Med 2020;8:1331.
- Goraya N, Munoz‑Maldonado Y, Simoni J, Wesson DE. Fruit and Vegetable Treatment of Chronic Kidney Disease‑Related Metabolic Acidosis Reduces Cardiovascular Risk Better than Sodium Bicarbonate. Am J Nephrol 2019;49:438–448.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl 2013;3:1–150.
- Di Iorio BR, Bellasi A, Raphael KL, et al. Treatment of metabolic acidosis with sodium bicarbonate delays progression of chronic kidney disease: the UBI Study. J Nephrol 2019;32:989–1001.
- BiCARB study group. Clinical and cost‑effectiveness of oral sodium bicarbonate therapy for older patients with chronic kidney disease and low‑grade acidosis (BiCARB): a pragmatic randomised, double‑blind, placebo‑controlled trial. BMC Med 2020;18:91.
- Raphael KL, Greene T, Wei G, et al. Sodium Bicarbonate Supplementation and Urinary TGF‑β1 in Nonacidotic Diabetic Kidney Disease: A Randomized, Controlled Trial. Clin J Am Soc Nephrol 2020;15:200–208.
- Raphael KL, Isakova T, Ix JH, et al. A Randomized Trial Comparing the Safety, Adherence, and Pharmacodynamics Profiles of Two Doses of Sodium Bicarbonate in CKD: the BASE Pilot Trial. J Am Soc Nephrol 2020;31:161–174.
- Bushinsky, DA, Hostetter T, Klaerner G, et al. Randomized, Controlled Trial of TRC101 to Increase Serum Bicarbonate in Patients with CKD. Clin J Am Soc Nephrol 2018;13:26–35.
- Wesson DE, Mathur V, Tangri N, et al. Long‑term safety and efficacy of veverimer in patients with metabolic acidosis in chronic kidney disease: a multicentre, randomised, blinded, placebo‑controlled, 40‑week extension. Lancet 2019;394:396–406.
- Wesson DE, Mathur V, Tangri N, et al. Veverimer versus placebo in patients with metabolic acidosis associated with chronic kidney disease: a multicentre, randomised, double‑blind, controlled, phase 3 trial. Lancet 2019;393:1417–1427.
- Liu W, Li L, Zhang X, et al. Efficacy and Safety of Veverimer in the Treatment of Metabolic Acidosis Caused by Chronic Kidney Disease: A Meta‑analysis. Front Pharmacol 2021;12:643128.
- https://clinicaltrials.gov/ct2/show/NCT03710291
- Kategorie: Přehledové články
- Klíčová slova: chronické onemocnění ledvin; metabolická acidóza; nízká sérová koncentrace bikarbonátů; veverimer