Tromboembolické komplikace u primární membranózní nefropatie
Úvod
Primární membranózní nefropatie (MN) je jednou z nejčastějších příčin nefrotického syndromu u dospělých. Léčba MN je primárně zaměřena na prevenci rozvoje či zhoršení již přítomné renální dysfunkce, která progreduje v řádu několika let, zatímco ostatní komplikace se mohou objevit mnohem dříve. Jedná se zejména o trombotické komplikace (tromboembolická nemoc, TEN), jako jsou hluboká žilní trombóza, trombóza renální žíly a plicní embolie, jež jsou také asociovány s vyšším kardiovaskulárním rizikem. Tyto komplikace s sebou také přinášejí signifikantně zvýšené riziko morbidity a mortality. V následující kazuistice popisujeme případ rozvoje komplikací u pacienta s diagnostikovanou a léčenou primární MN.
Kazuistika
Osmačtyřicetiletý pacient s anamnézou syndromu preexcitace na EKG, anamnesticky s paroxysmy supraventrikulární tachykardie, byl na konci listopadu 2018 vyšetřen pro rozvoj typických klinických a laboratorních známek nefrotického syndromu zjištěných praktickým lékařem. Anamnéza otoků dolních končetin v době prvního nefrologického vyšetření činila šest týdnů, jediným dalším symptomem byla mírná únava. Krevní tlak dosahoval 130/80 mm Hg, fyzikální nález byl vyjma otoků bez patologického nálezu. Kvantitativní proteinurie zjištěná praktickým lékařem byla přibližně 4,0 g/24 hodin. Sonograficky se obě ledviny nacházely při horní hranici normy, vaskularizace normální, indexy rezistence symetricky lehce zvýšené, přítomny diskrétní známky ascitu okolo sleziny. Laboratorně byl mineralogram vyjma lehké celkové hypokalcemie v normě, kreatinin 96 µmol/l (normální referenční hodnota [N] 63–104 µmol/l), jaterní panel v normě, celkový cholesterol 11,8 mmol/l (N 2,9–5,0 mmol/l), hypoproteinemie – celková bílkovina 45,3 g/l (N 65,0–85,0 g/l), albumin 21 g/l (N 35,0–53,0 g/l), známky periferní hypotyreózy s hodnotou tyreostimulačního hormonu (TSH) 24 mU/l (N 0,27–4,2 mU/l) a volný tyroxin (fT4) 10,42 pmol/l (N 12,00–22,00 pmol/l), snížená hodnota imunoglobulinu G (IgG) 5,3 g/l (N 7,00–16,00 g/l). Panel infekčních virových hepatitid byl negativní. Krevní obraz s diferenciálním rozpočtem neprokázal patologickou odchylku, koagulační parametry byly v normě. Proteinurie činila 3,8 g/l, z čehož albuminurie 2,9 g/l, močový poměr protein/kreatinin (protein/creatinine ratio, PCR) dosahoval 1 018 mg/mmol, močový poměr albumin/kreatinin (albumine/creatinine ratio, ACR) 768 mg/mmol, v močovém sedimentu mírná erytrocyturie (33 erytrocytů/µl). Imunologicky složka C3 komplementu při horní hranici normy, C4 v normě, protilátky proti cytoplazmě neutrofilních leukocytů (ANCA) negativní, protilátky proti bazální membráně glomerulů (anti‑GBM) negativní, antinukleární protilátky (ANA) negativní, volné lehké řetězce v normálním poměru, protilátky proti receptoru pro fosfolipázu A2 (anti‑PLA2R) negativní. Provedený základní „onkoscreening“ – sonografie břicha, rentgen hrudníku a onkomarkery – neprokázaly podezření na neoplazii.
Na základě těchto nálezů byla indikována renální biopsie, v histologickém obraze zachyceno 15 glomerulů, z toho byl jeden zaniklý. Zachovalé glomeruly byly zvětšené, s akcentovanou mezangiální oblastí a otevřené kapilární kličky, bez nekróz a srpků, přítomna segmentální sklerotizace v několika glomerulech. Endokapilární buněčnost byla přiměřená. Intersticium bylo s minimální fibrózou, prakticky bez zánětu. Imunohistochemicky byla doložena pozitivita anti‑PLA2R, která, jak uvedeno výše, byla sérologicky negativní. Stav byl diagnosticky uzavřen jako membranózní glomerulonefritida v. s. primární etiologie. Byla zahájena kombinovaná imunosupresivní terapie podle Ponticelliho protokolu pulsy methylprednisolonu v celkové dávce 2 g, poté byl podáván prednison 40 mg denně a chlorambucil 8 mg denně (1. cyklus 14 dní, poté 14 dní pauza, poté další cyklus). Pacient byl s takto zavedenou terapií a standardní konzervativní terapií nefrotického syndromu včetně profylaktické antikoagulace nadroparinem 0,4 ml jednou denně propuštěn domů.
Při následující nefrologické kontrole desátý den prvního cyklu byla zjištěna progrese otoků až charakteru anasarky, proto byla indikována krátká rehospitalizace s cílem titrace diuretické terapie. Po 14 dnech byl zahájen druhý cyklus, opět bez kýženého efektu. Týden po ukončení druhého cyklu byl pacient opětovně rehospitalizován pro anasarku, zhoršení klinického stavu a laboratorní progresi renální dysfunkce s nutností substituce albuminu a humánních imunoglobulinů. Pro takto těžký nefrotický syndrom bylo rozhodnuto o ukončení dosavadní imunosupresivní terapie a byla zahájena terapie rituximabem, bylo podáno 2× 1 000 mg rituximabu i.v. v odstupu 14 dní. Při této terapii byl pacientův stav přechodně stabilizován, byl zaznamenán mírný pokles proteinurie.
V odstupu dalších dvou měsíců došlo k opětovnému vzestupu proteinurie, k poklesu koncentrace albuminu v séru a k progresi renální dysfunkce. Při diferenciální diagnostice tohoto stavu bylo vysloveno podezření na trombózu renální žíly, podezření však bylo CT angiografií (zobrazení cév pomocí výpočetní tomografie) břicha vyloučeno. Při tomto vyšetření byl náhodně zachycen infiltrát při bázi pravé plíce, klinicky asymptomatický, stav byl zhodnocen jako pravostranná pneumonie, etiologické agens nebylo zachyceno. Za této hospitalizace byla přítomna nejnižší koncentrace albuminu v séru 13,4 g/l, hodnota PCR vystoupala na 2 713 mg/mmol, současně koncentrace kreatininu v séru dosáhla nejvyšší hodnoty 156 µmol/l. Proto bylo rozhodnuto o podávání pulsů methylprednisolonu v režimu obden (celkem 1,5 g i.v.), poté bylo pokračováno perorální kortikoterapií.
Týden po propuštění byl pacient opětovně rehospitalizován pro progresi nefrotického syndromu (PCR 4 340 mg/mmol, celková bílkovina 26,4 g/l), bylo rozhodnuto o podání rituximabu v časnějším termínu, dále opakovaně substituovány humánní imunoglobuliny. Při dalších ambulantních kontrolách již byl efekt rituximabu znatelný (pokles PCR, obnovení renální funkce), kortikoterapie vysazena, bylo přerušeno i profylaktické podávání nadroparinu.
Za čtyři měsíce od hospitalizace byl u pacienta zaznamenán nárůst počtu CD19+ lymfocytů (z 0,0 % na 2,1 %), a proto byla podána další dávka rituximabu (počátek 10/2019 – viz obr. 1). V odstupu tří týdnů od této hospitalizace se pacient dostavil na centrální interní příjem naší nemocnice pro bolesti v pravém podžebří. Sonograficky byl zjištěn prosak pravé ledviny a okolních tkání, tekutina v peritoneální dutině. Laboratorně byla patrná elevace hodnot D‑dimerů a leukocytóza. Byla doplněna CT angiografie břicha s nálezem trombózy pravé renální žíly s propagací do dolní duté žíly, dále byla scintigraficky verifikována pravostranná plicní embolie, klinicky asymptomatická. V době této hospitalizace byla proteinurie opět vysoká a byla zjištěna významně zhoršená renální funkce, reakce na podaný rituximab byla velmi nízká. Byla zahájena antikoagulační terapie apixabanem v plné dávce, dále opětovně zahájena léčba prednisonem 20 mg s postupnou redukcí dávky a přerušením v průběhu šesti měsíců. Již za jeden měsíc došlo ke zlepšení renální funkce, albuminemie i proteinurie (viz obr. 1). V době přípravy této kazuistiky je pacientovi podávána trvalá antikoagulační terapie, proteinurie v dalším poklesu se nachází již mimo nefrotické pásmo, renální funkce při horní hranici normy, koncentrace albuminu v séru na dolní hranici normy, pacient je ve výborném klinickém stavu, od tromboembolické příhody byl rehospitalizován pouze k podávání udržovacích dávek rituximabu.
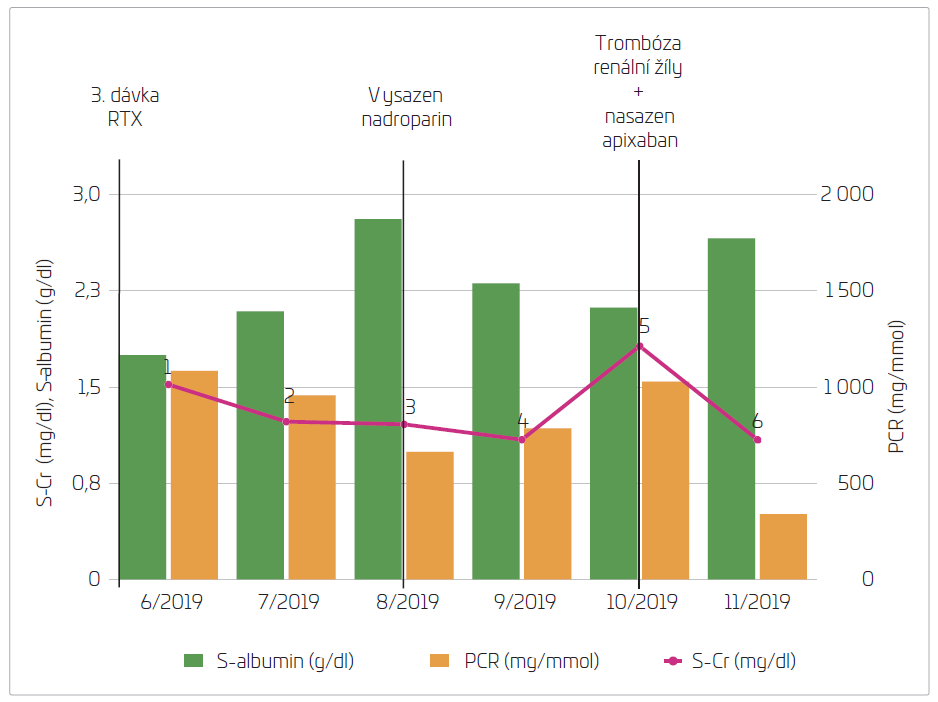
OBR. 1 Komentář: 6/2019 – hospitalizace pro anasarku, podán předčasně rituximab. 8/2019 – pro významné zlepšení hodnot PCR, S‑albuminu i S‑kreatininu vysazen nadroparin. 10/2019 podána 4. dávka rituximabu, bez reakce na léčbu, později v tomto měsíci manifestace trombózy renální žíly a následné nasazení antikoagulační terapie apixabanem. 11/2019 znatelný efekt terapie – pokles PCR, nárůst S‑albuminu, pokles S‑kreatininu. Upozorňujeme na nezvyklé jednotky použité pro potřeby přehlednosti grafu, odpovídající jednotlivé hodnoty kreatininu dle číslování: 1) 1,52 mg/dl = 135 μmol/l, 2) 1,23 mg/dl = 109 μmol/l, 3) 1,21 mg/dl = 107 μmol/l, 4) 1,09 mg/dl = 97 μmol/l, 5) 1,82 mg/dl = 161 μmol/l, 6) 1,09 mg/dl = 97 μmol/l.
Komentář
Literatura
- Li SJ, Guo JZ, Zuo K, et al. Thromboembolic complications in membranous nephropathy patients with nephrotic syndrome – a prospective study. Thromb Res 2012;130:501–505.
- Lee T, Derebail VK, Kshirsagar AV, et al. Patients with primary membranous nephropathy are at high risk of cardiovascular events. Kidney Int 2016;89:1111–1118.
- Mahmoodi BK, Ten KM, Waanders F, et al. High absolute risks and predictors of venous and arterial thromboembolic events in patients with nephrotic syndrome: results from a large retrospective cohort study. Circulation 2008;117:224–230.
- Roy C, Deschaintre Y, Sabbagh R, et al. Ischemic stroke of possible embolic etiology associated with nephrotic syndrome. Kidney Int Rep 2017;2:988–994.
- Zou PM, Li H, Cai JF, et al. A cohort study of incidences and risk factors for thromboembolic events in patients with idiopathic membranous nephropathy. Chin Med Sci J 2018;33:91–99.
- Thomson C, Forbes CD, Prentice CR, Kennedy AC. Changes in blood coagulation and fibrinolysis in the nephrotic syndrome. Q J Med 1974;43:399–407.
- Vaziri ND, Paule P, Toohey J, et al. Acquired deficiency and urinary excretion of antithrombin III in nephrotic syndrome. Arch Intern Med 1984;144:1802–1803.
- Eneman B, Levtchenko E, van den Heuvel B, et al. Platelet abnormalities in nephrotic syndrome. Pediatr Nephrol 2016;31:1267–1279.
- Fahal IH, McClelland P, Hay CR, Bell GM. Arterial thrombosis in the nephrotic syndrome. Postgrad Med J 1994;70:905–909.
- Lionaki S, Derebail VK, Hogan SL, et al. Venous thromboembolism in patients with membranous nephropathy. Clin J Am Soc Nephrol 2012;7:43–51.
- Zou H, Li Y, Xu G. Management of anticoagulation and antiplatelet therapy in patients with primary membranous nephropathy. BMC Nephrol 2019;20:442.
- Kauffmann RH, de Graeff J, de la Rivière GB, van Es LA. Unilateral renal vein thrombosis and nephrotic syndrome. Report of a case with protein selectivity and antithrombin III clearance studies. Am J Med 1976;60:1048–1054.
- Rabelink TJ, Zwaginga JJ, Koomans HA, Sixma JJ. Thrombosis and hemostasis in renal disease. Kidney Int 1994;46:287–296.
- LIach F, Papper S, Masry SG. The clinical spectrum of renal venous thrombosis: acute and chronic. Am J Med 1980;69:819–827.
- Kategorie: Kazuistiky
- Klíčová slova: membranózní nefropatie; tromboembolické komplikace
Z kazuistiky je zřejmé, že primární MN je asociována s vyšším rizikem tromboembolických komplikací. Podle čínské studie byla incidence hluboké žilní trombózy u primární MN 36 %, trombóza renální žíly 33 %, plicní embolie 17 %.1 Dále výskyt kardiovaskulárních komplikací je u pacientů s primární MN na začátku onemocnění srovnatelný s incidencí u pacientů v konečném stadiu onemocnění ledvin.2 Prediktory kardiovaskulárních příhod se zdají být přítomnost masivní proteinurie, nízká odhadovaná glomerulární filtrace (eGFR) a kouření cigaret.3–5 Snaha o snížení výskytu TEN by tedy měla být jedním z terapeutických cílů léčby primární MN.
Patogeneze trombofilních stavů u nefrotického syndromu je multifaktoriální. Na prvním místě lze jmenovat narušení rovnováhy mezi fibrinogenezí a fibrinolýzou. Ztrátami proteinů močí dochází ke snížení hodnoty antitrombinu, proteinu C a proteinu S.6,7 Riziko vzniku venózních tromboembolických komplikací je úměrné proteinurii a hypoalbuminemii. Riziko vzniku arteriálních trombóz je přisuzováno vyšší aktivaci a agregaci trombocytů.8 Mezi dalšími příčinami se uvádí hyperviskozita, intravaskulární dehydratace, hyperlipidemie, predispozice k trombogenezi (vrozené či získané) a terapie kortikoidy, která je u nefrotického syndromu častá.9 Podle dostupné literatury stoupá riziko venózních TEN s klesající albuminemií 2,13krát na každých 10 g/l albuminu v séru.10 Otázka profylaktické antitrombotické terapie není jednoznačně dořešena. U pacientů se závažnou hypoalbuminemií (< 25 g/l) je podle některých názorů přínosné podávání kyseliny acetylsalicylové, která snižuje výskyt arteriálních i venózních trombotických komplikací a zároveň je spojena s nízkým rizikem krvácení.11 Profylakticky se plná antikoagulační terapie nedoporučuje zejména pro riziko krvácení.11
Na naší klinice je zvykem pacientům s nefrotickým syndromem podávat profylaktickou dávku nízkomolekulárních heparinů (LMWH). U našeho pacienta byla tato terapie podávána po celou dobu až do výrazného zlepšení po třetí dávce rituximabu, kdy byla léčba nadroparinem přerušena, albuminemie byla v této době představována hodnotou 28,1 g/l a PCR ve značném poklesu. Necelé dva měsíce po vysazení nadroparinu došlo ke klinické manifestaci trombózy pravé renální žíly akutně vzniklými bolestmi v pravém podžebří (viz obr. 1). Při dvou ambulantních kontrolách mezi těmito událostmi byl znatelný postupný nárůst proteinurie (viz obr. 1), avšak i vzestup počtu CD19+ buněk jako známka snižování účinnosti rituximabu. Je otázkou, zda se na progresi nefrotického syndromu podílel samotný snižující se efekt terapie, nebo již incipientní trombóza renální žíly. Renální funkce byla v době manifestace trombózy signifikantně zhoršena (viz obr. 1).
V literatuře se popisuje signifikantní proteinurie jako raritní komplikace akutní trombózy renální žíly u pacientů bez nefrotického syndromu.14 Suspekce na akutní trombózu renální žíly by se měla zvážit u pacientů s nefrotickým syndromem a s jedním či více z těchto příznaků: nově vzniklá bolest v boku či generalizovaná bolest břicha, výskyt makroskopické hematurie, rozvoj či zhoršení renální dysfunkce, jež nejsou vysvětlitelné jinak. U chronické trombózy nemusejí být klinické příznaky vůbec vyjádřeny. V případě nefrotického syndromu a chronické trombózy renální žíly se popisuje možná progrese proteinurie a renální dysfunkce, toto však nebylo nikdy jasně dokumentováno, v jednom případě bylo toto vyloučeno bilaterální ureterální katetrizací, kdy mezi postiženou a nepostiženou stranou nebyl zaznamenán rozdíl v proteinurii a clearance kreatininu.12 Rutinní screening trombózy renální žíly není dle literatury doporučován, protože dopplerovská ultrasonografie nemá dostatečnou specificitu a senzitivitu a ostatní metody zatěžují pacienta radiačním zářením a aplikací kontrastních látek či invazivním výkonem.13 V našem případě došlo po zahájení antikoagulační terapie během jednoho měsíce ke znatelnému poklesu proteinurie, renální funkce se obnovila téměř ad integrum. Další významný vzestup proteinurie již nenastal, při posledních ambulantních kontrolách naopak dochází k dalšímu výraznému poklesu.
Závěrem můžeme konstatovat, že cílem této kazuistiky bylo názorně prezentovat komplikovaný případ pacienta s primární membranózní nefropatií, složitost terapie této choroby a konečně i nutnost zvažovat možný vliv tromboembolických komplikací na samotný průběh choroby a její reakci na terapii.