Difuzní alveolární hemoragie
Souhrn
Difuzní alveolární hemoragie je klinický syndrom charakterizovaný difuzním únikem krve z plicní mikrocirkulace do alveolárních prostorů a způsobený poškozením kapilár, arteriol a venul. Typická klinická triáda zahrnuje vykašlávání krve, difuzní opacity mléčného skla zjištěné při vyšetření zobrazovacími metodami a anémii, eventuálně hypoxemii. Diferenciální diagnostika je široká a základem pro diagnostiku je bronchoalveolární laváž. Autoři sdělení prezentují svoje zkušenosti, včetně rentgenové dokumentace.
Úvod
Alveolární hemoragie (AH) je vzácný a život ohrožující klinický stav charakterizovaný únikem krve z plicní mikrocirkulace do alveolárních prostorů a způsobený difuzním poškozením kapilár, arteriol a venul.1,2 Mortalita za hospitalizace se pohybuje v rozmezí 20–100 %.3,4 Nejedná se o jedno onemocnění, ale o klinický syndrom, který má celou řadu příčin (imunitní a neimunitní povahy). AH postihuje obvykle difuzně obě plíce, tzv. difuzní alveolární hemoragie (DAH). Základem pro diagnostiku je provedení bronchoalveolární laváže (BAL). AH musí být odlišena od lokalizovaných krvácení, jejichž zdrojem je bronchiální cirkulace (patologická vaskularizace při cévní anomálii, bronchiektazie, infekce, tumor). AH je lokalizována distálně v alveolárních prostorech, a proto se na rozdíl od bronchiálního krvácení nemusí projevit hemoptýzou.5–7
Etiologie a příznaky difuzní alveolární hemoragie
Alveolární hemoragie může mít celou řadu příčin imunitních a neimunitních, viz tabulku 1. Nejčastější neimunitní příčinou je srdeční onemocnění (mitrální stenóza a selhání levé komory), infekce, abúzus drog, poruchy srážlivosti. Histopatologicky je DAH projevem plicní kapilaritidy, blandní plicní hemoragie nebo difuzního alveolárního poškození. Plicní kapilaritida je charakterizována infiltrací alveolárních sept (plicní intersticium) neutrofilními granulocyty, které jsou zdrojem kyslíkových radikálů a cytoplazmatických enzymů vedoucích k poškození alveolárních kapilár, alveolárních kapilárních membrán a alveolárních stěn. Toto poškození vede k úniku erytrocytů z kapilár do intersticia a alveolárních prostor. Plicní kapilaritida je zodpovědná za DAH u vaskulitid, systémových onemocnění pojiva, antifosfolipidového syndromu, polékových postižení. Blandní plicní hemoragie je charakterizována hemoragií do alveolárních prostor bez kapilaritidy (tzn. bez zánětu, nekrózy v alveolech). Můžeme ji pozorovat rovněž u systémových onemocnění pojiva, plicní venookluzivní nemoci, idiopatické plicní hemosiderózy, mitrální stenózy, polékových postižení a při abúzu drog. Bradna a spol. studovali soubor 32 nemocných s DAH, u 18 z nich se jednalo o vaskulitidy, další diagnózy zahrnovaly systémová onemocnění pojiva, rapidně progredující glomerulonefritidy. U třetiny pacientů byla epizoda DAH prvním projevem systémového onemocnění.8
TAB. 1 Imunitní a neimunitní příčiny difuzní alveolární hemoragie
Základní klinickou triádou je: hemoptýza (vykašlávání krve z dolních dýchacích cest), difuzní alveolární opacity zjištěné pomocí zobrazovacích metod (zadopřední snímek hrudníku, výpočetní tomografie hrudníku) a anémie. Definice hemoptýzy a obecná doporučení pro diagnostiku a léčbu (klidový režim, poloha v polosedě, led na hrudník, hemostyptika, vazokonstrikční léky) lze nalézt na stránkách učebnic pneumologie.9 Ne vždy platí, že musejí být vyjádřeny všechny tři příznaky současně. Onemocnění se může projevit rychle progredující hypoxemií s nutností ventilační podpory. Trvání příznaků může být akutní, subakutní a chronické. Hemoptýza se vyskytuje ve 40–80 % případů.1 Dušnost může být přítomna a je způsobena anémií a ventilačně‑perfuzním nepoměrem. Bolesti na hrudníku nejsou časté. Systémové projevy (teploty, bolesti kloubů, bolesti svalů, kožní projevy a jiné) lze pozorovat u vaskulitid, systémových onemocnění pojiva.
Stanovení diagnózy
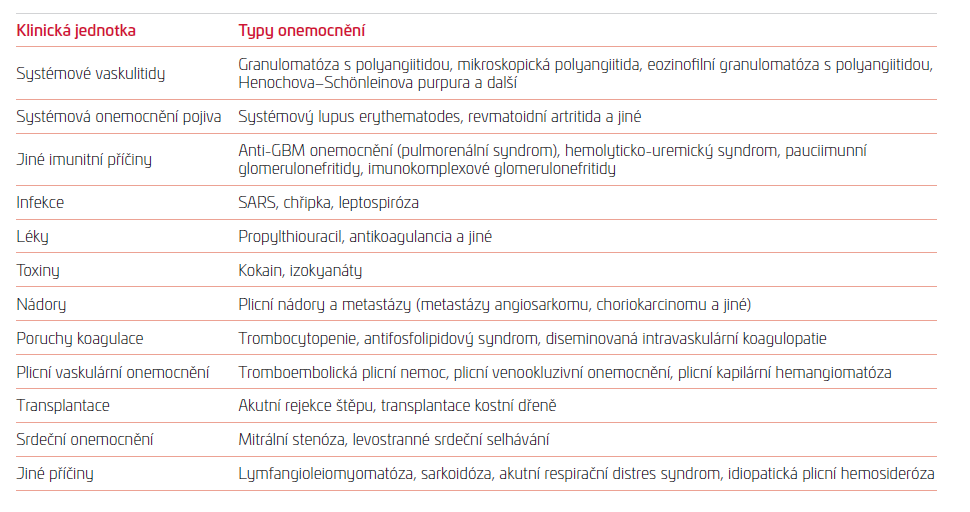
Základem pro diagnostiku je anamnéza a klinické vyšetření. Je nutné pátrat po expozici drogám, farmakologické anamnéze. Klinickým vyšetřením vyhledávat systémové projevy (nespecifické systémové příznaky, jako je únava, svalová a kloubní bolest; příznaky pro vaskulitidy nebo systémová onemocnění pojiva – kožní, otolaryngologická, oční, muskuloskeletální, neurologická, nefrologická a jiná). Poslechový nález může být bez patologie nebo jsou přítomny chrůpky až krepitace v inspiriu. Z laboratorních vyšetření se zaměřujeme na krevní obraz s diferenciálním rozpočtem, koagulační faktory, parametry zánětu, renální funkce včetně sběru moči na odpady bílkovin, erytrocyturii, N‑terminální fragment natriuretického propeptidu typu B (NT‑proBNP), imunologická vyšetření. K základu patří kvantitativní stanovení imunoglobulinů, složky komplementu C3 a C4, cirkulující imunokomplexy, stanovení základních parametrů buněčné imunity, autoprotilátky (antinukleární protilátky [antinuclear antibodies, ANA], protilátky proti extrahovatelnému nukleárnímu antigenu [extractable nuclear antigens, ENA], protilátky proti cytoplazmě neutrofilních leukocytů [antineutrophil cytoplasmic antibodies, ANCA], protilátky proti bazální membráně glomerulů [anti‑glomerular basement membrane antibodies, anti‑GBM], protilátky proti dvojvláknové DNA [double‑stranded DNA antibodies, anti‑ds‑DNA], antifosfolipidové protilátky). Rentgenový snímek plic obvykle ukáže oboustranné snížení transparence s opacitami mléčného skla (obr. 1).
OBR. 1: Rentgenový snímek hrudníku pacientky s DAH při systémové vaskulitidě typu c‑ANCA‑PR3. Difuzně oboustranně přítomné snížení transparence typu opacit mléčného skla, vpravo v dolním plicním poli se plicní zastínění sumuje s měkkotkáňovým infiltrátem v prsu histologicky verifikovaným jako granulomatóza s polyangiitidou. Pacientka byla léčena pulsy kortikosteroidů + cyklofosfamidu s plazmaferézami. Z archivu autorů.
DAH – difuzní alveolární hemoragie
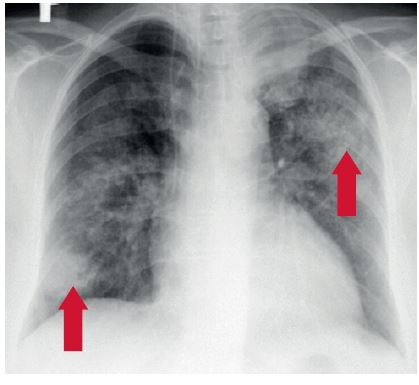
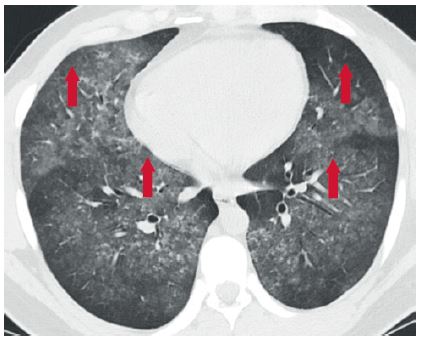
Při vyšetření hrudníku výpočetní tomografií s vysokým rozlišením (HRCT) vidíme opacity mléčného skla („ground‑glass opacity“) (částečná výplň alveolů) nebo konsolidace (zcela vyplněné alveolární prostory) s predominancí centrálně a šetřící periferie plic.1 V pozdějších stadiích pozorujeme i kombinace ground‑glass opacit spolu s retikulacemi a mikronoduly1 (obr. 2, 3).
OBR. 2: Pacient narozený v roce 1969, muž, silný kuřák s anti‑GBM onemocněním (dříve Goodpastureův syndrom) s DAH bez renálního postižení. HRCT hrudníku prokazuje oboustranně difuzně opacity mléčného skla (označeny šipkou) s maximem postižení peribronchiálních oblastí, a naopak s šetřením subpleurálních lokalit. Pacient léčen monoterapií kortikosteroidy se zákazem kouření. Dlouhodobě stabilní, bez návratu nemoci.
Z archivu autorů.
DAH – difuzní alveolární hemoragie; HRCT – výpočetní tomografie s vysokým rozlišením (high‑resolution computed tomography).
OBR. 3: HRCT hrudníku u pacientky, nekuřačky, s antifosfolipidovým syndromem a vzácnou komplikací DAH. Difuzní okrsky mléčného skla s převahou vlevo (označeny šipkou). Pacientka byla léčena plazmaferézami, imunosupresí (kortikosteroidy, cyklofosfamid, rituximab a v současnosti dostává kombinovanou léčbu kortikosteroidy + mykofenolát mofetil) a antikoagulační terapií nízkomolekulárními hepariny.
Z archivu autorů.
DAH – difuzní alveolární hemoragie; HRCT – výpočetní tomografie s vysokým rozlišením (high‑resolution computed tomography).
Vyšetření plicních funkcí často prokazuje restrikční ventilační poruchy s hypoxemií a zvýšenou hodnotu difuzní kapacity plic způsobenou zvýšeným objemem kapilární krve, přítomností extravaskulární krve v plicích, zvýšenou afinitou oxidu uhelnatého (CO) pro hemoglobin.1 Restrikce je přítomna zejména u opakujících se DAH a chronických DAH, kde opakované krvácení vede k plicní fibróze.
Při bronchoskopii můžeme vidět makroskopicky fragilní sliznici s drobným difuzním slizničním krvácením. Bronchoalveolární laváž (výplach, BAL) obvykle provádíme z té části bronchiálního stromu, která ventiluje nejvíce postiženou část plic. Videobronchoskop se zavádí do segmentálního či subsegmentálního bronchu tak, aby byl vzduchotěsně zaklíněn a aby bylo optikou videobronchoskopu patrno další brochiální větvení. Posléze provádíme aplikaci fyziologického roztoku (FR) opakovaně ve frakcích (20–50 ml, celkově 100–150 ml) a následně zpětně odsáváme. Množství aplikovaného FR se řídí především návratností tekutiny, která by neměla poklesnout pod 50 % (http://www.pneumologie.cz/, doporučení pro provádění BAL).10 Pro akutní DAH je charakteristické progresivní hemoragické zabarvení po sobě jdoucích porcí bronchoalveolární tekutiny (BAT) (obr. 4).
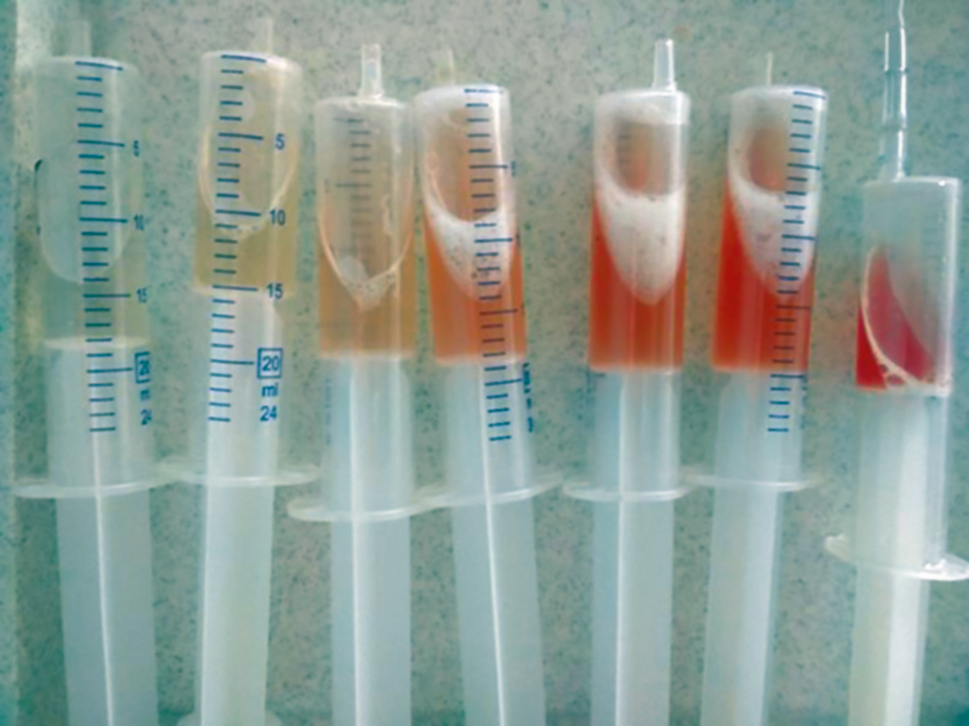
OBR. 4 Bronchoalveolární tekutina získaná bronchoalveolární laváží u difuzní alveolární hemoragie. Progresivně hemoragická tekutina získaná aspirací po instilaci jednotlivých porcí
lavážní tekutiny. Z archivu autorů.
Odezní‑li akutní epizoda DAH, může tento nález chybět. V diferenciálním rozpočtu buněk z BAT získané z BAL převládají erytrocyty a siderofágy (makrofágy obsahující hemosiderin, který vzniká rozkladem hemoglobinu). Siderofágy nemusejí být přítomny, pokud AH trvá méně než tři dny.1 Hemoglobin je konvertován na hemosiderin alveolárními makrofágy za 36–72 hodin a siderofágy zůstávají v plicích i několik týdnů po atace krvácení. Subakutní nebo chronická okultní AH je definována přítomností siderofágů převyšující 20–30 % z celkového množství makrofágů a erytrocyty mohou a nemusejí být přítomny (obr. 5).1,6,11,12
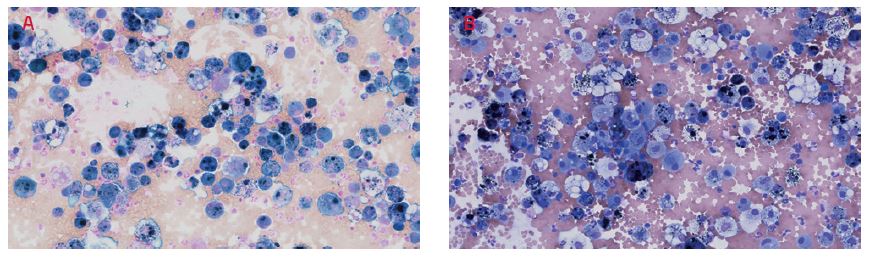
OBR. 5 (A) Bronchoalveolární tekutina – hojné siderofágy zabarvené modře, barvení na železo dle Perlse, zvětšeno 100krát. (B) Bronchoalveolární tekutina – hojné siderofágy a erytrocyty, barvení May‑Grünwald‑Giemsa, zvětšeno 100krát. Z archivu autorů.
Plicní biopsie je prováděna výjimečně. V histopatologickém obraze DAH převažují erytrocyty spolu s dalšími změnami v závislosti na trvání DAH a její příčině (imunitní etiologie).
Léčba difuzní alveolární hemoragie
Terapie závisí na příčině DAH. V případě respiračního selhání je indikována mechanická ventilace. U AH neimunitní povahy léčíme srdeční selhání, infekční příčinu, odstraníme abúzus drog. U AH imunitní povahy terapie sestává z podávání systémových kortikosteroidů a dalších imunosupresiv (cyklofosfamid, rituximab). Cyklofosfamid a rituximab se dávkují v souladu s doporučeními pro terapii vaskulitid nebo systémových onemocnění pojiva. Plazmaferéza je indikována v případech rychle progredujícího renálního selhání k rychlé eliminaci cirkulujících autoprotilátek. Plazmaferéza by mohla být přínosná i u DAH, pokud selhává léčba glukokortikoidy (GK) a cyklofosfamidem (CF) nebo GK a rituximabem (chimérická monoklonální protilátka proti molekule CD20); důkazy z randomizovaných studií ale chybějí.13
Závěry pro praxi
- Difuzní alveolární hemoragie nepředstavuje jedno onemocnění, ale vzácný klinický syndrom, na nějž je nutné myslet při diferenciální diagnostice intersticiálního plicního postižení.
- DAH je difuzní, nikoliv lokalizované poškození plicní mikrocirkulace.
- Typická klinická triáda zahrnuje: 1) vykašlávání krve, 2) difuzní alveolární opacity dokumentované zobrazovacími metodami, 3) anémii. Nemusejí být vyjádřeny všechny tři příznaky, stačí alespoň dva.
- Příčiny DAH mohou být různorodé, imunitní či neimunitní povahy.
- Průběh může být akutní, subakutní a chronický.
- Terapie DAH závisí na etiologii a často vyžaduje promptní rozhodnutí, protože jde o život ohrožující stav.
Literatura
- Lazor R. Alveolar haemorrhage syndromes. In: Cordier JF. Orphan lung diseases. Eur Respir Mon 2011;54:15–31.
- Vašáková M, Polák J, Matěj R. Difuzní alveolární hemoragie. In: Vašáková M, Polák J, Matěj R. (editors). Intersticiální plicní procesy. Od etiopatogeneze přes radiologický obraz k histopatologické diagnóze. Praha: Maxdorf, 2011: 285–312.
- Jobin P, Faraz S, Jiyoung W, et al. Recurrent alveolar hemorrhage: how do you treat that which you cannot see? Respir Med Case Rep 2018;25:201–203.
- Hassan TM, Hassan AS, Igoe A, et al. Lung involvement at presentation predicts disease activity and permanent organ damage at 6, 12 and 24 months follow‑up in ANCA‑associated vasculitis. BMC Immunology 2014;15:20.
- Zamora MR, Warner ML, Tuder R, Schwarz MI. Diffuse alveolar hemorrhage and systemic lupus erythematosus. Clinical presentation, histology, survival, and outcome. Medicine (Baltim.) 1997;76:192–202.
- Jin SM, Yim JJ, Yoo CHG, et al. Aetiologies and outcomes of diffuse alveolar haemorrhage presenting as acute respiratory failure of uncertain cause. Respirology 2009;14:290–294.
- Santos‑Ocampo AS, Mandell BF, Fessler BJ. Alveolar hemorrhage in systemic lupus erythematosous: presentation and management. Chest 2000;118:1083–1090.
- Bradna P, Maňák J, Soukup T, et al. Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii. Vnitř Lék 2018;64:169–172.
- Herout V. Hemoptýza – doporučený postup. http://www.pneumologie.cz/guidelines/. Navštíveno 22. 6. 2020.
- Skřičková J, Kolaříková R. Standardní postup při provádění bronchoalveolární laváže a vyšetřování bronchoalveolární tekutiny. http://www.pneumologie.cz/guidelines/. Navštíveno 22. 6. 2020.
- De Lassence A, Fleury‑Feith J, Escudier E, et al. Alveolar hemorrhage. Diagnostic criteria and results in 194 immunocompromised hosts. Am J Respir Crit Care Med 1995;151:157–163.
- Rabe C, Appenrodt B, Hoff C, et al. Severe respiratory failure due to diffuse alveolar hemorrhage: clinical characteristics and outcome of intensive care. J Crit Care 2010;25:230–235.
- Geetha D, Qiuyu J, Scott J, et al. Comparison of guidelines and recommendations on managing antineutrophil cytoplasmic antibody‑associated vasculitis. Kidney Int Rep 2018;3:1039–1049
- Kategorie: Názor hosta
- Klíčová slova: brochoalveolární laváž; difuzní alveolární hemoragie; hemoptýza; opacity mléčného skla