Chronická hyperkalemie – diagnóza a léčba
Úvod
Iontové poruchy obecně patří k obtížným medicínským tématům. Setkávají se s nimi všichni od praktických lékařů až po pracovníky vysoce specializovaných jednotek intenzivní péče. Na rozdíl od například poruch metabolismu glukózy nemají ionty „svůj“ obor. To vede někdy k tomu, že dlouhodobé obtížně řešitelné stavy, často i evidentně iatrogenní, končí přeposíláním pacientů od jednoho specialisty ke druhému, aniž byla stanovena příčina a naplánován kompletní vyšetřovací a léčebný postup. Nefrologie je obvykle na této cestě obligatorní zastávkou.
Poruchy koncentrace draslíku zvyšují morbiditu, mortalitu a náklady na zdravotní péči.1,2 Jako nejpříznivější se ukazují hodnoty kalemie 4–4,5 mmol/l,3 změny směrem dolů i nahoru prognózu zhoršují, a křivka má tak tvar J. Nepanuje však úplná shoda v tom, zda kalemie je kauzálním faktorem, nebo markerem.4
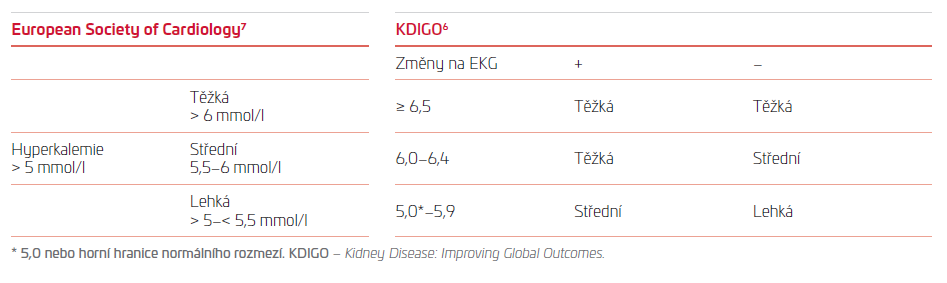
Chronické hyperkalemii je v poslední době věnována velká pozornost v souvislosti s vývojem nových léků, které absorbují draslík ve střevě a snižují obsah kalia v organismu. V poslední době se proto objevilo několik dobrých přehledových článků,5,6 které se tématu věnují podrobně. Přesto není k dispozici ani jednotná definice chronické hyperkalemie a není shoda ani na klasifikaci (tab. 1). V doporučeních Evropské kardiologické společnosti7 nalezneme definici, že chronická nebo rekurentní hyperkalemie je hyperkalemie opakovaně naměřená po dobu jednoho roku. Správně léčený a spolupracující pacient by ovšem neměl tuto definici už z principu splňovat, protože by mělo dojít k (vy)řešení podstatně dříve.
TAB. 1 Rozdělení hyperkalemie podle European Society of Cardiology a KDIGO
V následujícím textu se z nedostatku místa budu zabývat jenom pacienty nedialyzovanými. Necitované informace vycházejí z výše zmíněných přehledových článků.
Diagnóza a diferenciální diagnóza
Podle doporučení KDIGO (Kidney Disease: Improving Global Outcomes)6 je vhodné stanovovat koncentraci kalia v plazmě nebo v séru laboratorně. V séru mohou být hodnoty poněkud vyšší (o 0,1–0,7 mmol/l). Přístroje analyzující plnou krev u lůžka se všeobecně nedoporučují pro nedostatečnou přesnost. Podle nedávno publikované studie koncentrace kalia spíše podhodnocují,8 ale systematicky. Mohou tedy vyhovovat pro sledování změn u konkrétního pacienta, zejména u akutních stavů.
Diferenciální diagnóza musí vždy vzít v úvahu možnost pseudohyperkalemie. Její příčinou je nejčastěji nedodržení času preanalytické fáze, který by neměl přesáhnout 30 minut. Krev by neměla být odebírána z dlouho zatažené končetiny (více než jednu minutu) a nesmí být hemolytická. Rozpad krevních elementů, zejména blastů u leukemií nebo trombocytů u trombocytemií, může také způsobit hyperkalemii „in vitro“, ale obvykle to není diagnostický problém.
Diferenciální diagnóza skutečné hyperkalemie je osvětlena v tabulce 2. V praxi se nejčastěji setkáme s hyperkalemií vyvolanou léky nebo u pacientů s chronickým onemocněním ledvin (CKD) a renální insuficiencí, ať již jsou dialyzovaní, nebo ne. Častější je hyperkalemie u diabetiků. Zvýšený příjem hraje roli prakticky pouze v kombinaci s nějakým dalším mechanismem, za normálních okolností jsou ledviny schopny vyloučit mnohonásobně více draslíku, než je příjem v běžné stravě.
TAB. 2 Diferenciální diagnóza chronické hyperkalemie (nezahrnuje léky)

Často jsou příčinou hyperkalemie léky, které jsou vyčleněny do tabulky 3, sestavené podle konsenzu KDIGO.6 Mechanismy uvedené v podobné tabulce u kardiologických doporučení7 jsou v mnohém zavádějící. Většinou jsou však pacienti léčení podobnou medikací normokalemičtí. Pozornost je ovšem třeba věnovat každé změně, ať už je to vysazení některého z dosavadních léků, nebo přidání nového, interkurentní onemocnění či změna diety.
TAB. 3. Léky způsobující hyperkalemii (podle 6)

Léčba
Pro léčbu chronické hyperkalemie neexistuje mnoho doporučení založených na důkazech. Jestliže se dá prokázat nějaká léčitelná příčina, pak je její řešení samozřejmě na prvním místě. Jinak se obvykle doporučují následující opatření:
- Omezení příjmu draslíku v dietě. U akutní hyperkalemie je nezbytně nutné. Chronicky se toto omezení obtížně dodržuje, protože to obvykle znamená snížit množství čerstvého ovoce a zeleniny, což je v rozporu s doporučeními zdravé výživy i s preferencemi většiny pacientů. Rostlinná strava navíc přispívá k alkalizaci vnitřního prostředí a riziko hyperkalemie tím snižuje. Významným zdrojem draslíku jsou i maso a masné výrobky, zejména ošetřené různými aditivy a konzervanty. Na rozdíl od soli není obsah draslíku na obalech uváděn a může se významně lišit od tabulkových hodnot.
V reálném světě toto opatření naráží i na další překážky. Zjištění přesného množství draslíku v dietě je obtížné, a příjem je navíc intraindividuálně variabilní. Analýza jídelníčku poskytuje jen hrubý odhad. Měření odpadů kalia do moči je zatíženo velkou chybou. Kromě toho většina studií prokázala příznivé účinky zvýšeného množství draslíku v dietě na morbiditu a mortalitu, a to i u pacientů s CKD. Seznam studií je uveden v dokumentu KDIGO.6 - Korekce acidózy. Acidóza zvyšuje přesun draslíku z buněk do extracelulární tekutiny. Nedostatek bikarbonátu kromě toho snižuje dostupnost kaliových kanálů v distálním tubulu a tím snižuje vylučování kalia. Korekce acidózy často výrazně zlepší kalemii. Vyšší dávky bikarbonátu však mohou být při perorálním příjmu na obtíž zejména u pacientů, kteří již užívají větší množství léků. Při podávání tekutin parenterálně se někdy hledí pouze na obsah draslíku a nezvažují se další účinky. Bylo popsáno vyšší riziko vzniku hyperkalemie po podání fyziologického roztoku než po aplikaci Plasmalyte (který obsahuje kalium), pravděpodobně z důvodu acidifikace vnitřního prostředí fyziologickým roztokem.
- Úprava medikace zvyšující kalemii. Sem patří především kalium šetřící diuretika, suplementy draslíku a inhibitory renin‑angiotenzin‑aldosteronového systému (RAAS). Zde se otevírá i určitý prostor pro prevenci vzniku hyperkalemie. Někdy mají pacienti nastavenu substituci draslíku např. po průjmovém onemocnění s minerálovým rozvratem. Po zvládnutí akutního stavu je však třeba podávání kalia včas ukončit.
Jak u inhibitorů RAAS, tak u antagonistů aldosteronu je prokázán velmi příznivý vliv na morbiditu a mortalitu, zejména u pacientů se srdečním selháním, CKD a diabetem. Obavy z hyperkalemie vedou často k tomu, že pacienti dostávají buď příliš nízkou dávku, nebo vůbec tyto léky nemají, čímž jsou ochuzeni o jejich příznivé účinky. Zejména u lehčí asymptomatické hyperkalemie je vhodnější přidat některý z postupů zvyšujících vylučování kalia. Podrobnější postupy uvádějí v článku Rosano a spol.7 - Zvýšení vylučování draslíku. První a relativně nejsnazší možností je zvýšit vylučování ledvinami. Zvýšení průtoku distálním nefronem je zásadní a pacienti s hojnou diurézou obvykle hyperkalemií netrpí. Tohoto cíle by se dalo dosáhnout i prostým vyšším příjmem tekutin. Pro pacienty se srdečním selháním a většinu pacientů s CKD je to však neschůdné. Pokud jde o použití diuretik, při glomerulární filtraci převyšující 30 ml/min/1,73 m2 (0,5 ml/s) by se primárně měla v chronických indikacích používat thiazidová nebo thiazidům podobná diuretika. Často podávaný furosemid má účinek trvající zhruba šest hodin. I když se podá ve dvou denních dávkách, nepokryje celý 24hodinový interval. Na noc se z pochopitelných důvodů u ambulantních pacientů podávat nemá. Proto je vhodný u akutních stavů nebo tam, kde je nutné rychle snížit nebezpečné hodnoty. Naproti tomu aktivní metabolity spironolaktonu mají dlouhý poločas a jejich účinek přetrvává déle než 24 hodin. Pokud se tedy akutně podaří snížit koncentraci kalia furosemidem u pacienta, který užíval vyšší dávky spironolaktonu, je kontrola nutná ještě několik dnů.
Relativně méně užívanou možností je zvýšení vylučování trávicím traktem. Na našem trhu je zatím k dispozici jen kalcium polystyrensulfonát (calcium resonium, Resical). Resical je hrazen z pojištění u pacientů se selháním ledvin a s akutní hyperkalemií. Kromě vazby draslíku však u těchto přípravků dochází i k vazbě léků. Odstup od podání jiných perorálních léčiv by měl být tři hodiny, při gastroparéze až šest hodin. Obavy vzbuzuje rovněž toxická nekróza střeva, která byla popsána jako sice vzácný, ale velmi závažný nežádoucí účinek. Riziko hrozí zejména v kombinaci se sorbitolem, ale vyskytuje se i při samostatném podávání.V poslední době byly vyvinuty nové přípravky, které jsou bezpečnější. Jde o patiromer (obchodní název Veltassa) a cyklosilikát sodno‑zirkoničitý (Lokelma). Veltassa je již v databázi Státního ústavu pro kontrolu léčiv a je vázána na předpis, ale nemá stanovenu úhradu, Lokelma v databázi není. Patiromer musí být podáván s tříhodinovým odstupem od ostatních léků, podobně jako polystyrensulfonáty. Častým nežádoucím účinkem je hypomagnezemie a hypokalcemie. Cyklosilikát by se měl podávat s dvouhodinovým odstupem od podání léků, jako jsou například proteázové nebo tyrozinkinázové inhibitory a další, jejichž absorpce závisí na pH žaludku. Ne u všech léků se však tato informace v dostupné dokumentaci uvádí. Častějším nežádoucím účinkem tohoto přípravku jsou otoky a zácpa. Bylo také popsáno rušivé působení na vyšetření kostní denzity, které by mohlo ovlivnit výsledek.9
Jsou i další možnosti, které však zůstávají spíše v rovině teorií nebo spekulací. Inhibitory sodíko-glukózového kotransportéru 2 (SGLT2, glifloziny) způsobují osmotickou diurézu, a mohly by tedy přispívat ke zvýšenému vylučování draslíku. Po jejich užívání byla však popsána jak hypokalemie, tak hyperkalemie a účinek u konkrétního pacienta nelze předem odhadnout. Trend je ale spíše k hypokalemii,10 u některých pacientů by tedy mohly být účinné. Vylučování kalia střevem je zvýšeno po užití laxancií i v dávce, která nevyvolává průjem. Přesto může zvýšení počtu stolic pacienta obtěžovat. Dále je známo, že vylučování draslíku podléhá cirkadiánnímu rytmu, maximum je kolem poledne, minimum kolem půlnoci. Nejsou však žádné informace o tom, zda snídaně s draslíkem je méně riziková než večeře s draslíkem.
Závěr
Léčba chronické hyperkalemie je obtížná a vyžaduje obvykle ovlivnění více mechanismů najednou. Dále jsou nutné časté kontroly pacientova stavu, protože jakékoliv akutní onemocnění, změna stravování nebo zásahy do medikace mohou obtížně získanou rovnováhu znovu vychýlit nežádoucím směrem. Na druhé straně je vždy nutno zvažovat relativně malé riziko vyplývající z mírné hyperkalemie oproti riziku z přerušení terapie léky, které mohou výrazně zlepšovat prognózu pacienta, jako jsou inhibitory RAAS nebo antagonisté mineralokortikoidních receptorů.
Literatura
- Jiménez‑Marrero S, Cainzos‑Achirica M, Monterde D, et al. Impact on clinical outcomes and health costs of deranged potassium levels in patients with chronic cardiovascular, metabolic, and renal conditions [published online ahead of print, 2020 Jul 18]. Rev Esp Cardiol 2020;S1885–S5857(20)30273‑5.
- Betts KA, Woolley JM, Mu F, et al. Postdischarge Health Care Costs and Readmission in Patients With Hyperkalemia‑Related Hospitalizations. Kidney Int Rep 2020;5:1280–1290.
- Kovesdy CP, Matsushita K, Sang Y, et al. Serum potassium and adverse outcomes across the range of kidney function: a CKD Prognosis Consortium meta‑analysis. Eur Heart J 2018;39:1535–1542.
- Ferreira JP, Mogensen UM, Jhund PS, et al. Serum Potassium in the PARADIGM‑HF trial. Eur J Heart Fail 2020 Aug 18. doi: 10.1002/ejhf.1987. Online ahead of print.
- Hunter RW, Bailey MA. Hyperkalemia: pathophysiology, risk factors and consequences. Nephrol Dial Transplant 2019;34(Suppl 3):iii2–iii11.
- Clase CM, Carrero JJ, Ellison DH, et al. Potassium homeostasis and management of dyskalemia in kidney diseases: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int 2020;97:42–61.
- Rosano GMC, Tamargo J, Kjeldsen KP, et al. Expert consensus document on the management of hyperkalaemia in patients with cardiovascular disease treated with renin angiotensin aldosterone system inhibitors: coordinated by the Working Group on Cardiovascular Pharmacotherapy of the European Society of Cardiology. Eur Heart J Cardiovasc Pharmacother 2018;4:180–188.
- Chothia MY, Kassum P, Zemlin A. A method comparison study of a point‑of‑care blood gas analyser with a laboratory auto‑analyser for the determination of potassium concentrations during hyperkalaemia in patients with kidney disease. Biochem Med (Zagreb) 2020;30:030702.
- McCarney B, Binkley N, Krueger D. A Newly Recognized DXA Confounder: The Potassium‑Binding Medication Sodium Zirconium Cyclosilicate [published online ahead of print, 2020 May 21]. J Clin Densitom 2020;S1094‑6950(20)30089‑5.
- Yavin Y, Mansfield TA, Ptaszynska A, et al. Effect of the SGLT2 Inhibitor Dapagliflozin on Potassium Levels in Patients with Type 2 Diabetes Mellitus: A Pooled Analysis. Diabetes Ther 2016;7:125–137.
- Kategorie: Pacient s onemocněním ledvin v ordinaci ambulantního specialisty
- Klíčová slova: cyklosilikát sodno zirkoničitý; hyperkalemie; patiromer; polystyrensulfonát