Antikoagulancii indukovaná nefropatie navozená duální antiagregační terapií
Kazuistika
Dvaaosmdesátiletý pacient byl přijat k hospitalizaci na naši kliniku na doporučení praktického lékaře pro makroskopickou hematurii progredující asi týden, známky akutního poškození ledvin (acute kidney injury, AKI), únavu, nechutenství a námahovou dušnost.
V osobní anamnéze byla před osmi měsíci přítomna recidiva nestabilní anginy pectoris řešená katetrizačně implantací lékového stentu do ramus interventricularis anterior (RIA), dále dyslipidemie, arteriální hypertenze a benigní hyperplazie prostaty. Kvůli nedávné implantaci stentu pacient užíval standardní duální antiagregační léčbu kombinací klopidogrelu (75 mg denně) a kyseliny acetylsalicylové (100 mg denně). Dále pacient dlouhodobě užívá perindopril (5 mg denně), bisoprolol (2,5 mg denně) a atorvastatin (20 mg denně).
Vstupně byly zjištěny následující laboratorní hodnoty: kreatinin 522 μmol/l, urea 22,95 mmol/l, kalium 5,33 mmol/l, kyselina močová 739 μmol/l, pH krve 7,27, BE –5,9, HCO3 19,7, CRP 4,1 mg/l, Hb 107 g/l, leukocyty 35,5 × 109/l, trombocyty 117 × 109/l. V močovém sedimentu byly přítomny erytrocyty 460/μl a bílkovina 1 g/l. Elektroforéza sérových bílkovin prokázala deformaci gama‑frakce a monoklonální gamapatii typu IgG kappa. Koncentrace IgG v séru dosahovala 17,6 g/l, koncentrace IgM v séru 2,34 g/l, jinak bylo imunologické vyšetření bez dalších pozoruhodností.
Podle ultrasonografie ledvin byly přítomny známky akutní iritace v terénu chronické vaskulární nefrosklerózy, ledviny stranově symetrické velikosti 120 mm, hladké kontury obou ledvin, parenchym hyperechogenní a místy rozšířený až na 25 mm. Podle dopplerovského vyšetření byly zjištěny stranově symetrické a vysoké (> 0,80) rezistenční indexy v intrarenálních arteriích. Současně bylo popsáno suspektní expanzivní ložisko horního pólu levé ledviny, splenomegalie a paraaortální lymfadenopatie.
Vzhledem k výrazné leukocytóze bez korelátu v zánětlivých parametrech byl proveden mikroskopický diferenciální rozpočet s nálezem 68 % atypických susp. neoplastických lymfocytů v diferenciálním rozpočtu leukocytů. Materiál byl proto odeslán k vyšetření průtokovou cytometrií s potvrzením klonální proliferace středně velkých B lymfocytů s nespecifickým fenotypem nejspíše non‑Hodgkinova lymfomu (NHL) z marginální zóny (50 % z jaderných buněk). Na základě uvedených vyšetření byla doplněna trepanobiopsie z lopaty kosti kyčelní s nálezem lymfomové infiltrace tvořící 70 % celkové buněčnosti kostní dřeně, která morfologicky i imunofenotypově odpovídá B‑NHL mantle cell lymfomu. V rámci stagingu onemocnění bylo doplněno CT hrudníku, břicha a malé pánve s nálezem splenomegalie a krční, mediastinální, axilární, inguinální, paraaortální a mezenteriální lymfadenopatie. Zároveň byl potvrzen nález suspektního tumoru levé ledviny.
Za hospitalizace došlo k progresi AKI až do oligoanurického renálního selhání. Během týdne došlo k plynulému vzestupu hodnoty kreatininu z 522 μmol/l zaznamenaných na začátku hospitalizace až na 779 μmol/l. Vzhledem k progresi renálního selhání, hyperkalemii a metabolické acidóze byl pacientovi po osmi dnech od přijetí zaveden centrální žilní katétr a byla zahájena pravidelná hemodialyzační léčba.
Vzhledem k zavedené duální antiagregační terapii a klinickým krvácivým projevům (makroskopická hematurie, epistaxe) nebylo možné akutně provést renální biopsii (RB), byl proto vysazen klopidogrel a RB naplánována v odstupu. Běžnými laboratorními metodami se nepodařilo zjistit další příčinu přetrvávajícího krvácivého stavu (INR 1,22, aPTT/R 1,13, trombinový čas [TT] 15,8 s, fibrinogen 2,4 g/l, antitrombin III [ATIII] 89 %). I přes uvedenou kardiologickou anamnézu bylo dočasně přerušeno podávání kyseliny acetylsalicylové.
Následně (17. den od přijetí) byla provedena RB, která zachytila těsně subkapsulární punktát s morfologií akutní tubulární nekrózy s četnými čerstvými i lyzovanými erytrocyty/erytrocytárními válci v lumen tubulů, velmi pravděpodobně odpovídající antikoagulancii indukované nefropatii (viz obr. 1 a obr. 2). Současně byla diagnostikována glomerulonefritida s monoklonálními depozity (IgG, IgG3, C3 pozitivní), velmi suspektně jako součást prokázaného hematologického onemocnění (B‑NHL mantle cell lymfom). V subkapsulárním punktátu bez punkce arterií nebylo možné posoudit stav cév a rozsah spolupodílu vaskulární nefrosklerózy, který může limitovat další úpravu renálních funkcí.
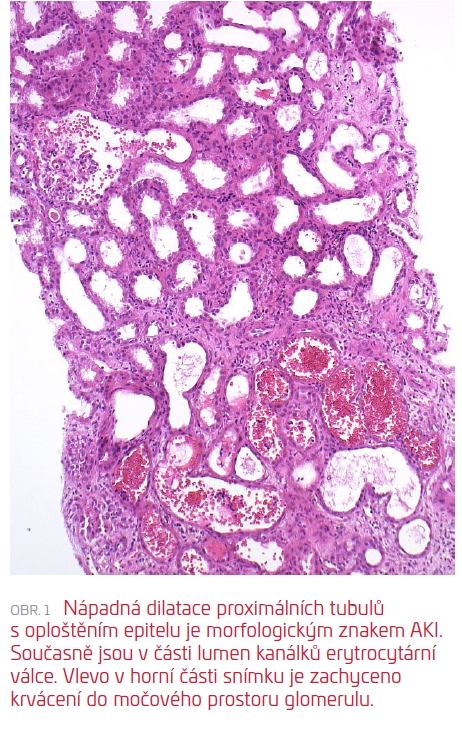
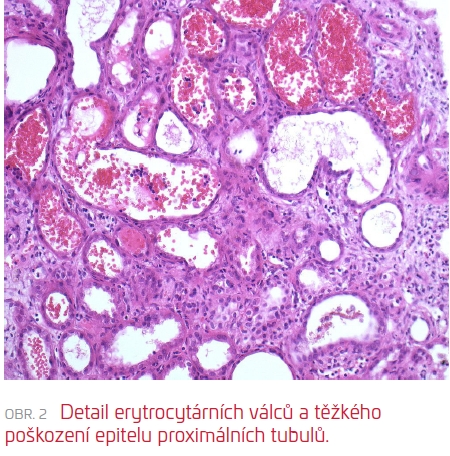
Za hospitalizace ani během dalších ambulantních kontrol nedošlo k reparaci renálních funkcí ani k obnově diurézy, a pacient byl proto předán do pravidelného dialyzačního léčení. Dále byl dispenzarizován na Interní hematologické klinice FNKV a byla zahájena hematologická terapie (mini‑CHOP). Nález na levé ledvině byl hodnocen jako primární tumor ledviny či infiltrace NHL a pacient byl v tomto ohledu dále vyšetřen.
Komentář
Literatura
- Wheeler DS, Giugliano RP, Rangaswami J. Anticoagulation related nephropathy. J Thromb Haemost 2016;14:461–467.
- Ryan M, Ware K, Qamri Z, et al. Warfarin related nephropathy is the tip of the iceberg: direct thrombin inhibitor dabigatran induces glomerular hemorrhage with acute kidney injury in rats. Nephrol Dial Transplant 2014; 29:2228–2234.
- Narasimha Krishna V, Warnock DG, Saxena N, Rizk DV. Oral anticoagulants and risk of nephropathy. Drug Saf 2015;38:527–533.
- Kabir A, Nadasdy T, Nadasdy G, Hebert LA. An unusual cause of gross hematuria and transient ARF in an SLE patient with warfarin coagulopathy. Am J Kidney Dis 2004;43:757–760.
- Kincaid Smith P, Bennett WM, Dowling JP, Ryan GB. Acute renal failure and tubular necrosis associated with hematuria due to glomerulonephritis. Clin Nephrol 1983;19:206–210.
- Brodsky SV, Nadasdy T, Rovin BH, et al. Warfarin related nephropathy occurs in patients with and without chronic kidney disease and is associated with an increased mortality rate. Kidney Int 2011;80:181–189.
- Brodsky SV, Satoskar A, Chen J, et al. Acute kidney injury during warfarin therapy associated with obstructive tubular red blood cell casts: a report of 9 cases. Am J Kidney Dis 2009; 54:1121–1126.
- An JN, Ahn SY, Yoon CH, et al. The occurrence of warfarin related nephropathy and effects on renal and patient outcomes in Korean patients. PLoS One 2013;8:e57661.
- Ozcan A, Ware K, Calomeni E, et al. 5/6 nephrectomy as a validated rat model mimicking human warfarin related nephropathy. Am J Nephrol 2012;35:356–364.
- Rizk DV, Warnock DG. Warfarin related nephropathy: another newly recognized complication of an old drug. Kidney Int 2011;80:131–133.
- Brodsky SV, Hebert LA. Anticoagulant Related Nephropathy: Is an AKI Elephant Hiding in Plain View? J Am Coll Cardiol 2016;68:2284–2286.
- Angiolillo DJ. Variability in responsiveness to oral antiplatelet therapy. Am J Cardiol 2009;103(3 Suppl):27A–34A.
- Kategorie: Kazuistiky
- Klíčová slova: akutní poškození ledvin; antikoagulancii indukovaná nefropatie; duální antiagregace; hematurie
Antikoagulancii indukovaná nefropatie (anticoagulation‑related nephropathy, ARN) je stav projevující se akutním poškozením ledvin navozeným nadměrnou antikoagulační léčbou warfarinem a dalšími antikoagulancii.1 Antikoagulancii indukovaná nefropatie je u některých pacientů spojována s nevratným poškozením ledvin a se zvýšenou mortalitou.
Původně používaný termín „warfarinem indukovaná nefropatie“ či „warfarinová nefropatie“ byl nahrazen termínem „antikoagulancii indukovaná nefropatie“ vzhledem ke spojení tohoto stavu i s jinými typy antikoagulační léčby,2,3 ale nikoliv s antiagregační léčbou.
Akutní poškození ledvin způsobené glomerulární hemoragií bylo popsáno u pacientů s glomerulární lézí (tj. chorobou ledvin) jak s koagulopatií (INR v rozmezí 6–9),4 tak bez ní.5 Nověji bylo popsáno AKI také u pacientů bez současně přítomné choroby ledvin a s nižší hodnotou INR (> 3).6 Podrobná studie používající biopsii devíti pacientů, u nichž došlo k nevysvětlenému AKI ve spojitosti s předávkováním warfarinem, odhalila predominantní tubulární lézi s obstrukcí erytrocyty a erytrocytárními válci.7 Rozpoznání charakteristické histologické léze asociované s dosud nevysvětleným AKI s pozadím nadměrné antikoagulace vedlo k zavedení termínu antikoagulancii indukovaná nefropatie.
Incidence ARN se stanovuje obtížně. Je to zejména proto, že studie zkoumající incidenci se opíraly o domnělou diagnózu ARN (definovanou zvýšením koncentrace kreatininu v séru během několika dní od abnormálního zvýšení INR) místo přesného stanovení diagnózy (stanovené biopticky).8 Je tedy pravděpodobné, že epidemiologické studie přeceňují incidenci ARN, navíc u více nemocných pacientů existuje vyšší pravděpodobnost přítomnosti renální insuficience a také i rozvoje ARN. Na druhé straně v praxi je pravděpodobnější podcenění výskytu ARN, a to ze dvou důvodů:
Observační studie naznačují, že nejvíce případů AKI se objeví během prvních osmi týdnů po zahájení terapie warfarinem.6,10 Interval mezi patologickým zvýšením INR a nástupem AKI ale není s jistotou určen.
Podezření na diagnózu ARN by mělo být vysloveno u pacientů, u kterých se objeví AKI při současné nadměrné antikoagulaci. Definitivní diagnóza může být však stanovena pouze bioptickou verifikací. Biopsie se však často u pacientů podstupujících antikoagulační léčbu neprovádí, alespoň ne okamžitě, pro obavu z vysokého rizika krvácení.
Diferenciální diagnostika AKI je široká a závisí na nálezu v moči. Mezi pacienty, kteří vykazují hematurii, zejména s dysmorfní populací erytrocytů a s erytrocytárními válci, je důležité odlišit glomerulonefritidy nebo vaskulitidy.11
Bohužel zatím neexistují žádné prospektivní studie, které by podložily způsoby léčby ARN. Vzhledem k dosavadním klinickým zkušenostem převládá názor, že navrácení INR do terapeutického rozmezí může omezit rozsah akutního a chronického poškození ledvin způsobeného glomerulárním krvácením.11
Naše kazuistika popisuje případ, kde klinický průběh a zejména histologický nález odpovídá ARN, přestože pacient nebyl léčen antikoagulancii, ale duální antiagregací. Lze tedy právem usuzovat na etiopatogenetickou souvislost. Při přehlédnutí literatury jsme podobný případ nedohledali, jde tedy o první popis takového případu.
Diferenciálně diagnosticky je možné vzít v úvahu i souhru tří momentů, které se sešly v jedné době: i/ glomerulonefritida, ii/ duální antiagregace, iii/ neodhalená koagulopatie/trombocytopatie při lymfomu. Jak však již bylo diskutováno výše, přítomnost CKD zvyšuje riziko vzniku ARN dvojnásobně. Lze tedy oprávněně předpokládat, že postižení glomerulů je rizikovým faktorem pro vznik ARN.
Současně je potřeba konstatovat, že krvácení mohlo být zčásti způsobeno i tím, že mohlo dojít k předávkování antiagregancii. V běžné klinické praxi se totiž vliv antiagregační léčby nijak nemonitoruje, přestože funkční testy agregace destiček jsou k dispozici (klasická optická agregometrie Bornovou metodou, turbidimetrická aglutinační agregometrie, impedanční agregometrie a další). Hrozí tak riziko pod‑/předávkování i při běžných dávkách antiagregancií.12 V našem případě jsme žádné agregační testy neprovedli.