Nemoc lehkých řetězců (LCDD)
Žena, narozená roku 1939 (160 cm, 92…104 kg), s anamnézou arteriální hypertenze od roku 1980 a cholecystektomie, byla v roce 2004 (ve věku 65 let) doporučena k nefrologickému vyšetření pro těžko korigovatelnou hypertenzi. Byl zjištěn nefrotický syndrom s proteinurií 8 g/24 h, s hypalbuminémií 27 g/l, s hypercholesterolémií 6,5 mmol/l, dále anémie s Hb 106 g/l a snížení glomerulární filtrace se sérovou koncentrací kreatininu 199 μmol/l (eGF 0,36 ml/s dle MDRD). Byla provedena renální biopsie s průkazem nemoci lehkých řetězců kappa (LCDD), hodnota volných lehkých řetězců kappa (FLC) byla 276 mg/l.
U nemocné bylo provedeno hematologické vyšetření, nebyla splněna kritéria pro diagnózu myelomu a specifická hematologická léčba nebyla indikována. Rtg ani MR vyšetřením nebyla prokázána kostní ložiska. Byla zahájena cyklická pulsní léčba dexamethasonem ve 28denních cyklech v dávce 40 mg denně p.o. po dobu čtyř dnů vždy od 1. do 4. dne cyklu. Tyto cykly byly aplikovány čtyři a pak pokračovala udržovací léčba prednisonem v dávce 10 mg denně.
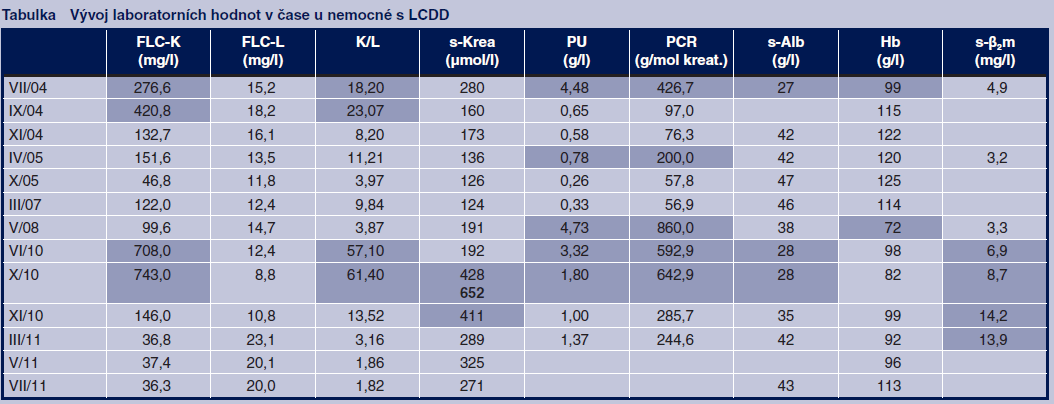
Léčba vedla k navození parciální remise trvající přes tři roky. Po tuto dobu kolísala proteinurie v rozmezí 0–1,3 g/24 h, sérové koncentrace albuminu v rozmezí 39–47 g/l a kreatininu v rozmezí 120–200 μmol/l s výjimkou jednoho měření v roce 2006, kdy při infektu sérová koncentrace kreatininu stoupla přechodně na 278 μmol/l. Koncentrace hemoglobinu kolísala mezi 109–122 g/l, hodnota FLC mezi 46–151 mg/l. Klinický stav pacientky byl po tyto tři roky převážně dobrý.
Od roku 2007 byl při pravidelných kontrolách zjištěn postupný rozvoj relapsu onemocnění se vzestupem proteinurie (roku 2008) až 9,9 g/24 h, s hypalbuminémií 32 g/l, s anémií (Hb 95 g/l), bez zřetelného zhoršení glomerulární filtrace (s‑kreatinin 201 μmol/l). Restagingem opět nebyl prokázán myelom.
Po poradě s hematologem byla v roce 2008 opět zahájena stejná cyklická pulsní léčba s dexamethasonem a prednisonem jako v roce 2004. Léčba byla po třetím cyklu komplikována rozvojem retence tekutin s anasarkou, zhoršením anémie a rozvojem blíže nespecifikované infekce, kterou se podařilo zvládnout kombinací antibiotik a antimykotik. Dřívější porucha glukózové tolerance progredovala a rozvinul se diabetes mellitus. V cyklické pulsní léčbě jsme po rozvoji těchto komplikací již nepokračovali, navázali jsme pouze prednisonem nejprve 20 mg denně, posléze 10 mg denně.
Parciální remise trvala necelý rok, poté docházelo opět k vzestupu proteinurie a k výraznému zhoršování arteriální hypertenze, která byla obtížně korigovatelná. V roce 2010 došlo k rychlému zhoršování funkce ledvin se vzestupem s‑kreatininu na 464 μmol/l. Tento vývoj byl provázen prudkým vzestupem hodnoty FLC na 743 mg/l. Byl opět proveden restaging hematologického onemocnění, jehož klasifikace zůstala stejná.
Vzhledem k neuspokojivému vývoji byla změněna léčebná strategie a zahájena kombinovaná cyklická pulsní léčba melfalanem a dexamethasonem. Melfalan jsme podávali v redukované dávce vzhledem ke snížené funkci ledvin – 12 mg/den (0,12 mg/kg/den, 5,7 mg/m2 tělesného povrchu a den) vždy 1.–4. den cyklu, dexamethason ve stejných dávkách jako při předcházejících léčebných kúrách. Bylo podáno celkem pět cyklů a poté aplikována udržovací léčba prednisonem v dávce 5 mg denně, posléze 2,5 mg denně. Léčba byla komplikována retencí tekutin s rozvojem anasarky a dušnosti; tuto komplikaci jsme zvládli diuretiky a vedla k prodloužení intervalu mezi dvěma léčebnými cykly, ale nikoli k přerušení léčby.
Po zahájení léčby došlo k prudkému poklesu FLC na 146…36 mg/l, naproti tomu zprvu pokračoval vzestup s‑kreatininu na maximální hladinu 652 μmol/l, následovaný poklesem na 271 μmol/l. Proteinurie ještě stoupla na maximální hodnotu 7,5 g/24 h a pak poklesla na 1,5 g/24 h. Sérová koncentrace albuminu stoupla z 28 g/l na 43 g/l. Od ukončení léčby v březnu 2011 dosud je stav pacientky stabilní, poslední proteinurie je 1,5 g/24 h, s‑albumin 44 g/l, s‑kreatinin 298 μmol/l, eGF 0,22 ml/s dle MDRD, FLC 36 mg/l (vývoj laboratorních hodnot – viz tab.). Klinický stav pacientky je dobrý.
Vedle uvedeného byla pacientka léčena též antihypertenzivy, alopurinolem, omeprazolem, železem, angiagregační dávkou kyseliny acetylsalicylové, kalciem, furosemidem, hypolipidemikem, levothyroxinem a erytropoézu stimulujícími léky.
FLC‑K – volné lehké řetězce kappa, FLC‑L – volné lehké řetězce lambda, K/L – poměr kappa/lambda, s‑Krea – sérová koncentrace kreatininu, PU – proteinurie, PCR – poměr protein/kreatinin v moči, s‑Alb – sérová koncentrace albuminu, Hb – koncentrace hemoglobinu v krvi, s‑β2m – sérová koncentrace β2‑mikroglobulinu
Komentář
- MUDr. Martin Havrda, I. interní klinika 3. LF UK a FNKV, Praha
Literatura
- Fujita H, et al. Durable hematological response and improvement of nephrotic syndrome on thalidomide therapy in a patient with refractory light chain deposition disease. Int J Hematol 2011;93:673–676.
- Gharwan H, Truica CI. Bortezomib‑based chemotherapy for light chain deposition disease presenting as acute renal failure. Med Oncol 2011, online 9 April.
- Herrera GA. The kidney in plasma cell dyscrasias. Contrib Nephrol 2007;153:1–4.
- Jaccard A, et al. High‑dose melphalan versus melphalan plus dexamethasone for AL amyloidosis. N Engl J Med 2007;357:1083–1093.
- Lorenz EC, et al. Long‑term outcome of autologous stem cell transplantation in light chain deposition disease. Nephrol Dial Transplant 2008;23:2052–2057.
- Petrakis I, et al. Biopsy‑proven resolution of renal light‑chain deposition disease after autologous stem cell transplantation. Nephrol Dial Transplant 2010;25:2020–2023.
- Rajkumar SV. Prognosis and treatment of immunoglobulin light chain (AL) amyloidosis and light and heavy chain deposition disease. UpToDate 19.3. 2011
- Kategorie: Kazuistiky
- Klíčová slova: kazuistika; nemoc lehkých řetězců (LCDD)
Nemoc lehkých řetězců (LCDD) patří mezi tři nejčastější formy postižení ledvin u monoklonálních gamapatií. Poškození ledvin je u těchto onemocnění podmíněno přítomností paraproteinu, produkovaného patologickým klonem plazmatických buněk, který je specifickým způsobem deponován v renální tkáni. Oborově stojí problematika na hranici hematologie a nefrologie. U části nemocných se onemocnění manifestují primárně poškozením ledvin, nejčastěji nefrotickým syndromem nebo poklesem glomerulární filtrace, který může různou rychlostí progredovat. Nemocný je pro tyto příznaky vyšetřen nefrologem a na základě renální biopsie je diagnostikováno specifické onemocnění ledvin spolu s monoklonální gamapatií. Zásadním krokem je pak provedení dalších vyšetření (stanovení paraproteinu v séru a v moči, periferní krevní obraz, stanovení sérové kalcémie, aspirace nebo trepanobiopsie kostní dřeně, RTG nebo MR skeletu ke zhodnocení jeho ložiskového postižení) a klasifikace onemocnění. Jsou‑li splněna kritéria pro diagnózu mnohočetného myelomu, probíhá léčba podle příslušných léčebných schémat. Mnohočetný myelom se prokazuje u většiny nemocných s myelomovou ledvinou, u 65 % nemocných s LCDD a u 10–20 % nemocných s AL amyloidózou ledvin.
U nemocných s monoklonálními gamapatiemi bez prokázaného myelomu není zatím léčba renálního postižení standardizovaná. Za základ léčby lze považovat postupy zaměřené na potlačení produkce paraproteinu patologickými plazmatickými buňkami. V případě akutně se rozvíjejícího selhání ledvin může hrát roli také hydratace a úprava hyperkalcémie. V budoucnosti může narůstat význam léčebných postupů zaměřených též na jiné patofyziologické aspekty těchto onemocnění. Jde zejména o snahu o eliminaci již vytvořeného paraproteinu z cirkulace, snahu o omezení depozice paraproteinu v renální tkáni, snahu o odstranění již deponovaného paraproteinu z tkání, nebo o ovlivnění dalších patogenetických mechanismů spojených s poškozením ledvin.
V monitoraci nemocných s monoklonální gamapatií lze s výhodou využít sledování sérových koncentrací volných lehkých řetězců kappa a lambda. Fyziologická polyklonální produkce je charakterizována fyziologickým poměrem koncentrací obou typů řetězců, zatímco patologická monoklonální produkce je charakteristická vychýlením tohoto poměru ve prospěch toho typu řetězců, který produkují patologické plazmatické buňky. Při snížení glomerulární filtrace stoupá sérová koncentrace obou typů řetězců, protože klesá jejich vylučování do moči, ale jejich poměr se nemění.
U naší nemocné bylo nefrologické vyšetření indikováno z důvodu akcelerace hypertenze, nefrotického syndromu a poklesu glomerulární filtrace. Na základě renální biopsie byla diagnostikována LCDD, ale nebyl prokázán mnohočetný myelom. Za této situace jsme se rozhodli k léčbě pulsy dexamethasonu. Tato léčba byla účinná a nemocnou dobře tolerovaná. Došlo k potlačení produkce paraproteinu, což lze demonstrovat poklesem hladiny volných lehkých řetězců kappa a zlepšením poměru řetězců kappa/lambda. Došlo ke zlepšení laboratorních známek postižení ledvin s poklesem proteinurie, s normalizací albuminémie, s poklesem s‑kreatininu, zlepšila se též anémie. Efekt léčby se udržel po dobu více než tří let, poté došlo k relapsu onemocnění a opakování stejné léčby nepřineslo kýžený výsledek. Proto jsme se posléze, v situaci prudce se zhoršující funkce ledvin, rozhodli ke kombinované pulsní léčbě dexamethasonem a melfalanem. Tato léčba vedla k rychlému a velmi výraznému účinku se stabilizací funkce ledvin a s ústupem nefrotického syndromu. Nežádoucí účinky byly přijatelné. Od skončení pulsní léčby ještě neuplynul ani rok a nemůžeme předpovědět, jak dlouho bude navozená remise trvat.
V literatuře jsou popsány různé léčebné postupy v případě LCDD bez myelomu. Bylo publikováno několik malých studií, v nichž bylo dosaženo příznivého výsledku vysokodávkovanou chemoterapií s autologní transplantací kmenových buněk (HDT‑ASCT). Kasuisticky bylo po této léčbě popsáno vymizení renálních depozit lehkých řetězců. Problémem léčby je její toxicita. Hlavním cílem léčby je prevence selhání ledvin, protože extrarenální postižení je u LCDD zřídka klinicky významné. Z tohoto pohledu se léčba, spojená s více než 10% periprocedurální mortalitou, může jevit problematická. Stojí za to připomenout, že superiorita HDT‑ASCT proti pulsní léčbě melfalanem a dexamethasonem nebyla prokázána u AL amyloidózy, tedy choroby spojené s mnohem závažnějším extrarenálním postižením než LCDD.
V kasuistických sděleních bylo popsáno úspěšné využití thalidomidu a bortezomibu v léčbě LCDD. Tato léčba je jistě slibná, ale je nákladná a v našich podmínkách je pro pacienty bez prokázaného myelomu obtížně dostupná.
Závěr: V kasuistice je popsána léčba LCDD pulsy dexamethasonu a při relapsu onemocnění pulsy melfalanu a dexamethasonu. Léčba vedla k remisi nefrotického syndromu a zabránila progresi do selhání ledvin.