Léčba IgA nefropatie
Barratt J, Feehally J. Treatment of IgA nephropathy. Kidney Int 2006;69:1934–1938.
Nefropatie s ukládáním depozit z imunoglobulinu A (IgAN) je nejčastější idiopatickou glomerulonefritidou ve všech zemích, kde se provádějí renální biopsie, a představuje důležitou příčinu konečného selhání ledvin. Proto má léčba tohoto onemocnění vedoucí ke zpomalení progrese choroby zásadní medicínsko-ekonomický dopad. Přibližně 25 až 30 % nemocných s IgAN progreduje během 20–25 let trvání onemocnění do stadia terminálního selhání ledvin. Jen asi 10 % neléčených nemocných může spontánně stabilizovat či znormalizovat patologický nález v močovém sedimentu. Na progresi onemocnění má jistě vliv nejen histologický nález v renální biopsii, ale i kontrola krevního tlaku a velikost proteinurie (i když podle některých studií mohou tyto faktory ovlivňovat progresi IgAN jen ze 30 %).
Bohužel, k dispozici je stále velmi málo randomizovaných terapeutických studií, které by navíc měly dobře navržené uspořádání (včetně definování cílových parametrů a stratifikace pacientů) a zahrnovaly některé nezbytné kroky, požadované pro současné studie. Důvodem může být nejspíše pomalá progrese IgAN, což vyžaduje nemocné sledovat v dlouhém časovém intervalu, navíc by studie zahrnující větší počet nemocných musela mít nepochybně mezinárodní rozměr. Autoři této práce si dali za cíl kriticky zhodnotit dostupné randomizované kontrolované studie a vytvořit určité doporučení pro léčbu nemocných s IgAN.
Klinicky se IgAN manifestuje asymptomatickou mikroskopickou hematurií s proteinurií či bez ní. S postupujícím věkem se zvyšuje pravděpodobnost současného výskytu zhoršené renální funkce a hypertenze jako první manifestace onemocnění. Makroskopická hematurie, nastupující po infekci horních cest dýchacích, se typicky vyskytuje ve druhé až třetí dekádě života, a prakticky nikdy se s ní nesetkáme po 40. roce života. Nefrotický syndrom (často při koincidenci IgAN s minimálními změnami glomerulů), stejně jako akutní renální selhání u IgAN, je popisován zhruba u 5 % nemocných. Akutní renální selhání může být způsobeno současně přítomnou akutní tubulární nekrózou či srpkovitou formou nefritidy.
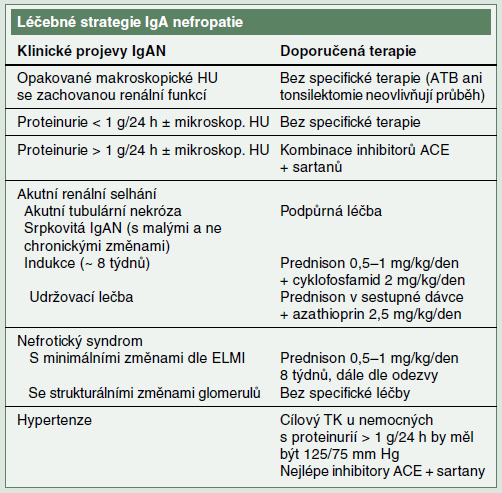
Stále neexistuje léčba, která by zabránila mesangiální depozici IgA, a tak se většina léčebných opatření zaměřuje na redukci imunitní a zánětlivé odpovědi v glomerulech a tubulo-intersticiu. Základní přehled léčebné strategie je shrnut v tabulce.
Rekurentní makroskopická hematurie. Její epizody spontánně vymizí většinou do dvou až tří dní. Jsou spouštěny infekcemi postihujícími hlavně sliznice horních cest dýchacích. Profylaktická terapie antibiotiky neovlivní dobu trvání hematurie ani celkovou prognózu nemocných. Dříve hojně prováděná tonsilektomie má nyní zastánce především v Japonsku, odkud pocházejí i dvě randomizované studie. Závěry těchto studií ale nejsou z hlediska dlouhodobé prognózy onemocnění jednoznačné.
Izolovaná mikroskopická hematurie bez/s malou proteinurií. Je obecně akceptováno, že tito nemocní s proteinurií < 1 g/ den nevyžadují specifickou terapii, pouze sledování.
Srpkovitá forma IgAN. Tato forma IgAN má i přes podávání kombinované imunosupresivní terapie horší prognózu než srpkovité formy ANCA-asociovaných vaskulitid. Udává se, že renální přežívání srpkovité IgAN je 50 % v prvním roce a jen 20 % v pátém roce od stanovení diagnózy. Pro léčbu této formy IgAN chybějí randomizované kontrolované studie. Ojedinělé práce doporučují kromě kombinované imunosuprese provádět i plazmaferézy. Podle doporučení autorů článku by ke kombinované léčbě vysokými dávkami kortikosteroidů a cyklofosfamidem měli být indikováni nemocní s více než 10 % srpků v renální biopsii, s aktivními známkami glomerulárního či tubulo-intersticiálního postižení a bez známek chronického poškození, u nichž dochází k rychlému zhoršování renální funkce.
Nefrotický syndrom u IgAN. Terapeutický zásah se v tomto případě musí striktně opírat o výsledek renální biopsie. Velkou proteinurii totiž může způsobit koincidence IgAN s minimálními změnami glomerulů, ale i těžké strukturální poškození glomerulů (popřípadě intersticiální změny), vedoucí k progresivní renální dysfunkci. V prvním případě je indikována léčba kortikosteroidy, ve druhém jen léčba symptomatická.
Pozvolna progredující IgAN. Jako tato forma IgAN je většinou definována skupina nemocných s proteinurií mezi 1–3 g/den, hypertenzí a mírně redukovanou renální funkcí v době stanovení diagnózy. Překvapivě v málo studiích se autoři opírají o histologická data, na rozdíl např. od studií se SLE nefritidou. Specifická léčba této skupiny nemocných není definována. Existuje ale několik možných přístupů a faktorů, které se v léčbě uplatňují.
Kontrola krevního tlaku (TK): U nemocných s IgAN a proteinurií > 1 g/den je doporučována cílová hodnota TK 125/75 mm Hg. Z důvodu maximální suprese systému renin- angiotensin, a tím i redukce proteinurie, jsou léky první volby k dosažení cílových hodnot TK inhibitory ACE. Studie COOPERATE ukázala aditivní účinek podávání blokátorů receptorů AT1 pro angiotensin II a inhibitorů ACE na pokles proteinurie, aniž by současně došlo k poklesu TK.
Léčba ovlivňující imunitní a zánětlivou odpověď. Podávání kortikosteroidů u tohoto typu IgAN autoři doporučují pouze u nemocných s přetrvávající proteinurií > 1 g/den i přes účinnou kontrolu TK (< 125/75 mm Hg) a současnou léčbu kombinací inhibitorů ACE + sartan. Pro podávání cyklofosfamidu a mykofenolát mofetilu u této formy IgAN jsou dle autorů slabá data, a nelze je tedy v této indikaci doporučit. Stejně tak neuspokojivá jsou data týkající se podávání rybího tuku, warfarinu, urokinázy či antiagregační terapie.
Na závěr autoři poukazují na nutnost zahájit rozsáhlé, dlouhodobé studie, kde kromě zkoumání různých léčebných režimů by byl naplněn předpoklad maximální kontroly TK při použití kombinace léků blokujících RAS systém.
Komentář
- Doc. MUDr. Romana Ryšavá, CSc., Klinika nefrologie 1. LF UK a Všeobecné fakultní nemocnice v Praze
Literatura
- Appel GB, Walkman M. The IgA nephropathy treatment dillemma. Kidney Int 2006;69:1939–1944.
- Ballardie FW, Roberts ISD. Controlled prospective trial of prednisolone nad cytotoxics in progressive IgA nephropathy. J Am Soc Nephrol 2002;
- 13:142–148. Donadio JV, Grande JP. The role of fish oil/omega-3 fatty acids in the treatment of IgA nephropathy. Semin Nephrol 2004;24:225–243.
- Strippoli GF, Manno C, Schena FP. An „evidence-based“ survey of therapeutic options for IgA nephropathy: assessment and criticism. Am J Kidney Dis 2003;41:1129–1139.
- Kategorie: Komentované články
- Klíčová slova: glomerulární filtrace
Článek, který je ve stejném časopise publikován ihned za výše uvedeným, se také zabývá léčbou IgAN (Appel et al., 2006). Autoři si v něm kladou několik otázek, na které se snaží najít odpověď. V odpovědi na otázku, proč bychom měli léčit IgAN, se kromě známého faktu nezpochybnitelně progresivního charakteru onemocnění uvádí i další argument, a sice vliv chronické renální insuficience a proteinurie na kardiovaskulární morbiditu a mortalitu. A vzhledem k tomu, že IgAN postihuje především mladé jedince, je nutné se pokusit tento rizikový faktor omezit. Na otázku, které nemocné s IgAN přednostně léčit, lze odpovědět, že ty nejrizikovější. A kteří to jsou? Dle zde citované práce ti s hodnotou kreatininu > 130 μmol/l, GF < 1,3 ml/s a proteinurií > 2,3 g/den. V mnohorozměrové analýze vyšly u této skupiny nemocných jako nezávislé rizikové faktory progrese hodnoty TK a velikost proteinurie. Každý vzestup středního arteriálního tlaku o 10 mm Hg je spojen s poklesem GF o 0,03 ml/s/rok a zvýšení proteinurie o každé 2 g/24 h snižuje GF o 0,05 ml/s/rok.
Pokud jde o hodnocení účinnosti kombinované imunosupresivní terapie u nemocných s progresivní formou IgAN, je jednou z nejvíce citovaných práce Ballardieho a Robertse (2002). V této studii bylo celkem 38 nemocných se sérovou koncentrací kreatininu > 130 μmol/l randomizováno buď k terapii placebem, či kombinaci prednisonu (dávka 40 mg/den; redukováno během dvou let na udržovací dávku 10 mg/den) a cyklofosfamidu (v dávce 1,5 mg/kg/den), který byl po třech měsících vyměněn za azathioprin v dávce 1,5 mg/den. Nemocní byli léčeni nejméně dva roky a celková doba sledování byla šest let. Výsledky renálního přežívání, a tedy zpomalení progrese IgAN, byly v léčené skupině výrazně lepší (ve druhém roce 82 vs. 68 %, ve třetím roce 82 vs. 47 % a v pátém roce sledování 72 vs. 6 %). Této studii lze ale vytknout několik důležitých nedostatků. Kromě potenciální myelotoxicity (a dalších nežádoucích účinků) při dlouhodobé terapii je to především to, že nebyly plně vyčerpány možnosti symptomatické léčby, tzn. že jen část nemocných byla léčena inhibitory ACE a nemocní léčení sartany dokonce nebyli do studie vůbec zařazeni. Nebylo tedy vůbec využito duální blokády renin-angiotensinového systému, což samo osobě mohlo výrazně zpomalit jak progresi onemocnění, tak minimálně proteinurii (která je nepochybně důležitým faktorem progrese). Na druhou stranu, na rozdíl od celé řady jiných prací o IgAN, zde byla snaha zohlednit podíl histologických změn na progresi onemocnění.
Později publikovaná metaanalýza Strippoliho (Strippoli et al., 2003) ale pozitivní efekt cytotoxické terapie na zpomalení progrese IgAN nepotvrdila. Stejně tak nebyl v této analýze prokázán pozitivní účinek cyklosporinu A.
Celkem čtyři práce také vyhodnocovaly efekt podávání rybího oleje (kombinace EPA – eicosapentaenová kyseliny a DHA – docosahexaenové kyseliny). Nejnadějnější z nich byla práce Donadia (2004), kde nemocní denně konzumovali 12 g rybího oleje. Efekt byl především v ovlivnění metabolismu arachidonové kyseliny a blokování pro-zánětlivých působků. Výsledky metaanalýzy těchto čtyř studií ale celkový účinek této terapie nepovažují za jednoznačný.
Závěrem lze konstatovat, že nám stále chybějí silná data pro léčbu IgAN, která by vycházela ze závěrů multicentrických randomizovaných studií, kde by byl léčen větší počet nemocných.