Akutní poškození ledvin u pacienta s hepatitidou E
Úvod
Akutní poškození ledvin (AKI) představuje závažnou komplikaci širokého spektra různých patologických stavů rozličné etiologie. Rovněž patogeneze rozvoje AKI bývá různorodá a ne vždy zcela detailně prostudovaná. V níže popsané kazuistice prezentujeme případ rozvoje těžkého renálního poškození při současně se rozvíjející těžké akutní jaterní lézi na podkladě infekce virem hepatitidy E. V současné literatuře není popsáno mnoho případů tohoto typu, přesvědčivé vysvětlení patofyziologického mechanismu rozvoje AKI v našem konkrétním případě chybí. Tato kazuistika je tedy podána jako diferenciálně diagnostická úvaha v případech koincidence výskytu snížené funkce ledvin u onemocnění s dominující jaterní lézí.
Kazuistika
Devětašedesátiletý pacient byl přijat na naši kliniku cestou urologické ambulance, kam ho nejprve odeslal praktický lékař, ke kterému se pacient dostavil pro tmavé zbarvení moče. Na urologické ambulanci byl bez provedení odběrů stav vyhodnocen jako uroinfekt a pacient byl propuštěn do domácího prostředí, kde zahájil antibiotickou léčbu. Pacient se po několika dnech opět dostavil na urologickou ambulanci pro nově objevený ikterus, dále referoval světlou stolici, bolesti beder, vystupňovanou únavu a nechuť k jídlu. Pro nález laboratorních známek AKI a jaterní léze nejasné etiologie byl odeslán k dalšímu vyšetření na interní ambulanci FNKV.
V osobní anamnéze je klíčovým stav po radikální cystektomii pro karcinom močového měchýře s derivací moče dle Brickera, provedené před pěti lety, nyní bez známek recidivy. Mezi ostatní přidružená onemocnění patří diabetes mellitus 2. typu zjištěný před šesti lety a nyní léčený perorálními antidiabetiky, dále arteriální hypertenze a hyperlipidemie (nezjištěná délka trvání obou onemocnění). Pacient dlouhodobě užívá p.o. medikaci: perindopril (8 mg denně), moxonidin (0,3 mg denně), metformin (850 mg denně) a rosuvastatin (20 mg denně). Pacient negoval abúzus alkoholu či drog, nekouří. Poslední týdny užíval výhradně chronickou medikaci, dietní chyby v posledních několika dnech si nebyl vědom. Pacient poslední týdny trávil většinu času na chalupě mimo město, kromě úklidu půdy bez anamnézy větší fyzické zátěže.
Vstupně byly zjištěny následující laboratorní hodnoty: kreatinin 430 µmol/l (63–104 µmol/l), urea 20 mmol/l (2,80–8,00 mmol/l), celkový bilirubin 175 µmol/l (< 21,0 µmol/l), přímý bilirubin 161 µmol/l (< 5,0 µmol/l), alaninaminotransferáza (ALT) 31,7 µkat/l (< 0,73 µkat/l), aspartátaminotransferáza (AST) 14 µkat/l (< 0,67 µkat/l), alkalická fosfatáza (ALP) 4 µkat/l (0,66–2,20 µkat/l), gama‑glutamyltransferáza (GGT) 6,7 µkat/l (< 1,77 µkat/l), laktátdehydrogenáza (LDH) 5,11 µkat/l (< 4,10 µkat/l), C‑reaktivní protein (CRP) 20 mg/l (< 5,0 mg/l), hemoglobin (Hb) 131 g/l (135,0–175,0 g/l), leukocyty 6,07 × 109/l (4,00–10,00 × 109/l), trombocyty 92 × 109/l (150–400 × 109/l), mezinárodní normalizovaný poměr (INR) 1,16 (0,80–1,20), retikulocyty 1,3 % (0,5–2,5 %). V močovém sedimentu byla přítomna výrazná erytrocyturie 2 300/µl (0–12/µl), mírná proteinurie 0,74 g/l (< 0,15 g/l), leukocyturie 92/µl (0–20/µl), dále zvýšená hodnota bilirubinu. Osmolalita moče dosahovala hodnot 283 mmol/kg (770–1 200 mmol/kg). Koncentrace imunoglobulinu G (IgG) v séru byla 10,3 g/l (7,0–16,0 g/l), imunoglobulinu A (IgA) 4,24 g/l (0,7–4,0 g/l), imunoglobulinu M (IgM) 2,9 g/l (0,4–2,3 g/l), imunoglobulinu E (IgE) 6,3 IU/ml (< 100,0 IU/ml). Nápadně snížené byly koncentrace složky C3 a C4 komplementu, a sice 0,49 g/l (0,75–1,35 g/l), respektive 0,05 g/l (0,09–0,33 g/l). Imunologické vyšetření dále prokázalo slabou pozitivitu protilátek proti proteináze (c‑ANCA s titrem 1 : 20, přičemž titr protilátek anti‑PR3 a anti‑MPO byl v mezích normy: anti‑PR3 1,23 U/ml (< 3,50 U/ml), anti‑MPO 1,54 U/ml (< 9,00 U/ml).
Při vstupním vyšetření dominovaly fyzikálnímu nálezu ikterický kolorit a zvětšená, palpačně citlivá játra hmatná pod pravým žeberním obloukem. Pacient byl afebrilní, normotenzní, při fyzikálním vyšetření bez dalších podstatnějších patologických odchylek.
Bylo doplněno ultrasonografické vyšetření břicha s následujícími nálezy: hraniční velikost pravého jaterního laloku s homogenním setřelým parenchymem, bez obrazu dilatace intrahepatálních a extrahepatálních žlučových cest, dále normálně velké ledviny se setřelou strukturou, ale s širší kůrou při suspektní diabetické nefropatii, kdy v takto primárně postiženém terénu nešlo vyloučit akutní iritaci.
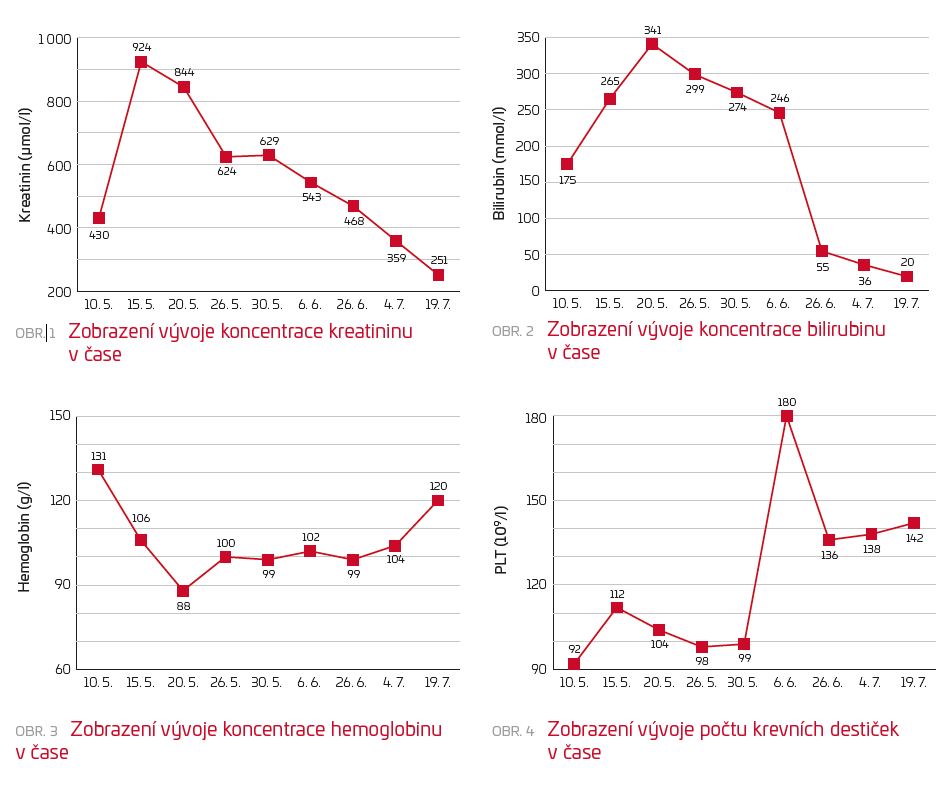
V průběhu hospitalizace došlo k rychlé progresi AKI až do fáze oligoanurického renálního selhání (obr. 1), pacientovi byl po čtyřech dnech od přijetí zaveden centrální žilní katétr a byla zahájena hemodialyzační léčba (HD). Současně docházelo k postupnému vzestupu koncentrace bilirubinu v séru při vysoké koncentraci jaterních transamináz přítomné již v době přijetí pacienta (ALT 31,7 µkat/l, AST 14 µkat/l) (obr. 2).
K objasnění příčiny rozvoje AKI byla pátý den hospitalizace provedena renální biopsie (RB) s obrazem přítomnosti akutní tubulární nekrózy fokálně s nekrózou epitelu, s nápadným edémem intersticia a s mírnou kulatobuněčnou zánětlivou celulizací. Diferenciálně diagnosticky se na prvním místě vzhledem k anamnéze a k laboratornímu nálezu zvažovala především infekční etiologie onemocnění.
Sérologickými metodami byla vyloučena nákaza virem hepatitidy A, hepatitidy B i hepatitidy C, rovněž byla vyloučena nákaza hantaviry. Z ostatních sérologických vyšetření byla vyslovena suspekce na přítomnost Leptospira icterohaemorrhagiae s titrem protilátek 1 : 200, přičemž tato hodnota je považována za slabě pozitivní.
Vzhledem k infekční etiologii onemocnění byl pacient po sedmi dnech od přijetí přeložen na Kliniku infekčních, parazitárních a tropických nemocí Nemocnice na Bulovce v Praze. Celkově čtrnáctý den hospitalizace byl z externí laboratoře hlášen vysoký titr IgM protilátek proti viru hepatitidy E, následně i protilátek IgG, pomocí perkutánní koronární intervence (PCR) byla prokázána pozitivita viru hepatitidy E ve stolici. Kontrolní sérologické vyšetření na leptospirózy bylo negativní, stav byl tedy uzavřen jako akutní virová hepatitida E.
Pacientovi byla průběžně poskytována léčebně komplexní podpůrná terapie, vzhledem ke zhoršování klinického stavu s rozvojem hypotenze s nutností přechodné katecholaminové podpory, opakované substituce koagulačních faktorů v podobě mražené krevní plazmy pro spontánní koagulopatii s hodnotami INR dosahujícími nejvýše 1,54 (bylo podáno celkem 11 mražených plazem), dále s nutností opakované hemosubstituce (celkem 12 transfuzních jednotek erymasy) pro rozvoj krvácivých komplikací – konkrétně šlo o epizodu masivní makroskopické hematurie, ke které došlo devět dní po provedení RB (obr. 3, 4). Bylo doplněno CT vyšetření s obrazem přítomnosti koagula vyplňujícího pánvičku pravé ledviny, s hydronefrózou, nicméně bez jasného průkazu zdroje krvácení. Byla zvažována souvislost s provedenou RB, nicméně další diagnostické výkony již nebyly provedeny. Pacientovi byla poskytnuta komplexní léčba hepatorenálního selhání včetně podávání terlipresinu, pravidelně byly prováděny obdenní HD s využitím citrátové antikoagulace.
Vzhledem ke zlepšování klinického stavu v dalším průběhu hospitalizace bylo ustoupeno od antivirotické léčby hepatitidy E ribavirinem. Postupně docházelo k poklesu hodnot jaterního souboru (sérové koncentrace bilirubinu, transamináz) a k normalizaci koagulačních parametrů. Dále došlo k rozvoji polyurické fáze renálního selhání s přechodnou nutností parenterální rehydratace. Poslední, dvanáctá, HD proběhla čtyřicátý třetí den od přijetí, následně se známkami postupného obnovení renální funkce a s umožněním propuštění pacienta do ambulantní péče. Koncentrace kreatininu v séru v době propuštění pacienta byla 359 µmol/l, při kontrole v nefrologické ambulanci 15 dní po propuštění s dalším poklesem na 251 µmol/l (obr. 1).
Komentář
Literatura
- Yang CW. Leptospirosis renal disease: Understanding the initiation by Toll‑like receptors. Kidney Int 2007;72:918–925.
- Pragya K, Sarthak M, Bipadabhanjan M, et al. Massive Hemolysis Causing Renal Failure in Acute Hepatitis E Infection. J Clin Transl Hepatol 2016;28:345–347
- Amitabh M, Ravinder PS, Anju A, et al. Case report: Acute hepatitis E infection with coexistent glucose‑6‑phosphate dehydrogenase deficiency. Can J Infect Dis Med Microbiol 2003;14:230–231.
- Mazdak A, Khalighi M, Kammi JH, et al. Intratubular Hemoglobin Casts in Hemolysis‑Associated Acute Kidney Injury. Am J Kidney Dis 2015;65:337–341.
- Jaymon P, Saqib W, Nikhil K, et al. Bile cast nephropathy: A case report and review of the literature. World J Gastroenterol 2016; 22:6328–6334.
- Bredewold OW, Fijter JW, Rabelink T, et al. A case of mononucleosis infectiosa presenting with cholemic nephrosis. NDT Plus 2011;4:170–172.
- Chávez‑Iñiguez JS, Meza‑Ríos A, Santos‑Garcia A, et al. Cholemic nephropathy: Hyperbilirubinemia and its impact on renal function. J Ren Hepat Disord 2019;3:33–39.
- Lata J. Hepatorenální syndrom. Interní Med 2013;15:253–255.
- Ohashi R, Hosokawa Y, Kimura G, et al. Acute renal failure as the presenting sign of disseminated intravascular coagulation in a patient with metastatic prostate cancer. Int J Nephrol Renovasc Dis 2013;6:47–51.
- Ohashi R, Ishii H, Naito Z, et al. Morphological spectrum of renal pathology and its correlation to clinical features in patients with disseminated intravascular coagulation: A study involving a series of 21 autopsy cases. Pathol Int 2014;64:443–452.
- Gowri SP, Sayi P, Ashok B, et al. A Study of Hepatitis E in Pregnancy: Maternal and Fetal Outcome. J Obstet Gynaecol India 2016;66:18–23.
- Pischke S, Hartl J, Pas SD, et al. Hepatitis E virus: Infection beyond the liver? J Hepatol 2017;66:1082–1095.
- Verschuuren EA, Haagsma EB, Zijlstra JG, Stegeman CA. Non‑oliguric acute renal failure associated with hepatitis E. Nephrol Dial Transplant 1997;12:799–801.
- Kategorie: Kazuistiky
- Klíčová slova: akutní poškození ledvin; akutní tubulární nekróza; hepatitida E; kazuistika
Příčina rozvoje a rychlé progrese AKI není doposud zcela zřejmá, diferenciálně diagnosticky byly zvažovány a postupně vylučovány následující možnosti: postižení ledvin při leptospiróze, AKI provázející masivní hemolýzu, biliární nefropatie, hepatorenální syndrom, možný podíl rozvoje diseminované intravaskulární koagulace a doposud neprostudovaný přímý nefrotoxický vliv viru hepatitidy E.
Symptomy onemocnění i laboratorní průběh odpovídaly diagnóze leptospirózy, rovněž epidemiologická souvislost a sérologicky potvrzená pozitivita protilátek proti Leptospira icterohaemorrhagiae a obraz renální biopsie by tuto hypotézu potvrzovaly. Právě pro renální manifestaci leptospirózy je typický morfologický obraz akutní tubulointersticiální nefritidy (ATIN) s charakteristickým nálezem edému intersticia, přítomnosti kulatobuněčné zánětlivé celulizace a poškození tubulárních buněk až s obrazem akutní tubulární nekrózy (ATN).1
Nicméně titr protilátek proti Leptospira icterohaemorrhagiae byl pouze těsně nad hraniční hodnotou, tedy ne zcela signifikantní pro infekci, během hospitalizace bylo navíc doplněno kontrolní sérologické vyšetření s negativním nálezem, leptospiróza byla tedy vyloučena.
Čtrnáctý den po přijetí byla definitivně potvrzena infekce virem hepatitidy E. V literatuře byly popsány ojedinělé případy masivní intravaskulární hemolýzy u pacientů s akutní hepatitidou E v kombinaci s kongenitálním deficitem glukóza‑6‑fosfát dehydrogenázy.2,3 Právě masivní intravaskulární hemolýza a s ní související hemoglobinurie by mohly vysvětlovat akutní poškození ledvin prostřednictvím tvorby precipitátů hemoglobinu poškozujících epitel tubulárního aparátu nefronu se spolupodílem přímého cytotoxického efektu volného hemoglobinu na epitelové buňky proximálního tubulu. Pro možnost této diagnózy by svědčila přítomnost hematurie, pokles v červeném krevním obraze a přítomnost histologického obrazu ATN ve vzorku z renální biopsie. Hemoglobinové válce nebyly ve vzorku přítomny, ale jak je dobře známo, ve většině případů AKI doprovázející intravaskulární hemolýzu nejsou v histologických vzorcích z renální biopsie k zastižení.4 Nicméně proti hypotéze uplatnění hemolýzy na rozvoji AKI u našeho pacienta svědčí pouze nevelké zvýšení hodnot laktátdehydrogenázy a přítomnost převážně konjugované hyperbilirubinemie, dále malé množství retikulocytů v krevním obraze. Masivní hemolýza se tedy nezdá jako pravděpodobné vysvětlení rozvoje AKI.
Další zvažovanou klinickou jednotkou s možným podílem na rozvoji AKI byla biliární nefropatie. Jedná se o akutní postižení ledvin při současně přítomné hyperbilirubinemii v důsledku tvorby precipitátů solí žlučových kyselin v tubulárním aparátu ledviny se spolupodílem přímého toxického účinku bilirubinu a žlučových kyselin na buňky tubulárního aparátu. Většina dostupné literatury popisuje vznik biliární nefropatie u pacientů s chronickým jaterním onemocněním, nicméně existují i případy rozvoje biliární nefropatie u akutní jaterní léze.5,6 U biliární nefropatie lze v histologickém vzorku z renální biopsie nalézt celé spektrum patologických změn, nejčastěji obraz ATN s intersticiálním edémem s možnou zánětlivou celulizací, přičemž glomeruly zůstávají intaktní. Téměř ve všech studovaných případech byly v histologickém vzorku nalezeny pigmentové válce v dilatovaném tubulárním aparátu nefronu.7 Právě absence těchto válců v histologickém vzorku z renální biopsie v našem případě možnou diagnózu biliární nefropatie zpochybňuje.
Rovněž hepatorenální syndrom (HRS) se nezdá jako pravděpodobné vysvětlení rozvoje akutního selhání ledvin u našeho pacienta. HRS je definován jako funkční selhání ledvin při jaterním onemocnění s portální hypertenzí a představuje vyvrcholení systémových cirkulačních změn při portální hypertenzi. Jeden z hlavních rysů HRS představují morfologicky intaktní ledviny.8 Ultrasonografické vyšetření v době přijetí pacienta bylo s absencí známek portální hypertenze a renální biopsie prokázala morfologické postižení ledvin, o HRS se tedy jednat nemohlo.
Laboratorní nález prohlubující se trombocytopenie a známek spontánní koagulopatie v kombinaci s renální insuficiencí mohl naznačovat podíl diseminované intravaskulární koagulace (DIC). Nicméně z důvodu nepřítomnosti dalších známek orgánového selhávání a pro absenci typického morfologického nálezu v histologickém vzorku z renální biopsie, kdy u DIC většinou dominuje přítomnost trombů bohatých na fibrin obturujících lumina glomerulárních kapilár a aferentních arteriol,9,10 se podíl DIC na renální insuficienci v našem případě jeví jako nepravděpodobný. Rovněž případů DIC vyvolaných infekcí virem hepatitidy E v současné literatuře není mnoho a týkají se zejména gravidních žen.11
Extrahepatální manifestace virové hepatitidy E jsou známým a relativně častým fenoménem, jenž se může projevit postižením různých orgánových systémů. V současné literatuře jsou popsány případy renální manifestace hepatitidy E, v převážné většině u imunosuprimovaných jedinců, nicméně existují rovněž případy renálního poškození u imunokompetentních jedinců. Histologicky jde o postižení ledvin v podobě membranoproliferativní glomerulonefritidy, membranózní glomerulonefritidy, nefroangiosklerózy nebo relapsu IgA nefropatie, přičemž se předpokládá etiologický podíl mechanismů mediovaných imunitním systémem ve spojitosti s pozitivním titrem chladových protilátek.12 Nicméně renální biopsie v našem případě neprokázala morfologické postižení glomerulů, ale intersticia.
V současné literatuře je popisován pouze ojedinělý případ AKI na podkladě biopticky verifikované ATN u imunokompetentního pacienta s infekcí virem hepatitidy E.13 V naší kazuistice jsme postupně vyloučili možné příčiny renálního selhání, lze tedy předpokládat, podobně jako ve výše citovaném případě, uplatnění dosud neprostudovaného přímého nefrotoxického vlivu viru hepatitidy E.