Pacient s chronickým onemocněním ledvin z pohledu nutričního terapeuta VFN v Praze
SOUHRN
Dietní terapie se zásadně liší u tří základních skupin onemocnění. Péče o pacienty s akutním onemocněním ledvin probíhá za hospitalizace. Do nutriční ambulance přicházejí pacienti s chronickým onemocněním ledvin (CKD), a to jak v rámci dialyzační, tak i konzervativní léčby. Nutriční péče o pacienty s CKD je komplexní, systematická a dlouhodobá. Preventivně i terapeuticky ovlivňuje více faktorů zároveň. Mezi základní mikro a makroživiny, které jsou středem zájmu nutričního terapeuta, patří: bílkoviny, draslík, fosfor a sodík. Většinou je třeba dietu přizpůsobit dalším přidruženým onemocněním, jako je diabetes mellitus 2. typu, obezi-ta či malnutrice.
Na Klinice nefrologie VFN je pacient k nutriční péči indikován svým nefrologem. Ten zároveň určuje některé parametry diety, jako jsou množství bílkovin, tekutin, draslíku či fosforu. Pacient je také instruován, jak zaznamenat třídenní jídelníček do připravené ša-blony. Tento zápis se po propočtu nutriční terapeutkou stává podkladem pro konzultaci. Změny v jídelníčku jsou s každým pacien-tem domlouvány individuálně, podle jeho možností a preferencí, což zvyšuje dlouhodobou adherenci k dietě. Nedílnou součástí je i dobrý vzájemný vztah, díky kterému nutriční terapeut od pacienta získá pravdivé informace o dodržování režimu. Na konci kon-zultace jsou pacientovi předány přehledné edukační materiály. Dále pak probíhají pravidelné kontroly zápisu jídelníčku a individuální nutriční konzultace v rozmezí šesti týdnů.
Dieta v predialyzačním období
Dietě v predialyzačním období dominuje omezení příjmu bílkovin, tzv. nízkobílkovinná dieta (NBD) je předmětem diskusí již řadu let. Pozitivní výsledky přinesla metaanalýza autorů Foque a spol. z roku 1992, kde byl prokázán pokles proteinurie, stabilizace metabolického stavu a oddálení zahájení dialyzační léčby až o rok ve srovnání s kontrolní skupinou bez dietní intervence.1 Výsledky velké randomizované studie Modification of Diet in Renal Disease (MDRD) z roku 1994 byly nejprve vyhodnoceny tak, že NBD nemá vliv na progresi chronického onemocnění ledvin (CKD), a naopak přináší riziko malnutrice. Pozdější interpretace této studie už ale nejsou tak negativní a přiklánějí se k pozitivnímu vlivu NBD a k poměrně malému riziku malnutrice při dobré zdravotní péči.2 Objevilo se ale i mnoho studií, kde účinek prokázán nebyl.
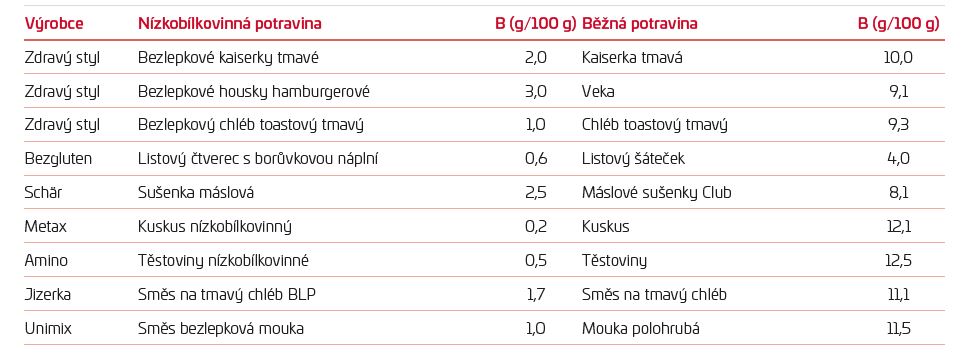
Velké uplatnění měla nízkobílkovinná dieta před dostupností dialyzační léčby, nemělo by se na ni však zapomínat ani dnes. Snahou je oddálit nutnost zahájení dialyzační léčby, která významně snižuje kvalitu života pacientů. Příjem bílkovin je většinou omezován na 0,6–0,8 g/kg tělesné hmotnosti (TH)/den. Při omezení na 0,6 g/kg TH/den a méně by měla probíhat suplementace ketoanalogy (esenciálních) aminokyselin. Při příjmu bílkovin 0,8 g/kg TH/den lze ketoanaloga využít také. Přísnější diety se využívají pouze u starších pacientů nepřejících si zahájení dialyzační léčby či u velice motivovaných pacientů prospívajících na takové dietě.3 Kromě množství bílkovin je třeba se soustředit i na jejich biologickou hodnotu. Nejvyšší biologickou hodnotu mají bílkoviny při kombinaci vajec s mlékem, brambory či pšenicí ve správném poměru. Z tohoto faktu vychází i známá bramborovo‑vaječná dieta, kterou publikovali Reinhold Kluthe a Herbert Quirin v Německu už v roce 1998. Naopak bílkoviny samotné pšenice mají nízkou biologickou hodnotu a zároveň tvoří nezanedbatelnou část bílkovin přijatých v běžné stravě. Proto se příjem pšeničných výrobků omezuje a nahrazuje nízkobílkovinnými produkty. Porovnání běžných a nízkobílkovinných potravin ukazuje tabulka 1.
TABULKA 1 Porovnání nízkobílkovinných a běžných potravin
Pacient dokáže těmito záměnami snížit příjem bílkovin o 25 g a více. Sortiment nízkobílkovinných potravin, mezi které patří i většina bezlepkových, se stále rozšiřuje. Dostupnost v běžných obchodech a supermarketech v posledních letech rapidně vzrostla. Cena bohužel zůstává poměrně vysoko, přibližně na trojnásobku ceny běžných potravin ve stejných kategoriích. Nalezneme ale i potraviny, například těstoviny, ve stejné cenové relaci jako ty běžné. O příspěvek na dietní stravování mohou žádat pouze pacienti v hmotné nouzi.
Někteří odborníci se přiklánějí k vegetariánské dietě, jiní naopak k dietě s regulovanou konzumací masa. Podle mého názoru je třeba volit dietu podle preferencí pacienta, čímž se zlepší dlouhodobá adherence k dietě. To ukázali i Picolli a spol. ve své studii, kde si pacienti sami vybírali mezi veganskou dietou se suplementací ketoanalogy a běžnou dietou s nízkobílkovinnými potravinami. Efekt obou diet byl srovnatelný.
Příjem sacharidů a tuků neovlivňuje ledvinné funkce přímo, mají spíše vliv na celkový příjem energie. Tuky mají vysoký obsah energie, 1 g představuje 38 kJ, proto je důležité jejich omezování u pacientů s nadváhou a obezitou, naopak u pacientů s malnutricí jejich příjem zvyšujeme. Z důvodu zvýšeného kardiovaskulárního rizika u pacientů s onemocněním ledvin by měl být kladen důraz i na kvalitu přijímaných tuků. Nasycené tuky by měly tvořit maximálně jednu třetinu, vhodným zdrojem nenasycených mastných kyselin jsou ryby a rostlinné oleje kromě palmového, palmo‑jádrového a kokosového tuku. Polysacharidy by měly být hlavním zdrojem energie u zdravého jedince i pacienta s onemocněním ledvin. Měly by tvořit asi 50 % celkového energetického příjmu. Naopak příjem potravin s přidanými cukry, tedy monosacharidy a disacharidy, by měl být omezen na minimum. Větší pozornost sacharidům věnujeme u pacientů s diabetem a diabetickou nefropatií. Poměrně málo diskutovaným tématem je vláknina, dokonce ani guidelines pro CKD KDIGO (Kidney Disease: Improving Global Outcomes) 2012 její doporučený příjem nepopisují. Vláknina se v potravinách často vyskytuje společně s draslíkem. Při přísné restrikci draslíku tak dochází i k nedostatečnému příjmu vlákniny, čímž je pacient připraven o její pozitivní vliv na krevní lipidy, rozvoj aterosklerózy i hodnotu C‑reaktivního proteinu (CRP).4 Úlohou nutričního terapeuta je proto pacienta edukovat, že i přes obsah draslíku v ovoci a zelenině není žádoucí ho zcela vynechat. Nízký obsah draslíku mají především jablka, hrušky, borůvky, jahody, ledový salát, čekanka, hlávkový salát, čínské zelí či salátové okurky. Pro přípravu salátů se hodí sterilované okurky či hrášek. Obsah draslíku můžeme také vhodně snížit technologickými úpravami. Máčením zeleniny nakrájené na malé kousky se sníží množství draslíku o 30 %. Důležité je však vodu dále nepoužívat. Tímto postupem v kombinaci s vařením dosáhneme snížení obsahu draslíku až o 50 %. Využití této metody je vhodné především při přípravě brambor, ale i jiných druhů zeleniny jako brokolice, květáku, mrkve, zelených fazolek. Pokud vylijeme šťávu z kompotu, dojde ke snížení o 30–50 %, hlubokým zmrazením a rozmrazením asi o 30 %. Nejvíce draslíku odstraníme vařením, proto není vhodné pečení, opékání, smažení či příprava v páře či na grilu.
Fosfor se vyskytuje hlavně v bílkovinných potravinách, proto při nízkobílkovinné dietě dochází přirozeně k jeho restrikci. Dalším významným zdrojem jsou potravinová aditiva (většinou soli fosforu), která se nacházejí v masných výrobcích, instantních produktech, ale i v některých nápojích. Tyto potraviny jsou však většinou nevhodné z více hledisek, z nichž jedním je i vysoký obsah sodíku (soli). Příjem sodíku je třeba regulovat individuálně. Většinou je však u obecné populace i pacientů v predialyzačním stadiu CKD vhodná jeho restrikce. Snížený příjem sodíku podporuje efekt nízkobílkovinné diety na snížení intraglomerulárního tlaku, a tím snížení nároků na glomerulární filtraci. Vhodným řešením může být nahrazení soli bylinkami. Doporučuje se bylinky přidávat čerstvé nebo mražené (např. kopr, petrželku, libeček, oregano, saturejku, estragon, majoránku). Při přípravě pokrmů je třeba mít vždy na paměti přiměřenost množství. Také bylinky totiž obsahují draslík a fosfor.5
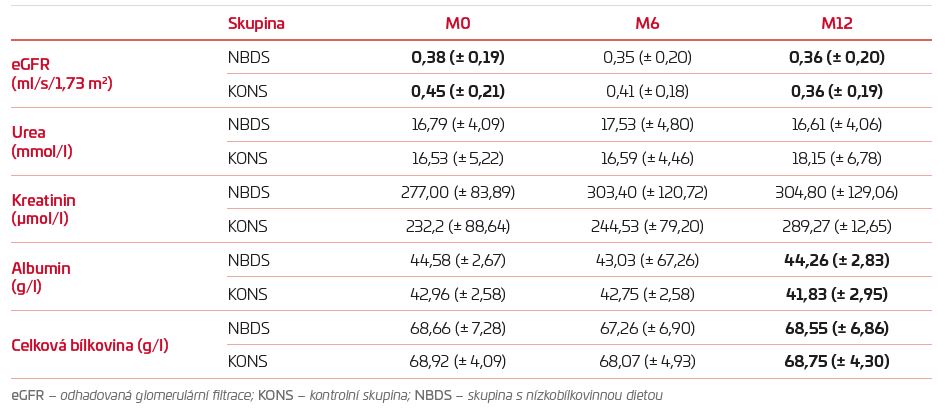
TABULKA 2 Výsledky studie
Lékař určuje vhodný příjem tekutin. V počátečních stadiích je snahou udržet pitný režim na 2–2,5 l, pokud pacient nemá otoky či srdeční selhání. Příjem tekutin se postupně se zhoršováním ledvinných funkcí snižuje, doporučené množství přijatých tekutin pak odpovídá diuréze za 24 hodin + 500 ml. Základ pitného režimu by měla tvořit voda – nejlépe stolní bez obsahu cukru a chemických přídatných látek. Minerální vody lze zařazovat, ale pouze ty, které mají nižší obsah vápníku a sodíku. Mezi vody s vyšším podílem zmiňovaných látek patří např. Šaratice, Vincentka, Zaječická, Poděbradka nebo Hanácká kyselka. Na našem trhu jsou k dostání i různé ochucené vody, nejen minerální, ale i stolní. Každá slazená ochucená voda v sobě obsahuje cukr, který při častém popíjení nápoje může mít za následek zvyšování tělesné hmotnosti. Slazené vody, limonády apod. by měly být jen doplňkem pitného režimu, a nikoliv jeho základem. Do pitného režimu patří samozřejmě čaje. Mezi povolené čaje patří všechny druhy čajů, vždy ale ve slabším výluhu. Černý a zelený čaj obsahuje tein, což je látka velmi podobná kofeinu, který je v kávě a má také močopudné účinky. Bylinné a ovocné čaje jsou povoleny bez omezení. I zde platí, že nápoj není nutné výrazně doslazovat. Nevhodné jsou instantní nápoje kvůli obsahu fosforu a ovocné šťávy kvůli obsahu kalia.
Studie
Nutriční databáze a odkaz na webové stránky:
https://www.kaloricketabulky.cz/
https://www.nutridatabaze.cz/
https://www.nutriservis.cz/cs/
https://www.nizkobilkovinnadieta.cz/
Dodržování diety v ambulantních podmínkách je ovlivňováno mnoha faktory a samotný předpis nezaručí výsledky. I proto jsme se rozhodli ověřit účinnost nízkobílkovinné diety, která je pacientům indikována a současně jsou o ní edukováni na Klinice nefrologie Všeobecné fakultní nemocnice (VFN), v malé retrospektivní studii. Ta porovnávala pacienty, u nichž byla indikována nízkobílkovinná dieta a dodržovali ji alespoň po dobu jednoho roku, s pacienty, u nichž tato dieta indikována nebyla. Vstupní data byla získána retrospektivně ze zdravotní dokumentace pacientů, kteří docházeli ambulantně na Kliniku nefrologie VFN v období od října 2016 až do března 2018. Ke skupině 15 pacientů dodržujících nízkobílkovinnou dietu byla přiřazena kontrolní skupina s 15 pacienty, u kterých edukace o nízkobílkovinné dietě neproběhla. Laboratorní data byla sbírána v čase první edukace a po 6 a 12 měsících. Hlavní získané výsledky (také viz tab. 2): U kontrolní skupiny (KONS) došlo k většímu poklesu glomerulární filtrace (GF) – z 0,45 ± 0,21 ml/s/1,73 m2 na 0,36 ± 0,19 ml/s/1,73 m2 (–0,9 ml/s/1,73 m2). U skupiny s nízkobílkovinnou dietou (NBDS) došlo jen k nevýznamnému snížení průměrné hodnoty GF z 0,38 ± 0,19 ml/s/1,73 m2 na 0,36 ± 0,20 ml/s/1,73 m2 (–0,02 ml/s/1,73 m2). Nenastaly významné změny v hodnotách urey v krvi. Vývoj koncentrací kreatininu odpovídá vývoji GF, tedy u KONS došlo k většímu vzestupu. Koncentrace albuminu se u žádného pacienta nevychýlily z normy, průměrná hodnota po roce NBD byla 44,58 ± 2,67 g/l. Průměrné hodnoty celkové bílkoviny se pohybovaly ve všech časech u NBDS i KONS mezi 68,5 a 69,0 g/l. Podle těchto výsledků bylo u daného souboru pomocí nízkobílkovinné diety dosaženo zpomalení progrese chronického onemocnění ledvin. Zároveň nedošlo k významnému zhoršení nutričního stavu pacientů. Tento fakt potvrzuje, že nízkobílkovinná dieta s řádnými edukacemi pacienta má své nezastupitelné místo v léčbě CKD.
Literatura
- Fouque, D, Laville M, Boissel JP, et al. Controlled low protein diets in chronic renal insufficiency: meta analysis. BMJ 1992;304:216–220.
- Kopple JD, Levey AS, Greene, T, Chumlea WC, et al. Effect of dietary protein restriction on nutritional status in the Modification of Diet in Renal Disease Study. Kidney Int 1997;52:778–791.
- Vachek J. Možnosti konzervativní terapie chronického onemocnění ledvin. Medical Tribune 2014;10(18). https://www.tribune.cz/clanek/33939 moznostikonzervativni terapie chronickeho onemocneni ledvin
- Krishnamurthy VM, Wei G, Baird BC, et al. High dietary fiber intake is associated with decreased inflammation and all cause mortality in patients with chronic kidney disease. Kidney Int 2012;81:300–306.
- Kalantar Zadeh K, Fouque D. Nutritional Management of Chronic Kidney Disease. N Engl J Med 2017;377:1765–1776.
- Evenepoel P, Meijers B. Dietary fiber and protein: nutritional therapy in chronic kidney. Kidney Int 2012;81:227–229
- Kategorie: Názor hosta
- Klíčová slova: dieta; chronické onemocnění ledvin; malnutrice; nízkobílkovinná dieta; nutriční podpora