Vyšetření močového sedimentu v předpovědi rizika relapsu ANCA asociované vaskulitidy v ledvinách
Rhee RL, Davis JC, Ding L, et al.
Renální postižení ve formě rychle progredující glomerulonefritidy představuje závažnou manifestaci ANCA‑asociované vaskulitidy (AAV), s vysokým rizikem rozvoje terminálního selhání ledvin (ESRD) a následného úmrtí.1 O významu přetrvávající mikroskopické hematurie u nemocných s AAV, kteří dosáhli remise po standardní indukční terapii, přetrvávají dosud nejednoznačné názory.2,3 Někteří experti považují perzistující hematurii za marker pokračující aktivity onemocnění, zatímco jinými odborníky může být přisuzována následkům předchozího renálního poškození.
K vyhodnocení prospěšnosti provádění pravidelné analýzy moči u AAV byl vyšetřován vztah mezi hematurií a proteinurií po ukončení indukční terapie, současně s dalšími hodnoceními studií u nemocných zařazených do studií RAVE (Rituximab in ANCA‑Associated Vasculitis Trial) a studie WGET (Wegener’s Granulomatosis Etanercept Trial).4–6 Jedná se o multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studie zahrnující nemocné s AAV, kteří měli aktivitu onemocnění hodnocenou podle známého skórovacího systému BVAS/GPA (Birmingham Vasculitis Activity Score for Granulomatosis with Polyangiitis) minimálně třemi body. Vyhodnocení renálního postižení podle BVAS/GPA zahrnuje tři položky: 1) přítomnost hematurie (≥ 1 + stanovená močovým proužkem nebo 10 a více erytrocytů na zorné pole), 2) přítomnost erytrocytárních válců, 3) vzestup sérové koncentrace kreatininu > 30 %, pokles v clearance kreatininu o více než 25 %.7 Nová nebo zvětšující se hematurie nebyla ve výstupu studie analyzována, neboť její zahrnutí ve vstupních i výstupních kritériích by mohlo vést k nadhodnocení asociace hematurie a renálního relapsu. K vyhodnocení vztahu zhoršující se hematurie (definované počtem erytrocytárních válců v zorném poli ve světelném mikroskopu) a renálního relapsu byla použita pouze data ze studie RAVE, ve které byla prováděna kvantifikace hematurie. Renální relaps byl na základě těchto modifikací tedy definován výskytem nových erytrocytárních válců či zvýšením jejich počtu a/nebo zhoršující se renální funkcí podle BVAS.
Frekvence studijních vizit byla mezi studiemi podobná, při každé vizitě bylo provedeno vyšetření moči proužkem a mikroskopická analýza močového sedimentu. Pacienti byli zařazeni do těchto dvou studií, pokud splňovali následující kritéria: 1) diagnóza granulomatózy s polyangiitidou nebo mikroskopické polyangiitidy podle Chapel Hill Consensus Conference z roku 19948 nebo podle klasifikačních kritérií American College of Rheumatology,9 2) přítomnost nejméně jedné položky zahrnující renální postižení podle BVAS/GPA, 3) pozitivita proteinázy 3 (PR3) – ANCA nebo myeloperoxidázy (MPO)‑ANCA stanovená metodou ELISA. Ze studie byli vyloučeni nemocní, kteří nedosáhli remise během šesti měsíců od zařazení do studie nebo pokud se nenacházeli v setrvalé remisi po dobu minimálně šesti měsíců. Dále nebyli zařazeni pacienti v pravidelném hemodialyzačním programu, vyloučeni byli nemocní s rozvinutým relapsem onemocnění či s ESRD.
Z celkového počtu 377 účastníků v obou studiích splňovalo kritéria pro zařazení 149 pacientů (99 pacientů ze studie RAVE, 50 pacientů ze studie WGET). U všech zařazených nemocných byly vstupně zjištěny známky renálního postižení s hematurií, 37 nemocných (37 %) pacientů ze studie RAVE absolvovalo renální biopsii. Data z renálních biopsií ve studii WGET nebyla dostupná. Z těchto 37 pacientů, kteří podstoupili biopsii, byla u všech (100 %) přítomna nová a zvětšující se hematurie, u 78 % nemocných bylo patrno zvýšení sérové koncentrace kreatininu a u 65 % případů byly prokázány erytrocytární válce. Přetrvávající hematurie za šest měsíců od zařazení byla zjištěna u 42 % pacientů.
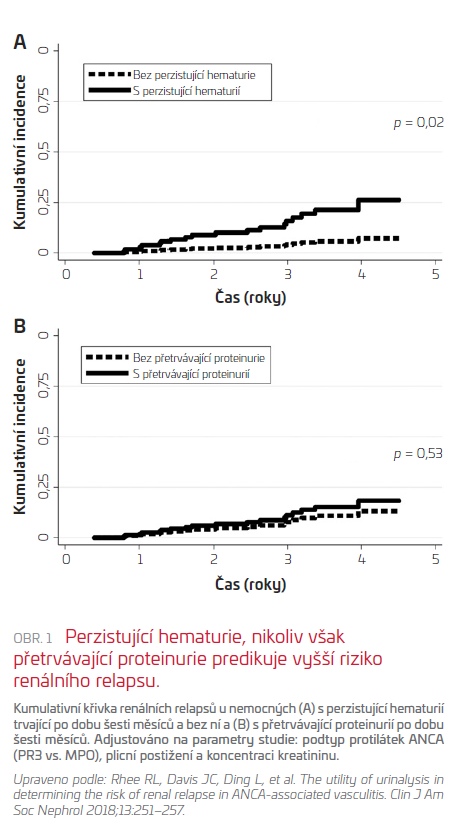
Ve skupině zahrnující 149 pacientů se následně rozvinul relaps u 57 (38 %) z nich (18 pacientů s renálním relapsem, 39 pacientů s relapsem extrarenálním), u 8 nemocných došlo k rozvoji terminálního selhání ledvin před rozvojem relapsu. U pacientů s přetrvávající hematurií déle než šest měsíců bylo zjištěno signifikantně více renálních relapsů ve srovnání s nemocnými bez hematurie (22 % vs. 5 %, p < 0,01). Průměrná doba k rozvoji renálního relapsu činila 22 měsíců.
Přetrvávající proteinurie byla přítomna u 63 (43 %) pacientů, nebyla však spojena s výskytem renálních relapsů.
Ve studii RAVE byla zvětšující se hematurie spojena se signifikantně vyšším výskytem renálních relapsů během následujících 6–12 měsíců, zatímco stoupající proteinurie neměla vliv na rozvoj relapsu v ledvinách (viz obr. 1).
Komentář
- MUDr. Karolína Krátká, Ph.D., I. interní klinika 3. LF UK a FNKV, Praha
- prof. MUDr. Ivan Rychlík, CSc., FASN, FERA, I. interní klinika 3. LF UK a FNKV, Praha
Literatura
- Flossmann O, Berden A, de Groot K, et al. Long‑term patients survival in ANCA‑associated vasculitis. Ann Rheum Dis 2011;70:488–494.
- Geetha D, Seo P, Ellis C, et al. Persistent or new onset microscopic hematuria in patients with small vessel vasculitis in remission: Findings on renal biopsy. J Rheumatol 2012;39:1413–1417.
- Chen TK, Murakami C, Manno RL, et al. Hematuria duration does not predict kidney function at 1 year in ANCA‑associated glomerulonephritis. Semin Arthritis Rheum 2014;44:198–201.
- Stone JH, Merkel PA, Spiera R, et al. RAVE‑ITN Research Group: Rituximab versus cyclophosphamide for ANCA‑associated vasculitis. N Engl J Med 2010;363:221–232.
- Wegener’s Granulomatosis Etanercept Trial (WGET) Research Group: Etancercept plus standard therapy for Wegener’s Granulomatosis. N Engl J Med 2005;352:351–361.
- Fussner LA, Hummel AM, Schroeder DR, et al. Rituximab in ANCA‑Associated Vasculitis‑Immune Tolerance Network Research Group: Factors determining in clinical utility of serial measurements of antineutrophil cytoplasmic antibodies targeting proteinase 3. Arthritis Rheumatol 2016;68:1700–1710.
- Stone JH, Hoffamm GS, Merkel PA, et al. International Network for the Study of the Systemic Vasculitides (INSSYS): A disease‑specific activity index for Wegener’s granulomatosis: Modification of the Birmingham Vasculitis Activity Score. Arthritis Rheum 2001;44:912–920.
- Jennette JC, Falk RJ, Andrassy K, et al. Nomenclature of systematic vasculitides. Proposal of an international consensus conference. Arthritis Rheum 1994;37:187–192.
- Leavitt RY, Fauci AS, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener’s granulomatosis. Arthritis Rheum 1990;33:1101–1107.
- Jayne D, Rasmussen N, Andrassy K, et al. European Vasculitis Study Group: A randomized trial of maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies. N Engl J Med 2003;349:36–44.
- De Groot K, Harper L, Jayne DR, et al. EUVAS: Pulse versus daily oral cyclophosphamide for induction of remission in antineutrophil cytoplasmic antibody‑associated vasculitis. Ann Intern Med 2009;150:670–680.
- Kemna MJ, Damoiseaux J, Austen J, et al. ANCA as a predictor of relapse: Useful in patients with renal involvement but not in patients with nonrenal disease. J Am Soc Nephrol 2015;26:537–542.
- Mahoney SL, Nachman PH. Persistent hematuria in ANCA vasculitis. Ominous or Innocuous? Clin J Am Soc Nephrol 2018;13:201–202.
- Magrey MN, Villa‑Forte A, Koening CL, et al. Persistent hematuria after induction of remission in Wegener granulomatosis: A therapeutic dilemma. Medicine (Baltimore) 2009;88:315–321.
- Kategorie: Komentované články
- Klíčová slova: ANCA asociovaná vaskulitida
Správné vedení léčby ANCA‑asociovaných vaskulitid (AAV) patří stále mezi úskalí klinické praxe. Moderní a účinnou imunosupresivní terapií může být sice dosaženo až v 70–90 % případů remise onemocnění,4,10,11 ale stále se přibližně u 40–50 % pacientů vyvine relaps onemocnění. Dosud nemáme k dispozici specifický marker, který by předpovídal relaps onemocnění a tak optimalizoval délku imunosupresivní léčby. Kontinuální imunosupresivní léčba je pak spojena s krátkodobými i dlouhodobými nežádoucími účinky a s vysokými náklady za léčbu.
Tato studie ukázala, že mezi pacienty s AAV s postižením ledvin, kteří dosáhli remise během šesti měsíců, přetrvávající hematurie, nikoliv však proteinurie, byla asociována se signifikantně vyšším rizikem následného renálního relapsu. Tato studie také poprvé poukázala na skutečnost, že perzistující hematurie je rizikovým faktorem pro renální relaps nezávislý na předchozích prediktorech relapsu, zahrnujících především zvýšení titru protilátek ANCA. Ačkoliv jsou relapsy onemocnění většinou doprovázeny vzestupem titru protilátek ANCA, interval mezi vzestupem protilátek a rozvojem relapsu je variabilní a trvá velmi často několik měsíců. V nedávné analýze12 se pouze u 50 % pacientů rozvinul relaps během 18 měsíců od vzestupu titru protilátek.
Komentovaná práce si klade důležitou otázku, která se netýká jen ANCA‑asociované glomerulonefritidy, ale také dalších glomerulonefritid. Přetrvávající hematurie po ukončení indukční terapie může představovat známku pokračujícího glomerulárního zánětu, a tedy aktivity onemocnění, nebo se může jednat o následek glomerulárního poškození, který není spojen s aktivním zánětem. Přitom rozlišení těchto dvou stavů je velmi důležité, neboť nemocní s pokračující aktivitou onemocnění by vyžadovali prodloužení nebo intenzivnější průběh indukční terapie a zároveň by delší aktivní perioda onemocnění měla vliv na trvání následné udržovací terapie. Většina odborníků však přisuzuje přetrvávající hematurii aktivitě glomerulonefritidy. To dokládá také skutečnost, že pouze jedna třetina pacientů ve studii RAVE podstoupila rebiopsii ledviny, u ostatních nemocných histologická verifikace aktivity choroby nebyla provedena.
Zlatým standardem k potvrzení diagnózy a ke stanovení aktivity onemocnění nadále zůstává renální biopsie. Známou limitací této invazivní metody je závislost na velikosti a kvalitě odebraných vzorků, ovlivněná navíc průkazem asynchronních fokálních lézí. Nicméně histopatologické vyšetření poskytuje cenné informace, které nemohou být shromážděny z jiných klinických a laboratorních vyšetření. V malém souboru devíti pacientů s ANCA vaskulitidou v klinické remisi a s přetrvávající nebo novou hematurií odhalilo opakování renální biopsie celou šíři histopatologických nálezů zahrnujících jiné typy glomerulonefritid (např. IgA nefropatii), fokálně segmentální glomerulosklerózu (FSGS) nebo více globální glomerulosklerózy.2 Rebiopsie ledvin je v klinické praxi zřídka prováděna a referovaná studie poukazuje na potřebu systematického provádění rebiopsií po ukončení indukční imunosupresivní léčby. Jen tak lze posoudit senzitivitu a specificitu analýzy moči v detekci aktivně probíhajícího glomerulárního postižení.13
V předchozích studiích s relativně malým počtem pacientů nebyla shledána klinická významnost perzistující hematurie, nebyla totiž asociována s aktivitou onemocnění.2,14 Podobně jako v práci Magreye a spol.14 měli pacienti v této studii prodloužený čas k renálnímu relapsu (průměr 22 měsíců). Prodloužený čas relapsu je však v rozporu s myšlenkou, že perzistující hematurie identifikuje aktivní onemocnění, pokud doutnající onemocnění nepřetrvává po dobu téměř dvou let, v nepřítomnosti poklesu renální funkce či výskytu jiné manifestace onemocnění. Přetrvávající hematurie nebyla spojena s poklesem renální funkce nebo s rizikem rozvoje ESRD, což dokumentuje, že hematurie není markerem většího renálního poškození.
Ve studii byla také řešena otázka, zda zvětšující se intenzita hematurie je asociována s renálním relapsem. Studie ukázala, že vzestup hematurie signifikantně předpověděl riziko renálního relapsu v následujících 6–12 měsících, nárůst hematurie přitom předcházel vývoji manifestace relapsu v řádu několika měsíců. Tyto nálezy podporují rutinní využití analýzy moči v klinické praxi a zdůrazňují důležitost častější klinické monitorace pacientů se zvyšující se hematurií jako časného ukazatele rozvíjejícího se relapsu.
Souhrnem lze konstatovat, že tato studie poukázala na korelaci přetrvávající hematurie s vyšší pravděpodobností relapsu ANCA‑asociované vaskulitidy, ale neodpověděla na otázku, jestli a kdy představuje známku pokračující aktivity glomerulonefritidy. V klinické praxi stále postrádáme adekvátní marker remise v imunologické a tkáňové odpovědi. U onemocnění charakterizovaných relapsy, jako např. u ANCA vaskulitidy či systémového lupus erythematodes (SLE), zůstává nezodpovězenou otázkou, zda relapsy představují opravdové rekurence onemocnění po období jednoznačné remise, nebo pouze zvýšení zánětlivé reakce v relativně klidovém stadiu, ale přitom s pokračující autoimunitní aktivitou.
Tato práce by měla podpořit hledání více senzitivního a specifického markeru hodnocení léčebné odpovědi a navozené remise, který by dobře koreloval s histologickým nálezem v ledvinách. Do objevení takových lepších markerů z dalších klinických a intervenčních studií by ošetřující nefrologové měli v případě pochybností o dosažení remise na konci indukční léčby stále uvažovat o provedení rebiopsie ledvin.