Jak se daří srdci, tak se daří ledvinám, a naopak: co nového u akutního kardiorenálního syndromu?
Souhrn
Akutní kardiorenální syndrom (aCRS) představuje akutní exacerbaci srdečního selhání vedoucí k akutnímu poškození ledvin (AKI). Renální žilní kongesce společně s akcelerovanou neurohormonální odpovědí (zvýšená aktivace sympatického nervového systému a osy renin–angiotenzin–aldosteron) jsou považovány za klíčový patofyziologický mechanismus akutního zhoršení funkce ledvin u aCRS. Léčba aCRS není vůbec jednoduchá. Důvodů je několik. Neexistují žádné pevně stanovené léčebné postupy, navíc je léčba často provázena řadou problémů. Mezi nejčastější patří další zhoršení funkce ledvin, poruchy elektrolytů, rozvoj rezistence k diuretikům či široké spektrum hemodynamických komplikací. Řada nedávno testovaných nových léčebných strategií přinesla zklamání. Příkladem jsou negativní studie s nesiritidem, tolvaptanem (antagonista receptorů V2 pro vazopresin), rolofyllinem (selektivní antagonista receptoru A1 pro adenosin) nebo mechanická ultrafiltrace izotonické tekutiny (studie CARRESS‑HF). Snaha o snížení centrálního žilního tlaku tak stále zůstává základním stavebním kamenem současné léčby aCRS.1 Článek je stručným shrnutím posledních poznatků zaměřených především na problémy, které souvisejí se správným používáním diuretik.
Diagnóza a klinické vyhodnocení
Přestože přítomnost periferních otoků je významným nezávislým faktorem rozvoje AKI,2,3 může být správné rozpoznání hlavních patofyziologických mechanismů vzniku aCRS oříškem. Klinické projevy kongesce totiž mohou být značně variabilní v závislosti na její lokalizaci (plicní, systémová nebo obojí) a míře. Absence některých typických známek srdečního selhání (námahová dušnost, paroxysmální noční dušnost, přítomnost plicních chrůpků, nález plicní žilní kongesce a kardiomegalie na RTG srdce a plic) nevylučuje spolehlivě přítomnost významné kongestivní komponenty. Jsou například pacienti s vysokými levostrannými tlaky bez jasných fyzikálních či RTG známek plicní kongesce. Vysvětlením je plicní vaskulární remodelace u chronického srdečního selhání. Nutné je rovněž vyloučit akutní kardiorenální syndrom navozený subklinickou hypovolemií, například při nadměrné diuretické léčbě. Pečlivé klinické vyšetření, analýza nedávných zásahů do léčby, vyhodnocení trendu hmotnosti a ideálně použití bedside ultrazvukového vyšetření jsou nástroji ke správnému vyhodnocení stavu volemie a pravděpodobné etiologie aCRS u hospitalizovaných pacientů.
Zhoršení funkce ledvin v průběhu dekongesční léčby
Léčba aCRS se opírá o komplexní léčbu dekompenzovaného srdečního selhání a o eliminaci faktorů, které k dekompenzaci vedou (např. infekce, ischemie, arytmie, hypertenze, nedodržování léčby, plicní embolie, medikace – nesteroidní antiflogistika, tyreopatie apod.). Redukce preloadu (dekongesce) zlepšuje geometrii srdečních komor, snižuje frakci funkční mitrální regurgitace, příznivě ovlivňuje renální žilní hypertenzi a tím renální kongesci. V klinické praxi však není neobvyklé, že je zhoršení renálních funkcí často připisováno příliš agresivní diuretické léčbě s její následnou redukcí. Důsledkem této defenzivní strategie je potom nedostatečná kontrola kongesce. Ta se ovšem ukazuje jako prioritní cíl v léčbě aCRS a její špatná kontrola je spojena s horší postnemocniční mortalitou této populace nemocných.4 Za přítomnosti jasné hypervolemie by tudíž zvýšení sérové koncentrace kreatininu (často přechodné) nemělo být důvodem k omezení snah o dosažení dekongesce.
Jak zacházet s diuretiky?
Kličková diuretika jsou první volbou v léčbě kongesce. Mají ovšem poměrně strmou křivku dávka–účinek (dose‑response curve) a plató, kterého diuretika často dosahují již v běžných dávkách. Navyšování dávky nad určitý strop tak nemusí vždy zvyšovat jejich účinnost. Perorální podávání furosemidu má omezenou a vysoce variabilní biologickou dostupnost. Příjem potravy zpomaluje významně vstřebávání furosemidu, což vede ke snížení vrcholových koncentrací. Vztaženo na miligram dávky je u pacientů s normální funkcí ledvin intravenózní podávání furosemidu přibližně dvojnásobně účinnější než perorální podávání. Za stavů se zvýšenou retencí sodíku (případ CRS) je intravenózní podání ještě účinnější než perorální, protože pro maximální účinek furosemidu je nutné dosáhnout vyšších vrcholových koncentrací.5 Zpomalené vstřebávání furosemidu způsobené kongescí střevní sliznice a snížením mezenterické perfuze brání dosažení dostatečných vrcholových koncentrací i navzdory navyšování perorální dávky furosemidu u pacientů hospitalizovaných pro aCRS. Jednotlivá dávka furosemidu zvyšuje sekreci chloridu sodného a vody po dobu pouze několika hodin (poločas kličkových diuretik je kratší než obvyklý dávkovací interval dvakrát denně). Následuje fáze velmi nízké exkrece sodíku, tzv. postdiuretická sodíková retence, která společně s aktivací sympatického systému a osy RAA může přispívat k fenoménu diuretické rezistence. Nicméně stále chybějí přesvědčivá data pro jednoznačně prospěšnější kontinuální podávání furosemidu. Vždy je však nutné individuální vyhodnocení. Pokud klinická odpověď na bolusové podávání není odpovídající, pacient jeví známky diuretické rezistence či je přítomna těžká dysfunkce pravé komory srdeční, je vhodné kontinuální podání upřednostnit.
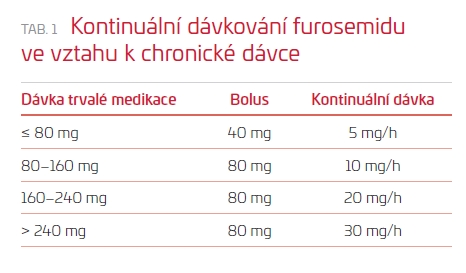
Cílem léčby je dosažení denní diurézy 3–5 l do doby dosažení euvolemie. V případě bolusového podávání by dávka furosemidu měla být přibližně 2,5násobně vyšší, než je denní dávka chronická. V případě kontinuálního podávání lze použít jako návod dávkování schéma v tab. 1.5
Pacient s rezistencí k diuretikům
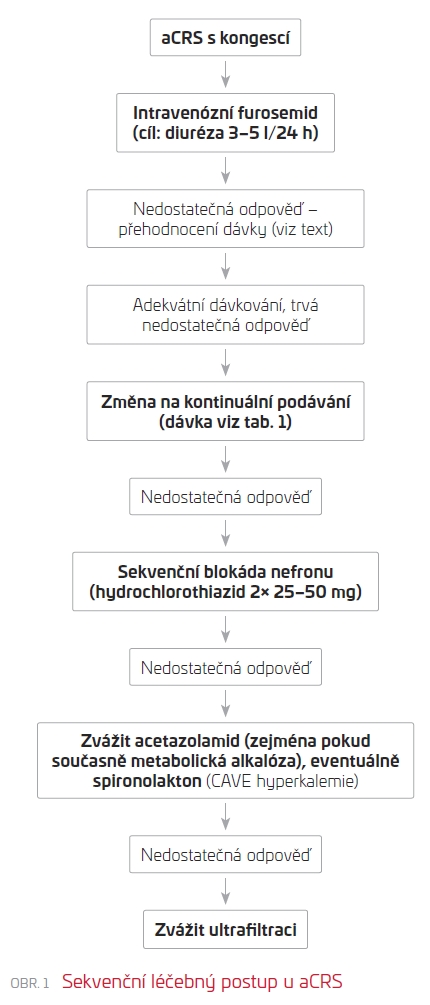
Rezistence k diuretikům je definována jako selhání dosažení dekongesce při maximálních doporučených dávkách furosemidu. Nedávno byla shledána silná asociace mezi hypochloremií a diuretickou rezistencí.6 Přesto, že kauzální souvislosti zatím nebyly doloženy, je důležité připomenout, že chloridy jsou klíčovým faktorem, který určuje aktivitu tubuloglomerulární zpětné vazby. Diuretika, která působí v proximálních tubulech, mohou bránit akumulaci bikarbonátu a rozvoji hypochloremie a tím zvýšit diuretickou účinnost zvýšením dodávky chloridů do macula densa.7 Tento princip dává fyziologický podklad k tzv. sekvenční blokádě nefronu, ačkoliv tato strategie byla testována jen v malých klinických studiích. Klinický význam pro pacienty tak nebyl zatím řádně doložen. Přesto existují dobré klinické zkušenosti s účinnou odpovědí na kombinaci kličkového a thiazidového diuretika (případně inhibitoru karboanhydrázy acetazolamidu, zejména tam, kde je současná metabolická alkalóza) u řady pacientů s rezistencí na kličková diuretika. Sekvenční léčebný postup u aCRS shrnuje obr. 1. Na jeho konci stojí ultrafiltrace. I když studie CARRESS‑HF neprokázala superioritu kontinuální ultrafiltrace (200 ml/h) a metoda nemůže být považována za iniciální postup volby v dekongesční léčbě, je mechanický způsob dekongesce v individualizovaných případech jediným účinným nástrojem ke zvládnutí farmakorefrakterních aCRS. Kandidáty jsou obvykle pacienti, kteří současně vyžadují i dialyzační léčbu.
Perspektivy
V současnosti je testována subkutánní aplikační forma furosemidu pro ambulantní pacienty. Očekávány jsou farmakokinetické výhody podobné intravenóznímu podání ve srovnání s perorální aplikací (viz výše). Z nově testovaných farmakologických přístupů je nejblíže výsledkům serelaxin, který zvyšuje renální krevní průtok. Očekává se také vyhodnocení přínosu sacubitril/valsartanu a inhibitorů společného transportéru pro sodík a glukózu (SGLT‑2) u pacientů s kardiorenální problematikou.
Literatura
- Di Nicolò P. The dark side of the kidney in cardio‑renal syndrome: renal venous hypertension and congestive kidney failure. Heart Fail Rev 2018 Jan 31. doi: 10.1007/s10741‑018‑9673‑4. [Epub ahead of print]
- Chen KP, Cavender S, Lee J, et al. Peripheral Edema, Central Venous Pressure, and Risk of AKI in Critical Illness. Clin J Am Soc Nephrol 2016;11:602–608.
- Chen C, Lee J, Johnson AE, et al. Right Ventricular Function, Peripheral Edema, and Acute Kidney Injury in Critical Illness. Kidney Int Rep 2017;2:1059–1065.
- Brisco MA, Zile MR, Hanberg JS, et al. Relevance of Changes in Serum Creatinine During a Heart Failure Trial of Decongestive Strategies: Insights From the DOSE Trial. J Card Fail 2016;22:753–760.
- Ellison DH, Felker GM. Diuretic Treatment in Heart Failure. N Engl J Med 2018;378:684–685.
- Ter Maaten JM, Damman K, Hanberg JS, et al. Hypochloremia, Diuretic Resistance, and Outcome in Patients With Acute Heart Failure. Circ Heart Fail 2016 Aug;9(8). pii: e003109. doi: 10.1161/CIRCHEARTFAILURE.116.003109.
- Verbrugge FH, Dupont M, Bertrand PB, et al. Determinants and impact of the natriuretic response to diuretic therapy in heart failure with reduced ejection fraction and volume overload. Acta Cardiol 2015;70:265–273.
- Kategorie: Přehledové články
- Klíčová slova: akutní poškození ledvin; diuretika; kardiorenální syndrom; kongesce