Nízká porodní hmotnost, prematurita a chronické onemocnění ledvin
Souhrn
Pokroky v péči o novorozence v posledních desetiletích vedly k významnému poklesu novorozenecké mortality. Zároveň se však rodí více dětí se zkrácenou dobou gestace a nízkou porodní hmotností. Prematurita je ale spojena s časnými komplikacemi po porodu (nekrotizující enterokolitida, retinopatie nedonošených a další). Již před několika desítkami let byla popsána asociace mezi nízkou porodní hmotností a vznikem metabolického syndromu, hypertenze, chronického onemocnění ledvin, osteoporózou a kardiovaskulárními komplikacemi v pozdějším věku. Tato onemocnění se objevují u dospělých s nízkou porodní hmotností významně častěji než u jedinců s normální porodní hmotností. Některé práce se věnují studiu toho, jaký vliv má prematurita na kardiovaskulární systém již v dětském věku. Cílem tohoto sdělení je seznámit čtenáře s pozdními riziky nízké porodní hmotnosti, a především upozornit na nutnost časného sledování pacientů s rizikovou perinatální anamnézou.
Klíčová slova: hypertenze – chronické onemocnění ledvin – nízká porodní hmotnost
Úvod
Na konci minulého století Barker a spol. upozornili na možnou souvislost mezi nízkou porodní hmotností (low birth weight, LBW) vzniklou v důsledku působení vnějších vlivů a zvýšeným rizikem vzniku ischemické choroby srdeční v dospělosti (obr. 1).
OBR. 1 Teorie Barkera a spol
ICHS – ischemická choroba srdeční; LBW (low birth weight) – nízká porodní hmotnost.
Tímto dali základ teorii časného původu zdraví a nemocí, dle které mohou mít četná onemocnění v dospělosti původ v období časného dětství a intrauterinního vývoje (Developmental Origins of Health and Disease, DOHaD).1,2 Ve stejné době Brenner a spol. vyslovili hypotézu, podle níž je snížené množství nefronů u novorozenců rizikovým faktorem pro pozdější manifestaci hypertenze (HT) (pro nedostatečnou exkreci sodíku při snížené filtrační ploše) a rozvoj chronického onemocnění ledvin (CKD), jehož etiologii vysvětlili kompenzatorní hyperfiltrací nižšího počtu nefronů s jejich postupným poškozením a následným poklesem funkce ledvin (obr. 2 a 3).3,4
OBR. 2 Teorie Brennera a spol.
CKD – chronické onemocnění ledvin.
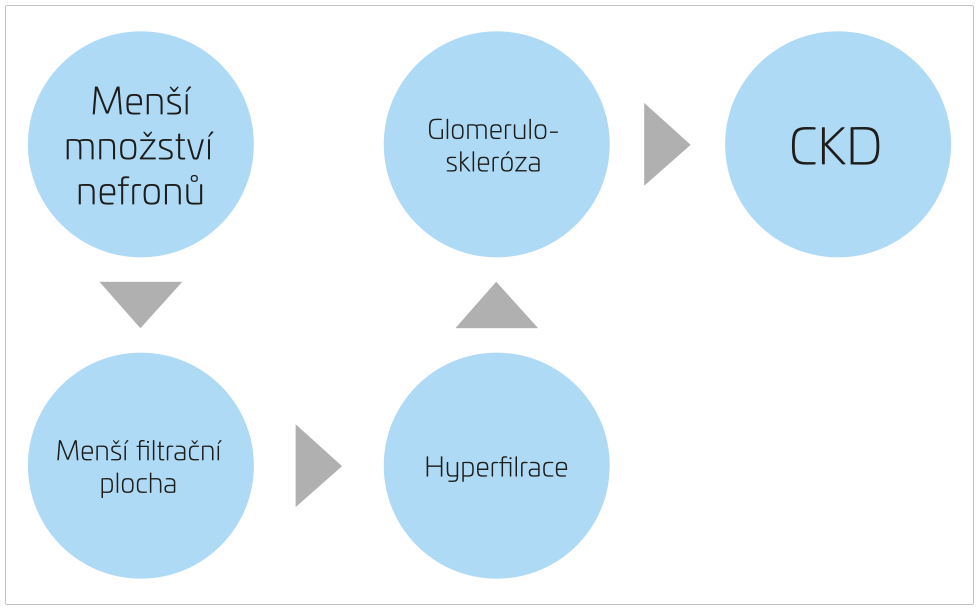
OBR. 3 Mechanismus rozvoje CKD v důsledku nízkého počtu nefronů.
CKD – chronické onemocnění ledvin.
Právě u pacientů s LBW se později prokázala nepřímá úměra mezi porodní hmotností a celkovým množstvím nefronů (obr. 4).5,6
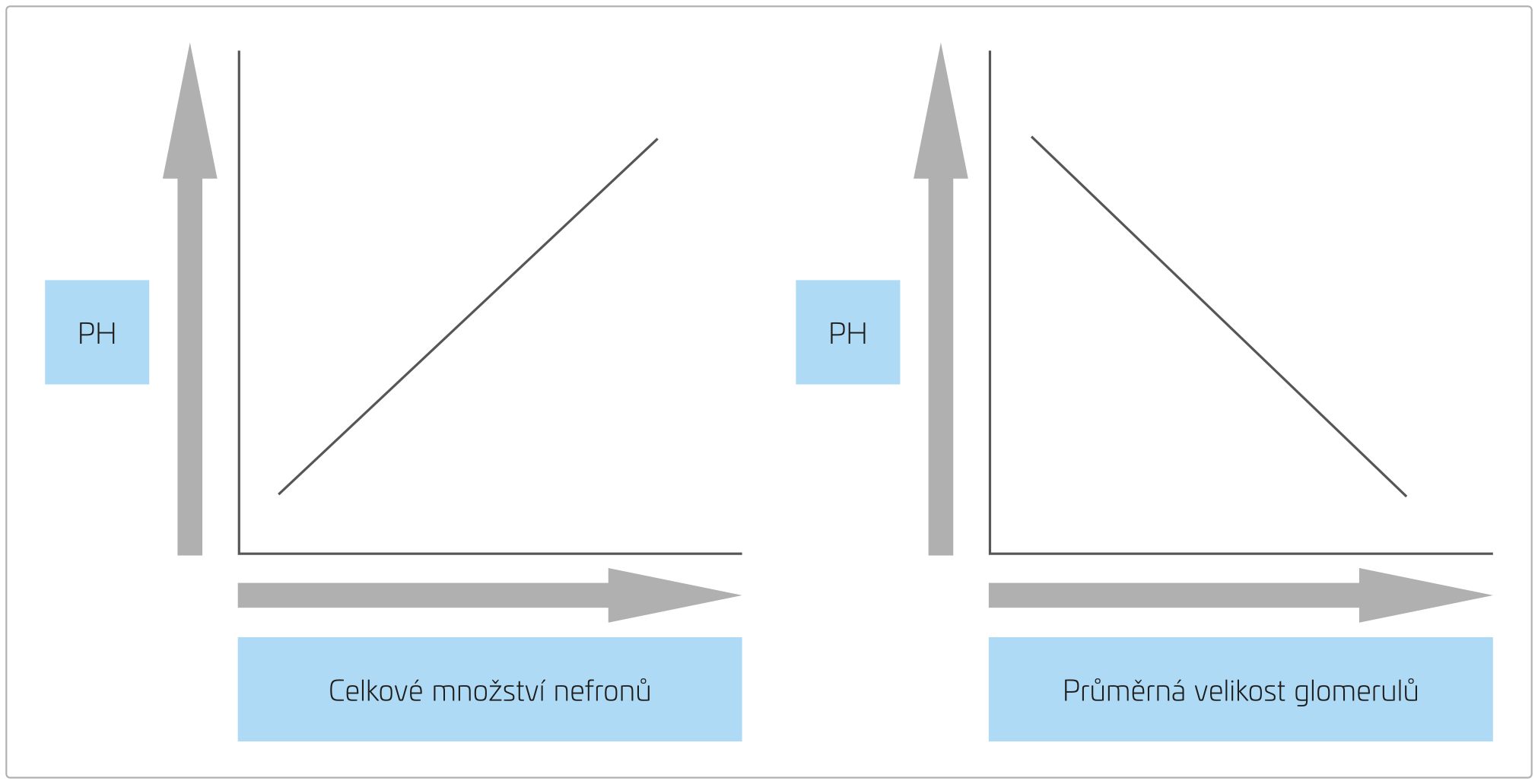
OBR. 4 Vztah mezi PH a množstvím nefronů a velikostí glomerulů.
PH – porodní hmotnost
Následovala celá řada studií zabývajících se touto problematikou a dnes již lze považovat LBW a prematuritu za významné rizikové faktory rozvoje HT, CKD, diabetu 2. typu a kardiovaskulárních onemocnění.7–10 Tento přehledový článek přináší shrnutí současného poznání o dlouhodobých komplikacích prematurity se zaměřením na onemocnění ledvin. Cílem našeho sdělení je také vysvětlení patofyziologie rozvoje CKD a hypertenze na základě současných vědeckých poznatků.
Nízká porodní hmotnost, prematurita a celkový počet nefronů
Celkový počet nefronů každého jedince je značně variabilní a pohybuje se od 210 000 do 2 700 000.9,11,12 To je nejspíše dáno kombinací vrozeného množství nefronů a následnou postnatální ztrátou v průběhu života.7,11 Až 60 % nefronů vzniká intrauterinně ve třetím trimestru, přičemž vývoj ledvin je ukončen ve 36. týdnu těhotenství. Nefrogeneze je tedy ukončena již prenatálně,9,13,14 u předčasně narozených dětí může pokračovat až 40 dní po porodu.15 Postnatální tvorba nefronů je ale u těchto dětí nedokonalá se vznikem abnormálních glomerulů a může být dále alterována akutním poškození ledvin (acute kidney injury, AKI) v novorozeneckém věku.15,16 Několik studií pak prokázalo u dětí s LBW přímou úměru mezi celkovým počtem nefronů a porodní hmotností a nepřímou úměru mezi porodní hmotností a průměrnou velikostí glomerulů (obr. 4).5,6
Nyní tedy víme, že u novorozenců předčasně narozených, s LBW i hypotrofií (small for gestational age, SGA) je množství nefronů nižší ve srovnání s normotrofickými novorozenci narozenými v termínu.7 Je však třeba zdůraznit, že existují i další faktory, které mohou vést k redukci počtu nefronů (např. genetické faktory, zdraví matky a nutrice).17
Nízká porodní hmotnost, prematurita a perinatální vlivy
Děti narozené s LBW jsou častěji vystaveny po porodu hypoxii, hyperoxii, AKI, nedostatečné intrauterinní/extrauterinní výživě, případně účinkům nefrotoxických léků či medikaci asociované se vznikem nefrokalcinózy.18,19 Nízká porodní hmotnost, prematurita, nízký počet nefronů, závažný klinický stav a nefrotoxická léčba (např. aminoglykosidy, nesteroidní antiflogistika) jsou důležitými rizikovými faktory pro rozvoj AKI.8,9,20–23 U 12–40 % dětí předčasně narozených se manifestuje AKI a riziko stoupá s mírou prematurity.24,25 Tito pacienti mají vysokou mortalitu a zvýšené riziko pozdního rozvoje CKD.26–29 Přesný mechanismus rozvoje CKD u pacientů po prodělaném AKI není zcela jasný. Nejspíše vzniká trvalé poškození části nefronů s následnou redukcí funkční renální masy. Další diskutovanou variantou je rozvoj AKI u již rizikových pacientů s nízkým počtem nefronů, kteří byli predisponováni k rozvoji CKD.9 Velká část pacientů, kteří prodělali AKI v novorozeneckém věku, nemá detailní informace o prenatální a perinatální anamnéze ve své lékařské dokumentaci, a nejsou proto dále sledováni stran možného rozvoje CKD.25
Vliv nutrice a zdraví matky na fetální programování
Adekvátní výživa v graviditě je důležitá pro nekomplikovaný průběh těhotenství a normální vývoj ledvin plodu.30 Podváha těhotné ženy, malnutrice, deficit železa a anémie během gravidity představují rizikové faktory pro LBW.31,32 Dostatečný energetický příjem, suplementace železa, vápníku, jodu, zinku a mikronutrientů u těhotných žen redukuje riziko prematurity a LBW, má tedy i významný vliv na prevenci rozvoje CKD.31,33 Ve studiích se zvířecími modely vedl deficit vitaminu A u matek k redukci množství nefronů jejich dětí, naopak jeho suplementace byla spojena se zvýšením množství nefronů.34
Ženy, kterým se narodilo dítě předčasně, mají vyšší pravděpodobnost dalšího porodu před termínem i přes snížení identifikovatelných rizik.8 Zajímavé také je, že osobní anamnéza prematurity či LBW u matek je rizikovým faktorem pro LBW a prematuritu jejich dětí, míra rizika je nepřímo úměrná matčině gestačnímu věku a jedná se o faktor nezávislý na socioekonomické situaci.35–38 Přesná příčina tohoto jevu není jasná, pravděpodobně se nebude jednat primárně o vliv genetický, protože podobná spojitost nebyla zjištěna mezi otci narozenými s LBW a jejich dětmi.35 Prematurita matek predisponuje také k rozvoji gestačního diabetu a hypertenzní nemoci v těhotenství (včetně preeklampsie a eklampsie), které jsou dále spojeny s LBW a prematuritou.37–39
Dalším rizikovým faktorem LBW je nadměrný příjem kofeinu v průběhu těhotenství, přičemž riziko je přímo úměrné dávce.40,41 Obdobně i užívání alkoholu a tabáku vede k dřívějšímu porodu a LBW i k abnormálnímu vývoji ledvin. U alkoholu byl tento efekt nejvýznamnější při jeho konzumaci v prvním trimestru těhotenství. U dětí, jejichž matky kouřily v době těhotenství, bylo zjištěno zvýšené riziko rozvoje CKD a HT (obr. 5).42–47
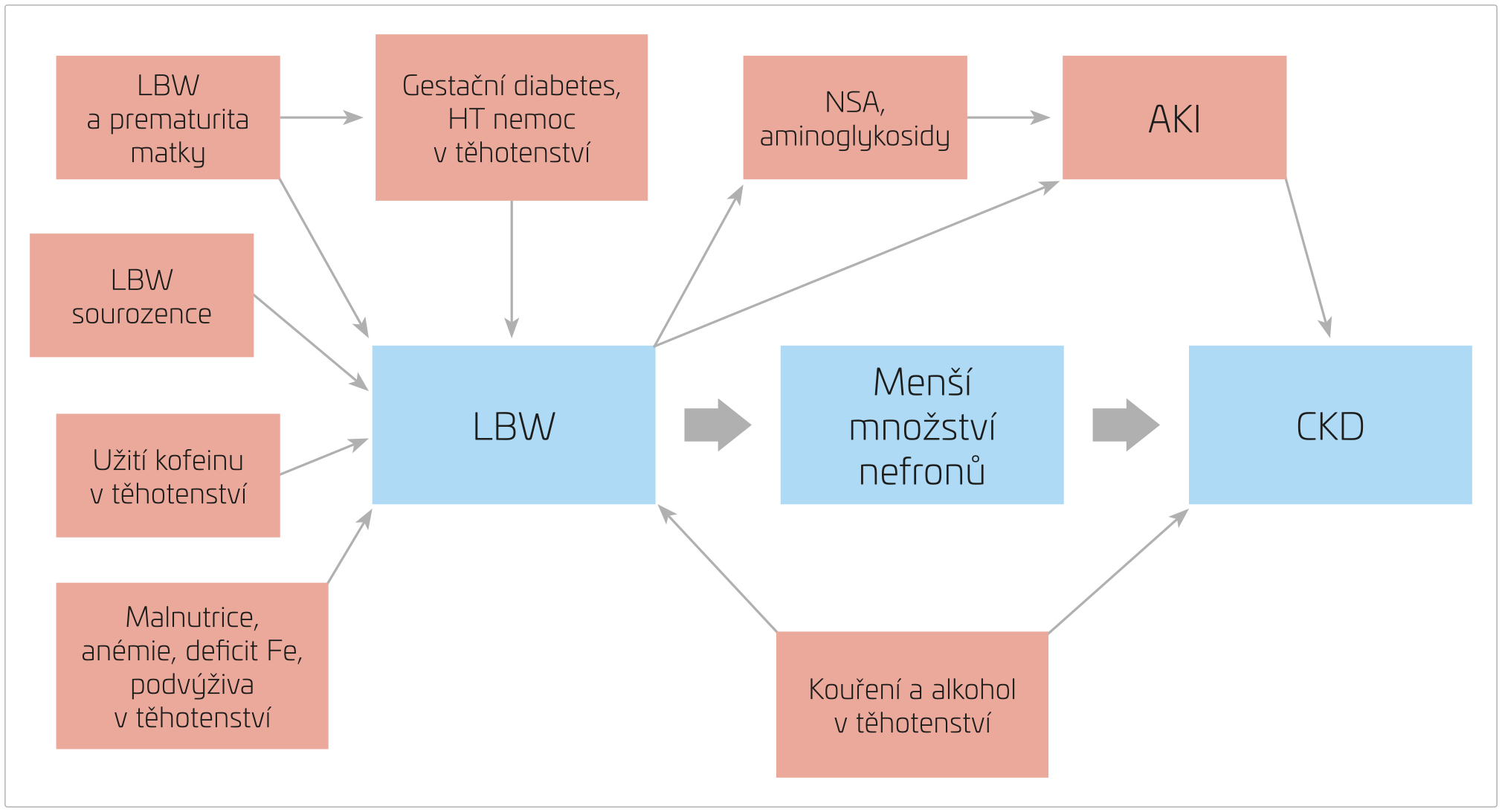
OBR. 5 LBW, perinatální vlivy a zdraví matky.
AKI – akutní poškození ledvin; CKD – chronické onemocnění ledvin; Fe – železo; HT – hypertenzní; LBW (low birth weight) – nízká porodní hmotnost; NSA –
nesteroidní antiflogistika.
Celkový počet nefronů a riziko rozvoje chronického onemocnění ledvin a hypertenze
Brennerova hypotéza vysvětluje vyšší výskyt CKD a HT u pacientů s vrozeným sníženým počtem nefronů, např. solitární, hypo‑/dysplastická ledvina, oligomeganefronie.7,48–51 Obdobně je i zvýšené riziko CKD a HT popsáno u dětí se získanou solitární ledvinou po ztrátě kontralaterární ledviny.52 V rozporu s touto teorií je však situace dárců ledvin, kteří tvoří velmi specifickou skupinu populace se získanou 50% redukcí nefronů. U těchto pacientů bylo prokázáno pouze minimálně zvýšené riziko rozvoje CKD v souvislosti s dárcovstvím. Dle současných poznatků není dárcovství ledviny považováno za rizikový faktor rozvoje hypertenze, nicméně některé studie poukazují na možné riziko u vybraných skupin dárců (hispánský a afroamerický původ, obezita, vyšší věk).53,54 U zvířecích modelů byla ztráta jedné ledviny v průběhu intrauterinního vývoje nebo časně po porodu spojena s pozdějším výskytem HT a postižením ledvin, které se ale neprokázalo u zvířat nefrektomovaných v dospělosti.55–57 Myši s redukovaným množstvím nefronů jsou navíc méně odolné vůči postnatálním inzultům, jako je unilaterální obstrukce.58 Zdá se tedy, že pro rozvoj HT a CKD u pacientů s nižším množstvím nefronů je důležitý moment v průběhu jejich života, kdy k této redukci dojde, a její příčina.
Nízká porodní hmotnost, prematurita a chronické onemocnění ledvin
Od konce devadesátých let proběhlo velké množství studií zabývajících se vlivem prematurity, LBW a SGA na vznik CKD. Většina těchto studií byla zaměřena především na LBW.7–10,17,58,59
Dle metaanalýzy 31 studií z roku 2009 mají jedinci s LBW o 70 % vyšší riziko rozvoje CKD.10 Rozsáhlá norská studie z roku 2008 zahrnující více než dva miliony účastníků prokázala o 70 % vyšší riziko rozvoje terminálního selhání ledvin (end stage renal disease, ESRD) u jedinců narozených s LBW, přitom SGA představuje dle této studie další a méně významný rizikový faktor.60 Další studie norských vědců z roku 2016 taktéž popsala LBW i SGA jako rizikové faktory rozvoje ESRD. Ty jsou nezávislé na familiárních, genetických faktorech či na vlivech vnějšího prostředí, a navíc anamnéza SGA byla identifikována jako více riziková než LBW u jedinců ve věku 18–42 let.61 Výraznou spojitost mezi gestačním věkem a rozvojem CKD prokázala studie provedená ve Švédsku v roce 2019 u dětí a dospělých ve věku do 43 let. Dle závěrů této studie byla prematurita spojena s dvojnásobným rizikem rozvoje CKD, v případě extrémní prematurity bylo toto riziko dokonce trojnásobné. Závislost na genetických faktorech a působení vnějšího prostředí se zdály být minimální.62 K obdobným závěrům dospěli i finští výzkumníci v rámci studie provedené v roce 2017.63
Důležitou otázkou zůstává, zdali se může LBW projevit na funkci ledvin již v dětském věku. Vyšší výskyt CKD a HT v souvislosti s LBW byl popsán v adolescentním věku a u mladých dospělých.64–67 Dle studie na dvojčatech je LBW spojena s poklesem glomerulární filtrace u mladých dospělých, přičemž mateřské a genetické faktory se jeví jako málo významné.68 Další práce prokázaly silnou asociaci mezi LBW, prematuritou a CKD v pediatrické populaci.69,70 U dětí narozených s extrémně nízkou porodní hmotností (extremely low birth weight, ELBW) byla zjištěna nižší glomerulární filtrace a vyšší riziko rozvoje HT již ve věku 11 let.18,71–73 Nižší glomerulární filtrace byla popsána i u devítiletých dětí narozených s LBW a u sedmiletých dětí narozených s ELBW.74,75 Pozoruhodné je, že dle provedených studií lze již ve třech letech života potvrdit nižší glomerulární filtraci a četnější výskyt proteinurie u dětí s LBW.76,77 V jedné studii byla prokázána hyperfiltrace již v prvním roce života u dětí narozených s velmi nízkou porodní hmotností (very low birth weight, VLBW), stejná kohorta pak měla ve třech letech nižší glomerulární filtraci ve srovnání s kontrolní skupinou.77
Několik studií nepotvrdilo spojitost mezi LBW a možným rozvojem CKD, byly však limitovány nízkým počtem pacientů.78–80
Nízká porodní hmotnost a velikost ledvin
Počet nefronů zřejmě koreluje s celkovým objemem ledvin v raném dětství.7 Dle metaanalýzy šesti studií toto však neplatí v dospělé populaci.81 Vysvětlením může být větší množství vlivů podílejících se na velikosti ledvin, jako jsou hypertrofie a ztráta nefronů s rostoucím věkem a index tělesné hmotnosti (BMI).7
Předčasně narozené děti mají postnatálně v 38. gestačním týdnu (tzn. 0. den života korigovaného věku) menší objem ledviny oproti dětem narozeným v termínu.82 Menší ledviny korigované vzhledem k tělesnému povrchu (body surface area, BSA) prokázalo více studií, a to jak v dětském věku, tak i u mladých dospělých s anamnézou LBW a prematurity.18,67,73,74,83–86 Také u jedinců s SGA byla popsána významná redukce velikosti ledvin s následným porušeným růstem ledviny postnatálně.87
Nízká porodní hmotnost, prematurita a hypertenze
Prematurita, LBW a urychlení růstu v prvním roce života jsou rizikovými faktory rozvoje HT v dospělém věku, což bylo potvrzeno dvěma metaanalýzami. Mezi LBW a rizikem HT je pak nepřímá úměra (obr. 6).88–90 S tímto závěrem je ve shodě taktéž metaanalýza studií jedinců s anamnézou VLBW a prematurity i studie u mladých dospělých.91,92 Zdá se, že toto riziko je nezávislé na prenatálních a perinatálních vlivech kromě mateřské eklampsie.93
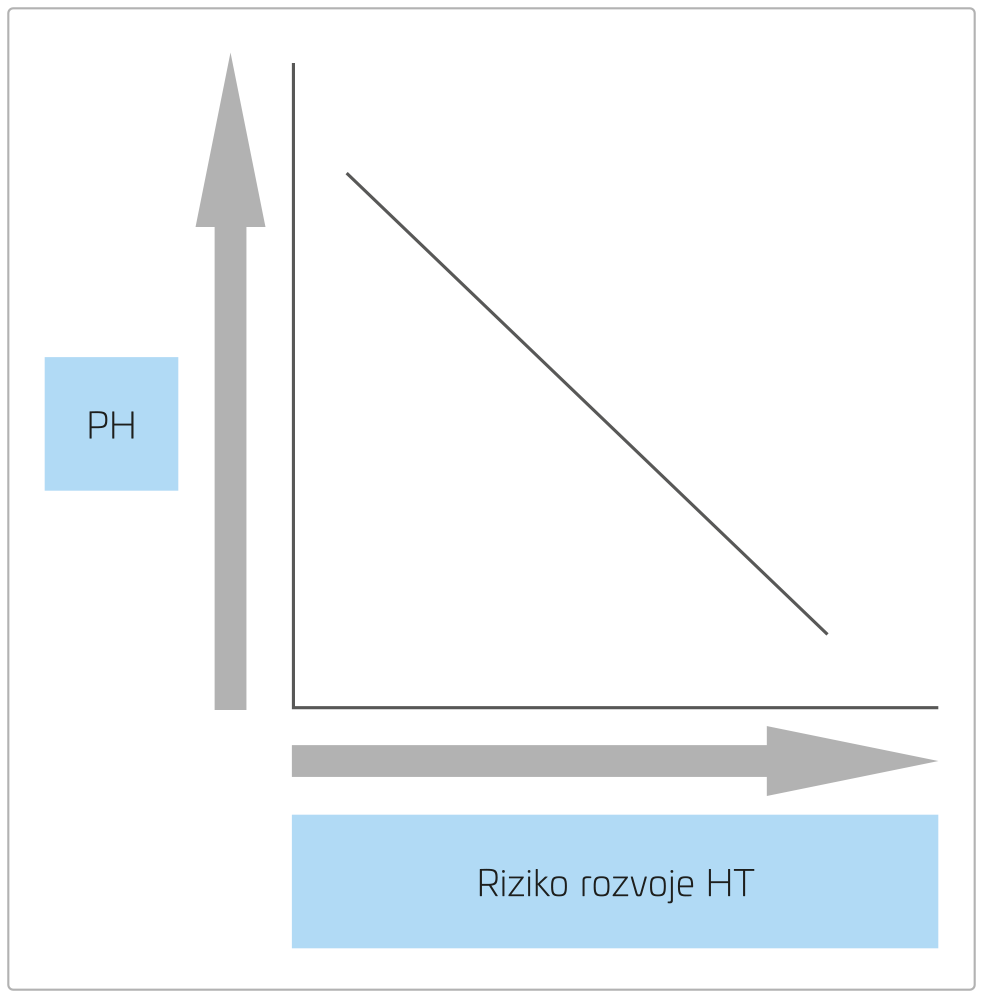
OBR. 6 Vztah mezi LBW a rizikem rozvoje hypertenze.
LBW (low birth weight) – nízká porodní hmotnost; PH – porodní hmotnost; HT – hypertenze
Riziko HT je prokázáno v adolescenci a dětském věku u jedinců s anamnézou prematurity, LBW a postnatálního urychlení růstu.64,71,73,94–100 Vyšší krevní tlak oproti kontrolní skupině lze pozorovat u dětí z prematurity již v raném dětství.101 Obdobně ve věku od jednoho roku do tří let byl u dětí s anamnézou VLBW v porovnání s dětmi narozenými s normální hmotností zjistěn vyšší krevní tlak, který byl ale ještě v rámci referenčních mezí.77,102
Jedinci s primární HT, kteří zemřeli při autonehodě, měli signifikantně nižší množství nefronů a větší glomeruly oproti normotenzním kontrolám.103 Zdá se tedy, že na rozvoji hypertenze u lidí narozených s LBW se podílí právě redukce masy nefronů. Vzhledem k možnému efektu intrauterinní restrikce růstu se lze domnívat, že faktorů podílejících se na rozvoji HT v souvislosti s LBW a prematuritou bude zřejmě více.104


Závěr
Od prvních publikací Barkera a Brennera uplynulo 30 let a dnes již existují přesvědčivá data o nepříznivém vlivu zkrácené gestace a LBW na zdraví. LBW má relativně vysokou incidenci, nižší množství nefronů spojené s LBW tak predisponuje dnes již významnou část populace k rozvoji HT a CKD, které pak vedou ke kardiovaskulárním komplikacím nezávisle na vlivech vnějšího prostředí, genetických a familiárních faktorech. Kardiovaskulární komplikace jsou hlavní příčinou mortality ve vyspělých zemích. Nevěnování dostatečné pozornosti problematice následků LBW tak může mít zásadní negativní vliv na veřejné zdraví. Je potřeba, aby tuto skutečnost vzali na vědomí jak praktičtí lékaři pro děti a dorost, tak praktičtí lékaři pro dospělé a nefrologové, a mohli tak časně zahájit prevenci, edukaci a eventuální terapii s cílem snížit rizika vzniku kardiovaskulárních komplikací. Preventivní vyšetření moči a krevního tlaku u jedinců rizikové skupiny je technicky i finančně nenáročné a může pozitivně ovlivnit prognózu významné části populace.
Definice pojmů
Chronické onemocnění ledvin představuje dle KDIGO funkční nebo strukturální abnormalitu ledvin, jež je přítomna alespoň tři měsíce a ovlivňuje zdraví jedince. Kritéria CKD popisuje tabulka 1.
Klasifikace novorozence dle porodní hmotnosti shrnuje tabulka 2, dle gestačního věku tabulka 3.
Nejednotná je v literatuře definice hypotrofického novorozence (SGA). Z názvu je jasné, že se jedná o novorozence, který je malý vzhledem ke gestačnímu věku. Slovo „malý“ je však často různě definováno, buď hmotností, délkou, či obvodem hlavičky, nebo těmito parametry dohromady s hodnotami pod 3., 5. nebo 10. percentilem. Světová zdravotnická organizace doporučila v roce 1995 definovat děti s hmotností pod 10. percentilem jako SGA. Dle mezinárodního konsenzu z roku 2007 reprezentovaného sedmi pediatrickými endokrinologickými společnostmi je SGA definován jako novorozenec s hmotností a/nebo výškou pod dvěma směrodatnými odchylkami pro daný gestační věk a pohlaví. Nejednotnost definice může vést k různým interpretacím výsledků jednotlivých studií.105
Literatura
- Barker DJ, Osmond C, Winter PD, et al. Weight in infancy and death from ischaemic heart disease. Lancet 1989;334:577–580.
- Barker DJ. The fetal and infant origins of adult disease. BMJ 1990;301:1111.
- Brenner BM, Garcia DL, Anderson S. Glomeruli and Blood Pressure: Less of One, More the Other? Am J Hypertens 1988;1(4 Pt 1):335–347.
- Brenner BM, Barry M, Anderson S. The Interrelationships Among Filtration Surface Area, Blood Pressure, and Chronic Renal Disease. J Cardiovasc Pharmacol 1992;19:1–7.
- Hughson M, Farris AB, Douhlas‑Denton RN, et al. Glomerular number and size in autopsy kidneys: The relationship to birth weight. Kidney Int 2003;63:2113–2122.
- Mañalich R, Reyes L, Herrera M, et al. Relationship between weight at birth and the number and size of renal glomeruli in humans: A histomorphometric study. Kidney Int 2000;58:770–773.
- Luyckx VA, Brenner BM. Clinical consequences of developmental programming of low nephron number. The Anatomical Record 2019. DOI: 10.1002/ar.24270. ISSN 1932‑8486. Dostupné z: https://onlinelibrary.wiley.com/doi/abs/10.1002/ar.24270
- Luyckx VA. Preterm Birth and its Impact on Renal Health. Semin Nephrol 2017;37:311–319.
- Low Birth Weight and Nephron Number Working Group. The Impact of Kidney Development on the Life Course: A Consensus Document for Action. Nephron 2017;136:3–49.
- White SL, Perkovic V, Cass A, et al. Is Low Birth Weight an Antecedent of CKD in Later Life? A Systematic Review of Observational Studies. Am J Kidney Dis 2009;54:248–261.
- Bertrám JF, Douglas‑Denton RN, Diouf B, et al. Human nephron number: implications for health and disease. Pediatr Nephrol 2011;26:1529–1533.
- Puelles VG, Hoy WE, Hughson MD, et al. Glomerular number and size variability and risk for kidney disease. Curr Opin Nephrol Hypertens 2011;20:7–15.
- Hoy WE, Hughson M, Bertrám JF, et al. Nephron Number, Hypertension, Renal Disease, and Renal Failure. J Am Soc Nephrol 2005;16:2557–2564.
- Faa G, Gerosa C, Fanni D, et al. Morphogenesis and molecular mechanisms involved in human kidney development. J Cel Physiol 2012;227:1257–1268.
- Rodríguez MM, Gómez AH, Abitbol CL, et al. Histomorphometric Analysis of Postnatal Glomerulogenesis in Extremely Preterm Infants. Pediatr Dev Pathol 2004;7:17–25.
- Sutherland MR, Gubhaju L, Moore L, et al. Accelerated Maturation and Abnormal Morphology in the Preterm Neonatal Kidney. J Am Soc Nephrol 2011;22:1365–1374.
- Luzckx VA, Bertrám JF, Brenner BM, et al. Effect of fetal and child health on kidney development and long‑term risk of hypertension and kidney disease. Lancet 2013;382:273–283.
- Starzec K, Klimek M, Grudzień A, et al. Longitudinal assessment of renal size and function in extremely low birth weight children at 7 and 11 years of age. Pediatr Nephrol 2016;31:2119–2126.
- Iacobelli SS, Loprieno S, Bonsante F, et al. Renal Function in Early Childhood in Very Low Birthweight Infants. Am J Perinatol 2007;24:587–592.
- Rhone ET, Carmody BJ, Swanson JR, Charlton JR. Nephrotoxic medication exposure in very low birth weight infants. J Matern Fetal Neonatal Med 2014;27:1485–1490.
- Pannu N, Nadim MK. An overview of drug‑induced acute kidney injury. Crit Care Med 2008;36:216–223.
- Misurac JM,Knoderer CA, Leiser JD, et al. Nonsteroidal Anti‑Inflammatory Drugs Are an Important Cause of Acute Kidney Injury in Children. J Pediatr 2013;162:1153–1159.
- Hui‑Stickle S, Brewer ED, Goldstein SL. Pediatric ARF epidemiology at a tertiary care center from 1999 to 2001. Am J Kidney Dis 2005;45:96–101.
- Selewski DT, Charlton JR, Jetton JG, et al. Neonatal Acute Kidney Injury. Pediatrics 2015;136:463–473.
- Carmody BJ, Swanson JR, Rhone ET, Charlton JR. Recognition and Reporting of AKI in Very Low Birth Weight Infants. Clin J Am Soc Nephrol 2014;9:2036–2043.
- Mamme C, Al Abbas A, Skippen P, et al. Long‑term Risk of CKD in Children Surviving Episodes of Acute Kidney Injury in the Intensive Care Unit: A Prospective Cohort Study. Am J Kidney Dis 2012;59:523–530.
- Viaud M, Llanos B, Harambat J. Renal outcome in long‑term survivors from severe acute kidney injury in childhood. Pediatr Nephrol 2012;27:151–152.
- Bruel A, Rozé JC, Quere MP, et al. Renal outcome in children born preterm with neonatal acute renal failure: IRENEO – a prospective controlled study. Pediatr Nephrol 2016;31:2365–2373.
- Askenazi DJ, Feig DI, Graham NM, et al. 3–5 year longitudinal follow‑up of pediatric patients after acute renal failure. Kidney Int 2006;69:184–189.
- Luyckx VA, Brenner BM. Birth weight, malnutrition and kidney‑associated outcomes – a global concern. Nat Rev Nephrol 2015;11:135–149.
- Black RE, Victora CG, Walker SP, et al. Maternal and child undernutrition and overweight in low‑income and middle‑income countries. Lancet 2013;382:427–451.
- Bryce J, Coitinho D, Darnton‑Hill I, et al. Maternal and child undernutrition: effective action at national level. Lancet 2008;371:510–526.
- Bhutta ZA, Das JK, Bahl R, et al. Can available interventions end preventable deaths in mothers, newborn babies, and stillbirths, and at what cost? Lancet 2014;384:347–370.
- Merlet‑Bénichou C, Vilar J, Lelièvre‑Pégorier M, Gilbert T. Role of retinoids in renal development: pathophysiological implication. Curr Opin Nephrol Hypertens 1999;8:39–43.
- Wilcox AJ, Skjaerven R Lie RT. Familial Patterns of Preterm Delivery: Maternal and Fetal Contributions. Am J Epidemiol 2008;167:474–479.
- Collins JW, Rankin KM, David RJ. Low Birth Weight Across Generations: The Effect of Economic Environment. Matern Child Health J 2011;15:438–445.
- Á Rogvi R, Forman JL, Damm P, et al. Women Born Preterm or with Inappropriate Weight for Gestational Age Are at Risk of Subsequent Gestational Diabetes and Pre‑Eclampsia. PLoS ONE 2012;7:e34001.
- Boivin A, Luo ZC, Audibert F, et al. Risk for Preterm and Very Preterm Delivery in Women Who Were Born Preterm. Obstet Gynecol 2015;125:1177–1184.
- Bilano VL, Ota E, Ganchimeg T, et al. Risk Factors of Pre‑Eclampsia/Eclampsia and Its Adverse Outcomes in Low‑ and Middle‑Income Countries: A WHO Secondary Analysis. PLoS ONE 2014;9:e91198.
- Sengpiel V, Elind E, Bacelis J, et al. Maternal caffeine intake during pregnancy is associated with birth weight but not with gestational length: results from a large prospective observational cohort study. BMC Med 2013;11:42.
- Chen LW, Wu Y, Neelakantan N, et al. Maternal caffeine intake during pregnancy is associated with risk of low birth weight: a systematic review and dose‑response meta‑analysis. BMC Med 2014;12:174.
- Nykjaer C, Alwan NA, Greenwood DC, et al. Maternal alcohol intake prior to and during pregnancy and risk of adverse birth outcomes: evidence from a British cohort. J Epidemiol Community Health 2014;68:542–549.
- Caputo C, Wood E, Jabbour L. Impact of fetal alcohol exposure on body systems: A systematic review. Birth Defects Res C Embryo Today 2016;108:174–180.
- Cnattingius S, Granath F, Petersson G, Harlow BL. The Influence of Gestational Age and Smoking Habits on the Risk of Subsequent Preterm Deliveries. N Engl J Med 1999;341:943–948.
- Kooijman MN, Akker H, Franco OH, et al. Fetal Smoke Exposure and Kidney Outcomes in School‑Aged Children. Am J Kidney Dis 2015;66:412–420.
- Al‑Odat I, Chen H, Chan YL, et al. The Impact of Maternal Cigarette Smoke Exposure in a Rodent Model on Renal Development in the Offspring. PLoS ONE 2014;9:e103443.
- Högberg L, Snattingius S, Lundholm C, et al. Effects of maternal smoking during pregnancy on offspring blood pressure in late adolescence. J Hypertens 2012;30:693–699.
- Schreuder MF, Langemeijer ME, Bökenkamp A, et al. Hypertension and microalbuminuria in children with congenital solitary kidneys. J Paediatr Child Health 2008;44:363–368.
- Bhathena DB, Julian BA, McMorrow GR Baehler RW. Focal Sclerosis of Hypertrophied Glomeruli in Solitary Functioning Kidneys of Humans. Am J Kidney Dis 1985;5:226–232.
- Argueso LR, Ritchey ML, Boyle ET, et al. Prognosis of patients with unilateral renal agenesis. Pediatr Nephrol 1992;6:412–416.
- Wikstad I, Celsi G, Larsson L, et al. Kidney function in adults born with unilateral renal agenesis or nephrectomized in childhood. Pediatr Nephrol 1988;2:177–182.
- Abou Jaoude P, Dubourg L, Bacchetta J, et al. Congenital versus acquired solitary kidney: is the difference relevant? Nephrol Dial Transplant 2011;26:2188–2194.
- Lentine KL, Lam NN, Seteb DK. Risks of Living Kidney Donation. Clin J Am Soc Nephrol 2019;14:597–608.
- Rastogi A, Yuan S, Arman F, et al. Blood Pressure and Living Kidney Donors. Transplant Direct 2019;5:488.
- Wang X, Johnson AC, Sasser JM, et al. Spontaneous one‑kidney rats are more susceptible to develop hypertension by DOCA‑NaCl and subsequent kidney injury compared with uninephrectomized rats. Am J Physiol Renal Physiol 2016;310:F1054–F1064.
- Singh RR, Denton KM, Bertram J, et al. Development of cardiovascular disease due to renal insufficiency in male sheep following fetal unilateral nephrectomy. J Hypertens 2009;27:386–396.
- Woods LL, Weeks DA a Rasch R. Hypertension After Neonatal Uninephrectomy in Rats Precedes Glomerular Damage. Hypertension 2001;38:337–342.
- Franco MCP, Oliveira V, Ponzio B, et al. Influence of Birth Weight on the Renal Development and Kidney Diseases in Adulthood: Experimental and Clinical Evidence. Int J Nephrol 2012;2012:1–5.
- Xu R, Zuo L. Low birthweight and chronic kidney disease. Nephrology 2010;15:18–22.
- Vikse BE, Irgents LM, Leivestad T, et al. Low Birth Weight Increases Risk for End‑Stage Renal Disease. J Am Soc Nephrol 2008;19:151–157.
- Ruggajo P, Skrunes R, Svarstad E, et al. Familial Factors, Low Birth Weight, and Development of ESRD: A Nationwide Registry Study. Am J Kidney Dis 2016;67:601–608.
- Crump C, Sundquist J, Winkleby MA, Sundquist K. Preterm birth and risk of chronic kidney disease from childhood into mid‑adulthood: national cohort study. BMJ 2019;365:l1346.
- Eriksson JG, Salonen MK, Kajantie E, et al. Prenatal Growth and CKD in Older Adults: Longitudinal Findings From the Helsinki Birth Cohort Study, 1924–1944. Am J Kidney Dis 2018;71:20–26.
- Khalsa DDK, Beydoun HA, Carmody JB. Prevalence of chronic kidney disease risk factors among low birth weight adolescents. Pediatr Nephrol 2016;31:1509–1516.
- Murai‑Takeda A, Kanda T, Azegami T, et al. Low birth weight is associated with decline in renal function in Japanese male and female adolescents. Clin Exp Nephrol 2019;23:1364–1372.
- Keijzer‑Veen MG, Schrevel M, Finken MJJ, et al. Microalbuminuria and Lower Glomerular Filtration Rate at Young Adult Age in Subjects Born Very Premature and after Intrauterine Growth Retardation. J Am Soc Nephrol 2005;16:2762–2768.
- Paquette K, Fernandes RO, Xie LF, et al. Kidney Size, Renal Function, Ang (Angiotensin) Peptides, and Blood Pressure in Young Adults Born Preterm. Hypertension 2018;72:918–928.
- Gielen M, Pinto‑Sietsma SJ, Zeegers MP, et al. Birth Weight and Creatinine Clearance in Young Adult Twins: Influence of Genetic, Prenatal, and Maternal Factors. J Am Soc Nephrol 2005;16:2471–2476.
- Hirano D, Ishikura K, Uemura O, et al. Association between low birth weight and childhood‑onset chronic kidney disease in Japan: a combined analysis of a nationwide survey for paediatric chronic kidney disease and the National Vital Statistics Report. Nephrol Dial Transplant 2016;31:1895–1900.
- Hsu CW, Yakamoto KT, Henry RK, et al. Prenatal Risk Factors for Childhood CKD. J Am Soc Nephrol 2014;25:2105–2111.
- Gilasrka M, Raaijmakers A, Zhang ZY, et al. Extremely Low Birth Weight Predisposes to Impaired Renal Health: A Pooled Analysis. Kidney Blood Press Res 2019;44:897–906.
- Vollsaeter M, Halvorsen T, Markestad T, et al. Renal function and blood pressure in 11 year old children born extremely preterm or small for gestational age. PLoS One 2018;13:e0205558.
- Raaijmakers A, Zhang ZY, Claessens J, et al. Does Extremely Low Birth Weight Predispose to Low‑Renin Hypertension? Hypertension 2017;69:443–449.
- Kwinta P, Klimek M, Drozdz D, et al. Assessment of long‑term renal complications in extremely low birth weight children. Pediatr Nephrol 2011;26:1095–1103.
- Ferdous F, Ma E, Raqib R, et al. Birth weight influences the kidney size and function of Bangladeshi children. J Dev Orig Health Dis 2018;9:386–394.
- Shinzawa M, Tanaka S, Tokumasu H, et al. Association of Low Birth Weight With Childhood Proteinuria at Age 3 Years: A Population‑Based Retrospective Cohort Study. Am J Kidney Dis 2019;74:141–143.
- Frankfurt JA, Duncan AF, Heyne RJ, et al. Renal function and systolic blood pressure in very‑low‑birth‑weight infants 1–3 years of age. Pediatr Nephrol 2012;27:2285–2291.
- Vanpée M, Blennow M, Linné T, et al. Renal function in very low birth weight infants: Normal maturity reached during early childhood. J Pediatr 1992;121:784–788.
- Rakow A, Johansson S, Legnevall L, et al. Renal volume and function in school‑age children born preterm or small for gestational age. Pediatr Nephrol 2008;23:1309–1315.
- Keijzer‑Veen MG, Kleinveld HA, Lequin MH, et al. Renal Function and Size at Young Adult Age After Intrauterine Growth Restriction and Very Premature Birth. Am J Kidney Dis 2007;50:542–551.
- Bueters R RG, Caj Van De Kar N, Fschreuder M. Adult Renal Size is Not a Suitable Marker for Nephron Numbers: An Individual Patient Data Meta‑Analysis. Kidney Blood Press Res 2013;37:540–546.
- Kandasmy Y, Smith R, Wright IMR, et al. Extra‑uterine renal growth in preterm infants: Oligonephropathy and prematurity. Pediatr Nephrol 2013;28:1791–1796.
- Spencer J, Wang Z, Hoy W. Low birth weight and reduced renal volume in Aboriginal children. Am J Kidney Dis 2001;37:915–920.
- Keijzer‑Veen MG, Devos AS, Meradji M, et al. Reduced renal length and volume 20 years after very preterm birth. Pediatr Nephrol 2010;25:499–507.
- Bakker H, Gaillard R, Franco OH, et al. Fetal and Infant Growth Patterns and Kidney Function at School Age. J Am Soc Nephrol 2014;25:2607–2615.
- Iyegar A, Nesargi S, George A, et al. Are low birth weight neonates at risk for suboptimal renal growth and function during infancy? BMC Nephrol 2016;17:100.
- Schmidt M, Chellakooty M, Boisen KA, et al. Impaired kidney growth in low‑birth‑weight children: Distinct effects of maturity and weight for gestational age. Kidney Int 2005;68:731–740.
- Bayman E, Drake AJ, Payasena C. Prematurity and programming of cardiovascular disease risk: a future challenge for public health? Arch Dis Child Fetal Neonatal Ed 2014;99:F510–F514.
- Mu M, Wang SF, Sheng J, et al. Birth weight and subsequent blood pressure: A meta‑analysis. Arch Cardiovasc Dis 2012;105:99–113.
- Parkinson JRC, Hyde MJ, Gale C, et al. Preterm Birth and the Metabolic Syndrome in Adult Life: A Systematic Review and Meta‑analysis. Pediatrics 2013;131:1240–1263.
- De Jong F, Monuteaux MC, Van Elburg RM, et al. Systematic Review and Meta‑Analysis of Preterm Birth and Later Systolic Blood Pressure. Hypertension 2012;59:226–234.
- Crump C, Winkleby MA, Sundquist K, et al. Risk of Hypertension Among Young Adults Who Were Born Preterm: A Swedish National Study of 636,000 Births. Am J Epidemiol 2011;173:797–803.
- Hovi P, Vohr B, Ment LR, et al. Blood Pressure in Young Adults Born at Very Low Birth Weight. Hypertension 2016;68:880–887.
- Wang X, Dong Y, Zou Z, et al. Low Birthweight Is Associated with Higher Risk of High Blood Pressure in Chinese Girls: Results from a National Cross‑Sectional Study in China. Int J Environ Res Public Health 2019;16:2898.
- Lule SA, Namara B, Akurut H, et al. Are birthweight and postnatal weight gain in childhood associated with blood pressure in early adolescence? Results from a Ugandan birth cohort. Int J Epidemiol 2019;48:148–156.
- Strufaldi MWL, Silva EMK, Franco MCP, et al. Blood pressure levels in childhood: probing the relative importance of birth weight and current size. Eur J Pediatr 2009;168:19–624.
- 97. Gilarska M, Klimek M, Grudzien A, et al. Blood Pressure Profile in the 7th and 11th Year of Life in Children Born Prematurely. Iran J Pediatr 2016;26:e5080.
- Vohr BR, Heyne R, Bann C, et al. High Blood Pressure at Early School Age Among Extreme Preterms. Pediatrics 2018;142:e20180269.
- Lurbe E, Garcia‑Vicent C, Torro MI, et al. Associations of Birth Weight and Postnatal Weight Gain With Cardiometabolic Risk Parameters at 5 Years of Age. Hypertension 2014;63:1326–1332.
- Salgado CM, Jardim PCBV, Teles F, et al. Baixo peso ao nascer como m arcador de alterações na monitorização ambulatorial da pressão arterial. Arq Bras Cardiol 2009;92(2).
- Vashishta N, Surapaneni V, Chawla S, et al. Association among prematurity (<30 weeks’ gestational age), blood pressure, urinary albumin, calcium, and phosphate in early childhood. Pediatr Nephrol 2017;32:1243–1250.
- Duncan AF, Heyne RJR, Morgan, et al. Elevated systolic blood pressure in preterm very‑low‑birth‑weight infants ≤ 3 years of life. Pediatr Nephrol 2011;26:1115–1121.
- Keller G, Zimmer G, Mall G, et al. Nephron Number in Patients with Primary Hypertension. N Engl J Med 2003;348:101–108.
- Juonala M, Cheung MH, Sabin MA, et al. Effect of birth weight on life‑course blood pressure levels among children born premature. J Hypertens 2015;33:1542–1548.
- Zeve D, Regelmann MO, Holzman IR, Rapaport R. Small at Birth, but How Small? The Definition of SGA Revisited. Horm Res Paediatr 2016;86:357–360.
- Kategorie: Názor hosta
- Klíčová slova: hypertenze (vysoký krevní tlak); chronické onemocnění ledvin; nízká porodní hmotnost