Pacient s kryptosporidiózou po transplantaci ledviny
Klíčová slova: Cryptosporidium parvum – imunosuprese – infekce – parazit – průjmy – transplantace
Kazuistika
V našem sdělení popisujeme případ 33letého pacienta, který podstoupil v červnu roku 2023 první transplantaci ledviny od kadaverózního dárce.
Anamnesticky pacient v dětství trpěl na opakované záněty močových cest a byl dlouhodobě sledován pro nález bílkoviny v moči. Pro progresi renální dysfunkce podstupuje ve 28 letech biopsii ledvin s nálezem blíže nespecifikované chronické glomerulonefritidy s pokročilými chronickými změnami. Po přechodném terapeutickém pokusu s kortikoidy bylo v roce 2021 zahájeno dialyzační léčení. Pacient byl následně zařazen na čekací listinu k transplantaci ledviny, která byla provedena od marginálního dárce v červnu 2023. Indukční terapie byla zvolena s antilymfocytárním globulinem, dále v trojkombinaci takrolimus, mykofenolát mofetil, prednison. Z chirurgického hlediska byl operační výkon nekomplikovaný. Po výkonu byl zaznamenán okamžitý, ale pozvolný rozvoj funkce štěpu. Po kontrolní biopsii s nálezem regenerující akutní tubulární nekrózy (ATN) byl pacient 18. pooperační den propuštěn do domácí péče s koncentrací kreatininu v séru 270 µmol/l.
Komplikací v průběhu druhého měsíce po transplantaci byl významný nárůst replikace polyoma BK viru na 5× 105 kopií. Proto byla indikována biopsie štěpu, která prokázala závažnou BK nefropatii s ložiskovou zánětlivou destrukcí tubulointersticia (PVN class 2). I přes změnu udržovací imunosupresivní terapie na cyklosporin A a redukci dávky mykofenolátu nedošlo k redukci replikace BK viru, funkce štěpu transplantované ledviny byla nadále omezená (Cr 330 µmol/l). Proto byl po dvou měsících od transplantace z terapie vysazen mykofenolát a za hospitalizace jsme podali intravenózní imunoglobuliny.
Po dvou dnech hospitalizace došlo u pacienta k rozvoji průjmového onemocnění doprovázeného i významným horním dyspeptickým syndromem. Nativní snímek břicha prokázal četné hladinky nedilatovaných střevních kliček, sonograficky bylo popsáno prosáknutí stěny sigmoidea a dilatace colon ascendens. Byla zahájena rehydratační a symptomatická terapie, odebrány kultivace. Se vzestupem hodnoty C‑reaktivního proteinu (CRP) zahajujeme empiricky antibiotickou (ATB) terapii v kombinaci ciprofloxacin a metronidazol. V dalším průběhu ale stav progredoval, sonograficky byl nález stacionární, i akutně provedené vyšetření výpočetní tomografií (CT) břicha však bylo s negativním nálezem.
Rozvinuly se febrilie a hodnota CRP dosahovala 130 mg/l. Vzhledem k horšícímu se klinickému obrazu pacienta léčeného kombinací již intravenózně podávaných ATB eskalujeme antibiotickou terapii na meropenem, a spíše z rozpaků jsme tak podali i ganciklovir.
Při opakování vyšetření stolice jsme ověřili přítomnost Clostridium difficile a podali fidaxomicin, který ovšem neměl žádný větší efekt.
Proto jsme doplnili endoskopická vyšetření. Gastroskopie byla mimo malý erytém těla žaludku s normálním nálezem. Kolonoskopie vyloučila pablánovou kolitidu, byly popsány nespecifické zánětlivé změny tračníku a odebrány četné etážové biopsie.
Vylučovali jsme tak postupně možné příčiny průjmů u pacienta po transplantaci ledviny (tab. 1). Z neinfekčních příčin jsou nejčastějšími nežádoucí účinky léčiv, zejména mykofenolátu, ten byl v případě našeho pacienta pro nález BK nefropatie redukován a vysazen.
Z infekčních příčin průjmů jsme potenciální virová agens testovali s negativním výsledkem, cytomegalovirus byl opakovaně vyloučen.
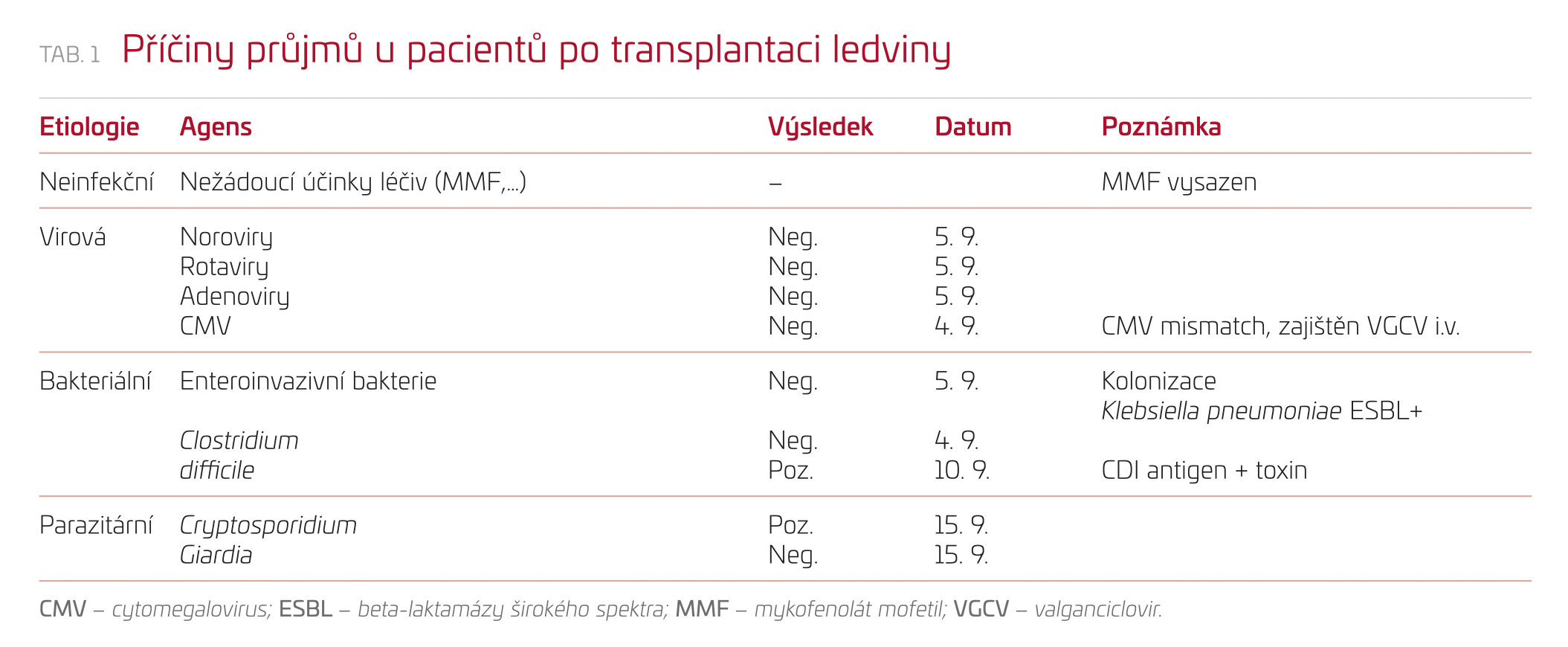
Screeningem bakteriálních agens jsme zjistili střevní kolonizaci Klebsiella pneumoniae ESBL+ (beta‑laktamázy širokého spektra) nevyžadující ATB terapii. Clostridia vyšla při opakování testu pozitivní, nevysvětlila vzhledem k pokračování průjmů přes více než týden trvající specifickou terapii všechny pacientovy obtíže.
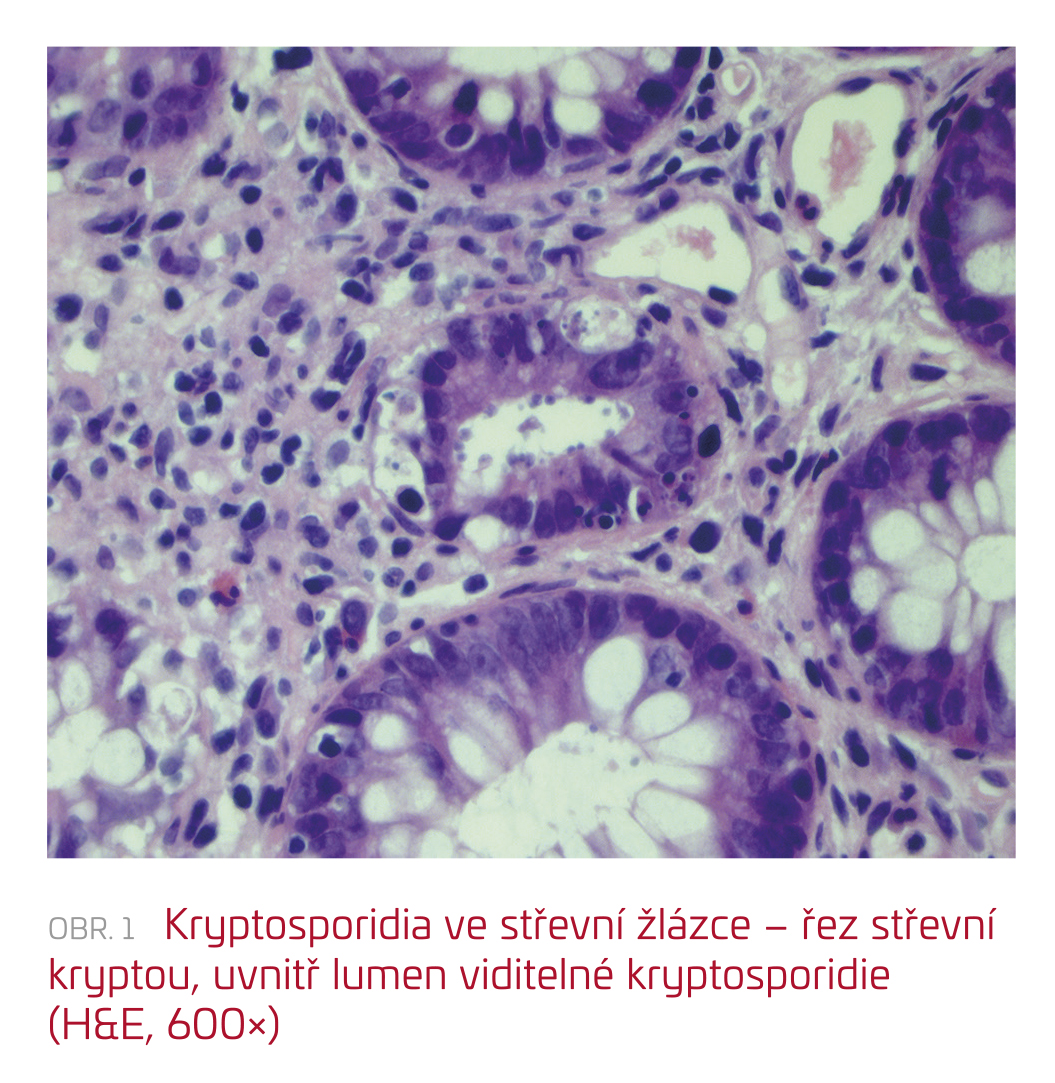
Možnou další, neobvyklou příčinou je parazitární etiologie průjmů. Z diagnostických rozpaků jsme tak odeslali stolici na parazitologické vyšetření – s překvapivým pozitivním nálezem kryptosporidií. Kryptosporidia byla rovněž identifikována při histopatologickém vyšetření z odebraných bioptických vzorků při kolonoskopickém vyšetření (obr. 1).
Při pátrání po možném rizikovém zdroji infekce jsme zjistili, že v týdnu před nástupem k hospitalizaci pacient konzumoval kukuřici z nedalekého pole u místa bydliště. Ta byla pravděpodobně kontaminována infekčními oocystami.
Léčebný postup jsme diskutovali s infektologem; nitazoxanid, lék volby na kryptosporidiózu ve Spojených státech amerických, není v České republice dostupný. Zkušenosti v Evropě jsou s podáním makrolidových ATB, a proto jsme podali azitromycin. Efekt terapie na ústup průjmů byl promptní, a tak jsme podávání přípravku mohli ukončit po třech dnech.
Další komplikací byly bolesti v epigastriu doprovázené elevací hodnot jaterních testů a amyláz. Ultrazvuk prokázal objemný žlučník a sludge. Endosonografie ozřejmila štíhlý choledochus bez lithiázy a rovněž objemný žlučník s hustým obsahem. Vzhledem k následné úpravě klinického stavu situaci uzavíráme jako pravděpodobný průchod konkrementu.
V diferenciální diagnostice jsme zvažovali komplikace kryptosporidiové infekce u imunosuprimovaných pacientů, kdy žlučník a žlučové cesty mohou být potenciálním rezervoárem parazita. Rychlá úprava klinického stavu toho času ale nesvědčila pro perzistující aktivitu onemocnění.
Kryptosporidióza
Kryptosporidióza je parazitární onemocnění způsobené prvokem o velikosti asi 5 µm, u člověka druhy Cryptosporidium parvum či C. hominis (dříve genotyp I a II).
Cryptosporidium je obligátně intracelulární, extracytoplazmatický parazit obratlovců (tj. je obklopen membránou hostitelské buňky, ale není přítomen přímo v cytoplazmě). U člověka se jedná o enterální patogen způsobující nejčastěji gastrointestinální onemocnění – kryptosporidiózu.1
Zdrojem je nejčastěji prostředí kontaminované oocystami – například voda, potrava. Je možný i mezilidský přenos mezi členy domácnosti, pečovateli (například v afrických zemích je dokonce častější než ten zoonotický), včetně sexuálního. Popisován je rovněž respirační přenos, ale není zcela objasněn, existuje evidence přítomnosti kryptosporidií i ve sputu některých infikovaných jedinců.
Onemocnění je velmi infekční – infekční dávka v řádu desítek oocyst stačí k nákaze. Následně infikovaný jedinec vylučuje miliony infekčních oocyst. Kryptosporidie jsou velmi rezistentní (chlor, jod) a v prostředí přežijí měsíce.
Incidence není přesně známa, 3–5/100 000 u dospělých, u dětí až 9/100 000 (u dětí v rozvojových zemích je pravděpodobně po rotavirech druhou nejčastější příčinou infekčních průjmů a rizikovým faktorem zvýšené mortality). Většina případů pravděpodobně není hlášena, a incidence se tak odhaduje až 80× vyšší.
Epidemie jsou nejčastěji asociovány s kontaminovanými vodními zdroji, rekreačními vodními zařízeními (rybníky, bazény, jezera). Ohniska jsou také spojena s farmami či mohou vznikat cestovatelské clustery. Největší epidemie dosud byla zaznamenána v Milwaukee v roce 1993, kdy se z kontaminované vody nakazilo přes 400 tisíc lidí.
Patogeneze průjmu je dána přímým poškozením epitelu parazitem, nepřímo pak poškozením při aktivaci zánětlivé odpovědi. Důsledkem je vznik sekrečního průjmu s malabsorpcí. V imunitní odpovědi je klíčová produkce interferonu gama (IFNγ) s následnou aktivací adaptivní, zejména T buněčné imunity. Zásadní roli T buněk podporuje i velmi těžký průběh onemocnění u pacientů s AIDS, u nichž dochází k výraznému zlepšení až ústupu symptomů po efektu antiretrovirální terapie s nárůstem počtu CD4+ lymfocytů.2 Analogicky pak pomyslné zotavení imunitního systému u pacientů po transplantaci umožňuje redukce imunosupresivní terapie.
Inkubační doba je dva dny až dva týdny. Onemocnění je v běžné populaci popisováno jako „self‑limiting“, do jednoho až dvou týdnů i bez terapie ustupuje, ale exkrece oocyst může pokračovat i po ústupu obtíží. U imunokompromitovaných může probíhat i jako závažné, chronické onemocnění s četnými komplikacemi. Většinu těchto poznatků o závažném průběhu onemocnění máme od pacientů s HIV/AIDS (human immunodeficiency virus / acquired immunodeficiency syndrome).
I u pacientů po transplantaci orgánů může kryptosporidiová infekce proběhnout zcela bez příznaků, dle dostupné argentinské studie byla při vyšetření stolice asymptomatických pacientů po transplantaci ledviny zjištěna poměrně vysoká prevalence oocyst i v jejich vzorcích.3
Při jasných klinických projevech se pak pacienti po transplantaci prezentují typicky jako náš pacient profuzními vodnatými průjmy s nauzeou a zvracením, bolestmi břicha, febriliemi. Mohou se přidat i další symptomy jako bolesti hlavy, nechutenství či flu‑like příznaky.2
Komplikací onemocnění může být dehydratace a malnutrice, u dětí neprospívání. Kombinací dehydratace s hypotenzí, někdy s přispěním toxicity kalcineurinových inhibitorů, dochází k rozvoji akutního poškození ledvin (AKI).2,6
U imunosuprimovaných pacientů bylo popsáno i postižení biliárního traktu, rozvoj hepatitidy, pankreatitidy a dále také, že žlučové cesty mohou být pomyslným rezervoárem kryptosporidií a příčinou relapsu tohoto onemocnění.4 Někteří pacienti tak mohou dospět i k cholecystektomii.
Diseminovaná forma kryptosporidiózy nikdy popsána nebyla. Z dlouhodobých následků patří mezi nejčastější syndrom dráždivého tračníku, únava, cefalea, bolesti očí či kloubů.
K diagnostice můžeme použít nejobvykleji vzorek stolice, organismy ale mohou být přítomny i ve sputu, v duodenálním aspirátu, žlučových sekretech či ve vzorku postižené střevní sliznice. Nejtradičnější z diagnostických metod je mikroskopické vyšetření stolice, diagnóza tkví v detekci typických oocyst, používáno je modifikované barvení dle Zeiehla–Neelsena. Další možností jsou imunofluorescenční metody či vyšetření primární řetězovou reakcí (PCR), výhodou PCR je schopnost rozlišit i jednotlivé genotypy. Stanovení diagnózy je možné i na základě histopatologického vyšetření postižené části střeva (obr. 1).
K obecným přístupům terapie patří rehydratace, korekce vnitřního prostředí, dieta.
Logickým krokem je změna či redukce imunosupresivní terapie. Samotný imunosupresivní režim hraje také svou roli, dle některých studií s vyšším rizikem pro pacienty léčené takrolimem oproti léčbě cyklosporinem.5 Mykofenolát, na jedné straně jako častá neinfekční příčina průjmů, se svým inhibičním mechanismem na metabolismus folátů naopak vykazuje i antiparazitickou aktivitu.6 Je zřejmý rozdíl mezi pacienty po transplantacích a pacienty s HIV, pro které je klíčová role antiretrovirální terapie.
Nitazoxanid je jediným přípravkem schváleným americkým Úřadem pro kontrolu potravin a léčiv (FDA) pro léčbu tohoto onemocnění.7 Nemá významné lékové interakce a není nutná redukce dávek u pacientů s renálním či jaterním selháním, dle randomizovaných klinických studií u imunokompetentních zkracuje délku trvání průjmů a snižuje množství vylučovaných oocyst.
Další možností jsou makrolidy, rovněž zkracují dobu trvání symptomů a eradikují oocysty.
Dále je zvažován paromomycin – doporučený pouze do kombinace s předchozími přípravky – či rifamyciny, jejichž efekt byl doložen u pacientů s HIV v rámci chemoprofylaxe Mycobacterium avium.8
Popsaný případ je dle našich zkušeností v poslední dekádě ojedinělým záchytem symptomatické kryptosporidiózy, což vysvětluje i určité diagnostické zdržení, možná spojené i se souběžným nálezem častého původce závažných průjmů, tj. Clostridium difficile. Je tedy vhodné v případě nevysvětlené příčiny průjmů, nejen u pacientů po transplantacích, pomýšlet i na parazitární etiologii a při nejasnostech odeslat stolici i na parazitologické vyšetření.
K dispozici máme zkušenosti od HIV pozitivních pacientů, popis průběhu, terapie a komplikací je často extrapolován z této specifické populace, ale ani zde nejsou k dispozici randomizované studie s větším počtem pacientů.9
U pacientů po transplantacích tvoří literární evidenci obvykle kazuistiky nebo série kazuistik často z endemických oblastí s celkově vysokou prevalencí onemocnění a také z pediatrické populace.5,6 Evidence z Evropy u dospělých není příliš bohatá. V nedávné francouzské studii bylo Cryptosporidium a Microsporidium identifikováno u 10 ze 73 vyšetřených symptomatických pacientů po transplantaci ledviny nebo ledviny a pankreatu s průjmy.10 Retrospektivní databázová analýza hlášených případů kryptosporidiózy byla provedena ve Francii u pacientů po transplantacích mezi lety 2006–2010 (TRANSCRYPTO).11 Za čtyři roky bylo uváděno celkem 47 případů onemocnění. Většina pacientů byla léčena nitazoxanidem, druhým nejčastěji používaným lékem byl azitromycin. V našem případě byla empirická terapie tímto u nás dostupným lékem také účinná.
Je ke zvážení, zda by Cryptosporidium mělo být součástí screeningového panelu enterálních patogenů.
Literatura
- Gerace E, Lo Presti VDM, Biondo C. Cryptosporidium Infection: Epidemiology, Pathogenesis, and Differential Diagnosis. Eur J Microbiol Immunol (Bp) 2019;9:119–123.
- Florescu DF, Sandkovsky U. Cryptosporidium infection in solid organ transplantation. World J Transplant 2016;6:460–471.
- Roncoroni AJ, Gomez MA, Mera J, et al. Cryptosporidium infection in renal transplant patients. J Infect Dis 1989;160:559.
- Abdo A, Klassen J, Urbanski S, et al. Reversible sclerosing cholangitis secondary to cryptosporidiosis in a renal transplant patient. J Hepatol 2003;38:688–691.
- Bhadauria D, Goel A, Kaul A, et al. Cryptosporidium infection after renal transplantation in an endemic area. Transpl Infect Dis 2015;17:48–55.
- Krause I, Amir J, Cleper R, et al. Cryptosporidiosis in children following solid organ transplantation. Pediatr Infect Dis J 2012;31: 1135–1138.
- Schneider A, Wendt S, Lübbert C, Trawinski H. Current pharmacotherapy of cryptosporidiosis: an update of the state‑of‑the‑art. Expert Opin Pharmacother 2021;22:2337–2342.
- Fichtenbaum CJ, Zackin R, Feinberg J, et al.; AIDS Clinical Trials Group New Works Concept Sheet Team 064. Rifabutin but not clarithromycin prevents cryptosporidiosis in persons with advanced HIV infection. AIDS 2000;14:2889–2893.
- Diptyanusa A, Sari IP. Treatment of human intestinal cryptosporidiosis: A review of published clinical trials. Int J Parasitol Drugs Drug Resist 2021;17:128–138.
- Deltombe C, Lefebvre M, Morio F, et al. Cryptosporidiosis and microsporidiosis as causes of diarrhea in kidney and/or pancreas transplant recipients. Med Mal Infect 2020;50:407–413.
- Lanternier F, Amazzough K, Favennec L, et al.; ANOFEL Cryptosporidium National Network and Transplant Cryptosporidium Study Group. Cryptosporidium spp. Infection in Solid Organ Transplantation: The Nationwide “TRANSCRYPTO” Study. Transplantation 2017;101:826–830.
- Kategorie: Kazuistiky
- Klíčová slova: Cryptosporidium parvum; imunosuprese; infekce; parazit; průjmy; transplantace