Marginální dárce ledvin – co to znamená a jak k tomu přistupujeme?
Souhrn
Termín marginální dárce vyjadřuje, poněkud pejorativně, horší kvalitativní charakteristiku odebrané ledviny. V přehledu nabízíme vhled do problematiky definice marginality, bioptického hodnocení ultrastrukturálních změn v ledvinách marginálních dárců a posouzení rizika vyplývajícího z takové charakteristiky pro alokační systém a pro samotného příjemce či volbu imunosupresivního režimu.
Přestože neexistuje definice ideálního dárce ledvin, pro ilustraci využijme zemřelého dárce mladého věku s izolovaným kraniotraumatem bez doprovodných komorbidit a poškození nitrobřišních a nitrohrudních orgánů. Odebraný orgán by měl mít normální anatomii bez dalších anomálií. V případě transplantace takového orgánu lze očekávat perfektní startovní podmínky pro další posttransplantační průběh. Snaha zpřesňovat definici marginality je posilována s cílem jednak odhadnout pravděpodobný posttransplantační průběh a současně využít tento parametr v rámci alokačního systému.
Definice marginálního dárce
Při setrvale se zvyšujícím počtu čekatelů na orgánovou transplantaci je logická snaha o využívání orgánů, které se svou charakteristikou více či méně vzdalují od zmiňovaného ideálu. V nomenklatuře je využívána řada pojmů, které se svým významem překrývají: Marginální dárce je obecný a široký termín poukazující na suboptimalitu odebraného orgánu. V podstatě neexistuje jeho jednoznačná definice a kritériem hodnocení může bý nejen věk, ale i další komorbidity dárce (akutní orgánové poškození, protrahovaná studená ischemie, onemocnění s rizikem přenosu od dárce na příjemce, malignita, civilizační choroby atd.) či proběhlý předodběrový inzult. Marginalita je blíže specifikována v termínu „dárce s rozšířenými kritérii“, který prvně použil Kaufmann v roce 1997. Ten zrazuje od poněkud pejorativního pojmu „marginální“. Exaktnější definice byla poskytnuta dalšími pracemi. Jednoznačnou definici poskytla analýza United Network for Organ Sharing data (UNOS), která vznikla z jednání v Crystal City (tab. 1) a zavádí pojem dárce ECD (expanded criteria donor). Vychází z analýzy dárcovských charakteristik spojených s vyšším relativním rizikem (1,7×) selhání transplantované ledviny.
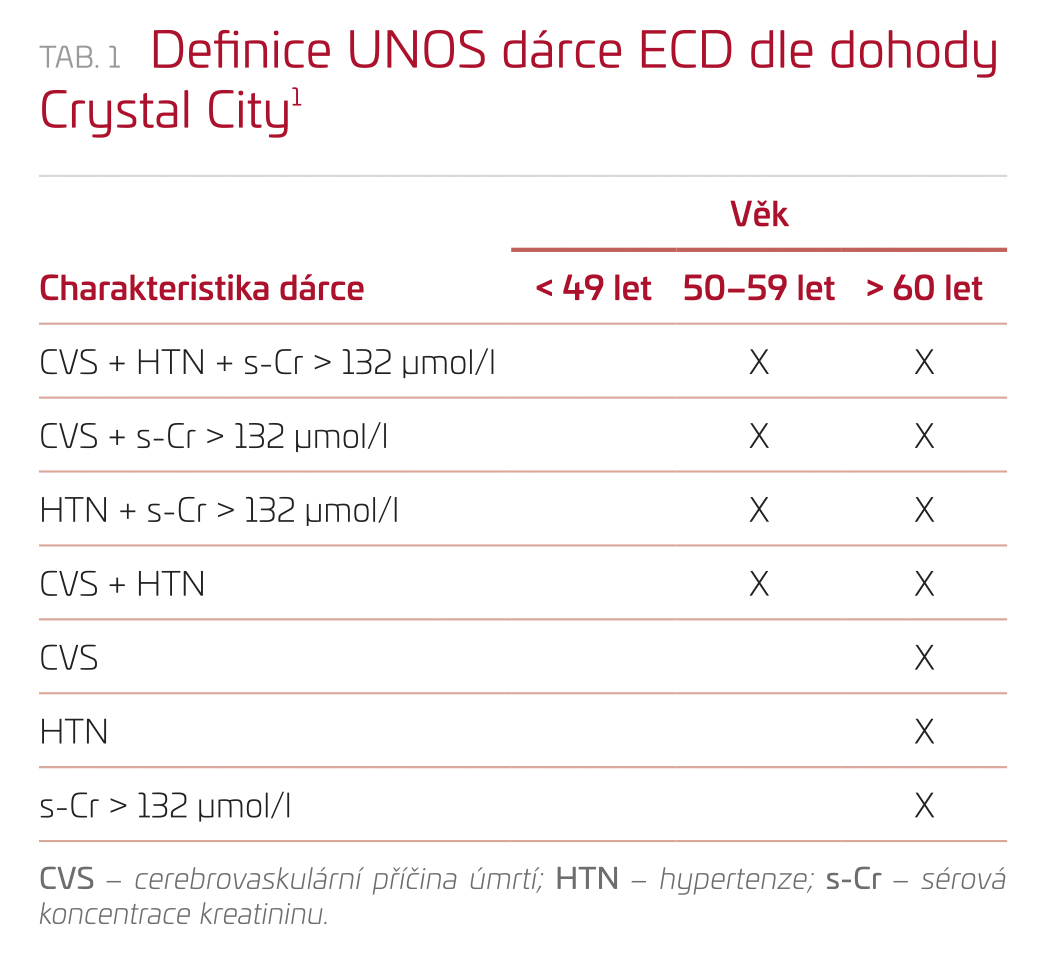
Referenční skupinou v této analýze byli dárci ve věku 10–39 let s jinou než cerebrovaskulární příčinou úmrtí s hodnotou koncentrace kreatininu v séru < 132 µmol/l.1,2 Transplantace ledvin od takto definovaných dárců ECD po nevratné zástavě oběhu (donation after circulatory death, DCD) byly v delším sledování spojeny s vyšším výskytem primárních afunkcí a zpoždění funkce štěpu (DGF), stejně jako s horšími parametry přežívání pacientů i transplantovaných ledvin.3 Navzdory nižšímu přežití pacientů a štěpů u transplantací ledvin od dárců ECD ve srovnání s dárci se standardními kritérii přináší transplantace od dárců ECD benefit ve srovnání s čekáním na dialýze.4–8 Sporná je absolutní přenositelnost zkušeností a zkušenosti ze zámořských programů přenesené do našeho prostředí. Metaanalýza Querardové ukazuje rozdílnou realitu přežívání štěpů mezi Severní Amerikou a Evropou (pětileté cenzurované přežívání štěpů od dárců ECD 72,4 % vs. 81,1 %).9 Jednoznačné vysvětlení tohoto jevu nemáme. Lze zvažovat významnější polymorbiditu u severoamerických příjemců (v diskutované práci není studována), vliv využití prezervačních technik v zemích Eurotransplantu a možný vliv alokačního systému. Práce také nepochybně ukazuje na potřebu validace kritérií před jejich implementací v jednotlivých zemích.
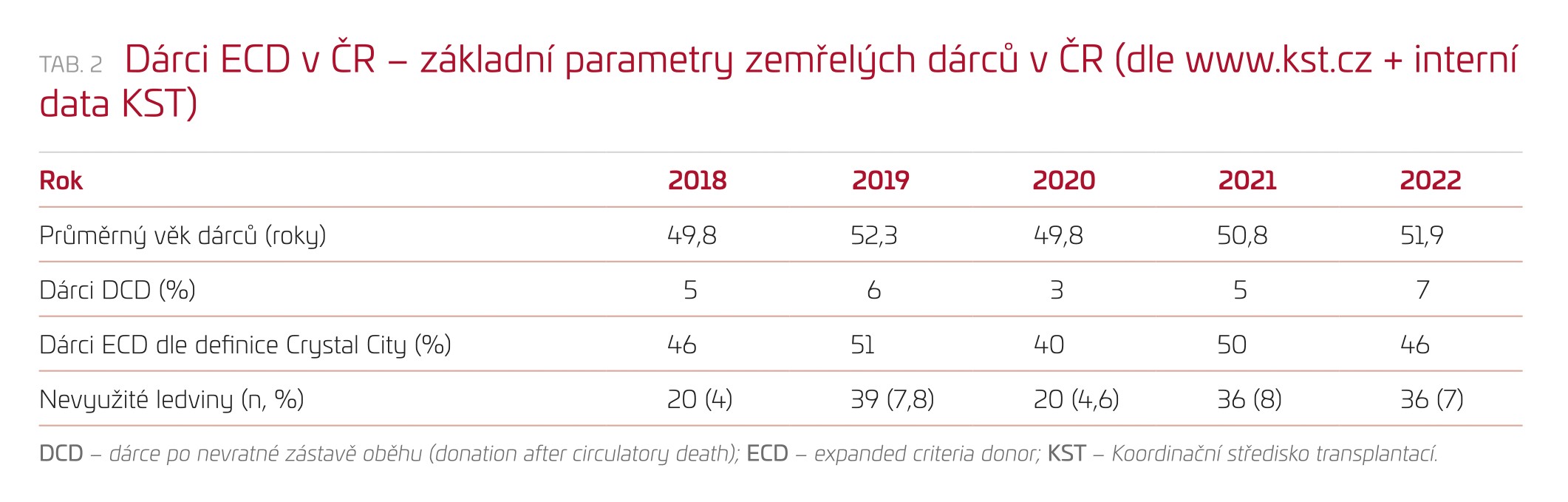
V České republice představují ledviny od dárců ECD téměř polovinu všech nabízených orgánů (tab. 2). Navzdory tomu je absolutní počet nevyužitých nabídek minimální v porovnání například s realitou ve Spojených státech.
Index KDRI/KDPI
S postupným růstem zkušeností se rozvíjela snaha o kvantitativní vyjádření dárcovských charakteristik spíše než dichotomické rozdělení užívané předchozí definicí z Crystal City. Dichotomické rozdělení dle těchto kritérií zařazuje jako ECD jakéhokoliv dárce staršího 60 let, jakkoliv může být dopad změn souvisejících se stárnutím ledvin na jejich funkci i ultrastrukturu značně heterogenní. Lze připustit, že ve skupině hodnocené jako SCD může za jistých okolností docházet k podhodnocení míry rizika budoucího selhání štěpu, a naopak u „zdravých“ dárců ECD může být toto riziko nadhodnocováno. Jako možné řešení tohoto problému byl ve Spojených státech vyvinut Kidney Donor Risk Index (KDRI). Index KDRI je kalkulován z 10 faktorů dárce (tab. 3) a udává v podstatě relativní riziko selhání štěpu ledviny po transplantaci od konkrétního zemřelého dárce ve srovnání s mediánem dárců (hodnoty 0,5–3,5).10 Kidney Donor Profile Index (KDPI) ukazuje percentil KDRI ve srovnání s předchozím rokem. Například dárce s KDPI 80 má index KDRI vyšší než 80 % dárců v předchozím roce. Výhodou je numerické vyjádření kvality štěpu, které řeší předchozí variabilitu kvality uvnitř skupiny SCD/ECD. Nadále však tento model nezahrnuje rizika vyplývající z akutního či periprocedurálního poškození ledvin či anatomických abnormalit.
Navzdory dostupným skórovacím systémům tedy zůstává úkolem klinika zhodnotit všechny dostupné informace a nespoléhat čistě jen na indexové a skórovací hodnoty.
Přínos dárcovské biopsie
Vedle klinických parametrů dárce může v rámci hodnocení posloužit vyšetření preimplantační biopsie ledviny. Míra změn souvisejících se stárnutím ledviny, tedy glomerulosklerózy, cévního postižení a intersticiální fibrózy, je obvykle dávána do souvislosti s horším výsledkem transplantace.11–13
Remuzziho protokol, který byl původně navržen pro indikaci transplantací jedné nebo dvou ledvin, je založen na semikvantitativním hodnocení glomerulosklerózy, tubulární atrofie, intersticiální fibrózy a arteriálního/arteriolárního zúžení. Při použití kritérií na základě rozsahu histologických změn od 0 do 12 byli Remuzzi a spol. schopni dosáhnout výsledků po duální transplantaci ledviny s použitím orgánů se závažnějšími chronickými histologickými změnami srovnatelných s orgány používanými při standardní transplantaci jedné ledviny.12 Vzorky pro vyšetření byly získávány v tomto případě punkční technikou. Praxí v České republice je obvykle získání vzorku povrchovou klínovitou excizí. V tomto případě míra glomerulosklerózy, tubulární atrofie a intersticiální fibrózy nemusí korelovat se vzorkem získaným z hlubokých částí kůry. Remuzziho skóre však nebylo validováno v nezávislé populaci a prediktivní schopnost tohoto specifického skóre pro výsledek transplantace a pro vyřazení ledviny zůstává nejasná.
Banffská klasifikace navrhla podobnou semikvantitativní analýzu histologických parametrů. Podrobněji však definovala vaskulární a různé další histologické abnormality. Banffský návrh se více zabývá technickými otázkami a otázkami histologické reproducibility, nepoužívá však bodový systém, ale celkovou závažnost histologických změn (mírná, středně závažná, závažná).14 Je zde zdůrazněna superiorita klínovitých biopsií oproti punkčním vzorkům (při snazší reprodukovatelnosti výsledku). Při hodnocení však biopsie vykazují velkou interindividuální variabilitu v hodnocení jednotlivých atributů včetně chronických cévních změn. Tato skupina již v závěru varuje před interpretací bioptického nálezu jako absolutního důvodu k odmítnutí ledviny.

Histologická klasifikace Maryland Aggregate Pathology Index (MAPI) je skórovací systém hodnotící faktory míry glomerulosklerózy, periglomerulární fibrózy, jizvení, hyalinózy arteriol a poměru tloušťky cévní stěny k lumen pomocí semikvantitativní stupnice s hodnotami 0–15.15 Hodnocení dle MAPI je limitováno náročností na analýzu obrazu a dostupnou techniku, a míra jeho využití je tedy dále omezená.
Histologické systémy klasifikace zatím nejsou vhodným nástrojem pro alokaci ledvin jako takovou. Při péči o příjemce a interpetaci dopadu transferu chronických změn jsou ale vhodnou pomůckou při posuzování vývoje funkce transplantované ledviny.
Alokace ledvin ECD
Alokační systém v ČR nikterak nezohledňuje marginalitu dárce ve smyslu výše uvedených charakteristik. Výjimku mohou tvořit lokální postupy v rámci alokace ledvin od dárců DCD v rámci jednotlivých center.
Naproti tomu alokační systém ve Spojených státech amerických již od zavedení definice dárce ECD taková kritéria zohledňuje. Cílem alokace je dosáhnout stavu „longevity match“. Tedy alokace cílená krom základních imunogenetických parametrů na dosažení maximální možné životnosti transplantovaného orgánu. Důsledkem je alokace ledvin ECD (s vyšším indexem KDPI) pro starší příjemce.
V zemích Eurotransplantu byl zahájen v lednu 1999 Eurotransplant Senior Program (ESP) s cílem dosáhnout efektivnějšího využití ledvin od starších dárců a nabídnout transplantaci starším pacientům. V rámci tohoto programu se v úzké geografické oblasti (Rakousko, Belgie, Německo, Lucembursko, Nizozemsko a Slovinsko) alokují ledviny od dárců ve věku ≥ 65 let příjemcům ve věku ≥ 65 let bez ohledu na shodu v HLA systému. Od zahájení ESP došlo jednak ke zvýšení utilizace ledvin od starších dárců a současně ke zkrácení čekací doby pro pacienty v ESP. Alokace na lokální úrovni vedla ke zkrácení doby studené ischemie (CIT) a k menšímu DGF, avšak byl zaznamenán vyšší výskyt rejekčních komplikací. Pětiletá analýza ESP ukázala, že přežívání pacientů nebylo alokací v rámci programu ESP negativně ovlivněno ve srovnání se standardní alokací.17
Zásadní otázkou zůstává, zda je správné odmítat ledviny s marginálními charakteristikami pro příjemce s vidinou „dočkání se“ lepší nabídky, kdy na jedné straně stojí jistota výsledků spojených s transplantací ledviny od dárce ECD oproti nejistotě, kdy se objeví jiná a lepší nabídka. V současnosti věříme, že navzdory zjištěnému rozdílu v přežívání štěpů od dárců ECD je vhodné tyto ledviny pro příjemce akceptovat s vědomím, že i protrahovaná doba čekání je dalším negativním prognostickým faktorem pro funkci štěpu. Při nabídce ledviny nestojíme před výběrem mezi orgánem SCD a ECD, ale mezi volbou transplantovat, či netransplantovat. Vzhledem k nadměrné morbiditě, mortalitě a nákladům spojeným s dialyzační léčbou by se omezené finanční zdroje poskytovatelů zdravotní péče měly zaměřit na maximální využití všech darovaných orgánů, aby se zabránilo plýtvání „marginálními“ orgány, které podle současných důkazů přinášejí prospěch v přežití většině (ne‑li všem) kandidátů transplantace ledviny zařazených na čekací listinu. Kvalifikované posouzení nabízeného orgánu lékařem kompetentním hodnotit všechny faktory stonání příjemce bude nadále jedním z nástrojů správné alokace ledviny.
Imunosuprese po transplantaci ledvin od dárců ECD
Starší práce ukazují na možnou vyšší imunogenitu ledvin od dárců ECD.17,18 Při hodnocení Eurotransplant Senior Programu lze spekulovat nad možným vlivem neuplatnění HLA matchování v rámci alokace těchto ledvin a při uplatnění HLA shody v systému alokace může přinést další výhodu.19 V pozdějších letech nebyl vyšší výskyt akutní rejekce u ledvin od dárců ECD prokázán.20 Volba imunosupresivního režimu by měla být primárně řízena imunologickým rizikem daným jinými faktory než statusem ECD/SCD (samotná podstata ECD imunologické riziko klinicky nedeterminuje). Aktuálně neexistují jednoznačné důkazy o tom, že by použití účinnější imunosuprese, jako jsou indukce thymoglobulinem a protokoly založené na sirolimu, poskytovalo nějakou výhodu oproti tradiční kombinaci takrolimu/cyklosporinu, mykofenolát mofetilu a prednisolonu.21 Logickou snahou je minimalizace toxicity kalcineurinových inhibitorů (CNI) při předpokládané vyšší vulnerabilitě ledvin ECD. Možnou alternativu může představovat bezkalcineurinový protokol s belataceptem. Studie BENEFIT‑EXT neprokázala rozdíl ve výskytu akutní rejekce či v přežívání štěpů v porovnání s cyklosporinovým režimem, přesto byl však zřejmý trend k pomalejšímu poklesu glomerulární filtrace ve skupině léčené belataceptem.22 Další možností je pozdní konverze na režim s belataceptem po stabilizaci funkce štěpu, kdy lze v šestém měsíci po transplantaci přerušit podávání CNI a nahradit jej belataceptem. V případě konverze na takový režim je prokázán pozitivní vliv na udržení vyšší glomerulární filtrace ve 24 měsících, avšak za cenu vyššího výskytu akutní rejekce.23 Takové režimy mohou být při zvážení imunologického rizika volbou u příjemců ledvin od dárců ECD.
Duální transplantace ledvin
Jedním z přístupů, jak zvýšit využití ledvin odebíraných od dárců ECD, je transplantace obou ledvin jednomu příjemci při předpokladu transplantace větší masy viabilních nefronů. Tato strategie se ukázala jako přínosná, ačkoliv v porovnání se standardními dárci vykazovala tato horší přežívání.24 V porovnání s dárci staršími 55 let se tento rozdíl stírá.25 Tyto observace nicméně nebyly systematické. V roce 2006 publikoval Remuzzi práci ukazující alokaci ledvin k duální transplantaci založenou na hodnocení preimplantační biopsie a ukázal, že lze dosáhnout přežívání štěpu srovnatelného s orgány od dárců SCD.12 Logicky je takový přístup spojen s větší operační zátěží a pochopitelně i vyšším rizikem chirurgických a urologických komplikací. V ČR je tento přístup využíván spíše v raritních případech.
Základem péče o příjemce ledvin od dárců ECD je však i nadále pečlivost v hodnocení všech dostupných informací o komorbiditách dárce, případně bioptického nálezu, to vše v kontextu detailního posouzení rizika a benefitu nabídky pro konkrétního příjemce.
Literatura
- Rosengard BR, Feng S, Alfrey EJ, et al. Report of the Crystal City meeting to maximize the use of organs recovered from the cadaver donor. Am J Transplant 2002;2:1–10.
- Metzger RA, Delmonico FL, Feng S, et al. Expanded criteria donors for kidney transplantation. Am J Transplant 2003;3(Suppl 4):114–125.
- Dahmane D, Audard V, Hiesse C. Retrospective follow‑up of transplantation of kidneys from ‘marginal’ donors. Kidney Int 2006;69:546–552.
- Merion RM, Ashby VB, Wolfe RA, et al. Deceased‑donor characteristics and the survival benefit of kidney transplantation. JAMA 2005;294:2726–2733.
- Pascual J, Zamora J, Pirsch JD. A systematic review of kidney transplantation from expanded criteria donors. Am J Kidney Dis 2008;52:553–586.
- Aubert O, Kamar N, Vernerey D, et al. Long term outcomes of transplantation using kidneys from expanded criteria donors: prospective, population based cohort study. BMJ 2015;351:h3557.
- Panchal H, Muskovich J, Patterson J, et al. Expanded criteria donor kidneys for retransplantation United Network for Organ Sharing update: proceed with caution. Transplant Int 2015;28:990–999.
- Patel K, Brotherton A, Chaudhry D, et al. All Expanded Criteria Donor Kidneys are Equal But are Some More Equal Than Others? A Population‑Cohort Analysis of UK Transplant Registry Data. Transpl Int 2023;36:11421.
- Querard AH, Foucher Y, Combescure C, et al. Comparison of survival outcomes between Expanded Criteria Donor and Standard Criteria Donor kidney transplant recipients: a systematic review and meta‑analysis. Transplant Int 2016;29:403–415.
- Rao PS, Schaubel DE, Guidinger MK, et al. A comprehensive risk quantification score for deceased donor kidneys: the kidney donor risk index. Transplantation 2009;88:231–236.
- Cockfield SM, Moore RB, Todd G, et al. The prognostic utility of deceased donor implantation biopsy in determining function and graft survival after kidney transplantation. Transplantation 2010;89: 559–566.
- Remuzzi G, Cravedi P, Perna A, et al. Long‑term outcome of renal transplantation from older donors. N Engl J Med 2006;354:343–352.
- Anglicheau D, Loupy A, Lefaucheur C, et al. A simple clinico‑histopathological composite scoring system is highly predictive of graft outcomes in marginal donors. Am J Transplant 2008;8:2325–2334.
- Liapis H, Gaut JP, Klein C, et al. Banff Histopathological Consensus Criteria for Preimplantation Kidney Biopsies. Am J Transplant 2017;17:140–150.
- Munivenkatappa RB, Schweitzer EJ, Papadimitriou JC, et al. The Maryland aggregate pathology index: a deceased donor kidney biopsy scoring system for predicting graft failure. Am J Transplant 2008;8:2316–2324.
- Organ Procurement and Transplantation Network. A Guide to Calculating and Interpreting the Kidney Donor Profile Index (KDPI) (PDF). (2020). Dostupné online: https://optn.transplant.hrsa.gov/media/1512/guide_to_calculating_interpreting_kdpi.pdf
- Frei U, Noeldeke J, Machold‑Fabrizii V, et al. Prospective age‑matching in elderly kidney transplant recipients – a 5‑year analysis of the Eurotransplant Senior Program. Am J Transplant 2008;8:50–57.
- Fijter JW, Mallat MJK, Doxiadis IIN, et al. Increased immunogenicity and cause of graft loss of old donor kidneys. J Am Soc Nephrol 2001;12:1538–1546.
- de Fijter J, Dreyer G, Mallat M, et al. Eurotransplant Senior DR‑compatible Program (ESDP) Study Group. A paired‑kidney allocation study found superior survival with HLA‑DR compatible kidney transplants in the Eurotransplant Senior Program. Kidney Int 2023;104:552–561.
- Diet C, Audard V, Roudot‑Thoraval F, et al. Immunological risk in recipients of kidney transplants from extended criteria donors. Nephrol Dial Transplant 2010;25:2745–2753.
- Montero N, Rodrigo E, Crespo M, et al. The use of lymphocyte‑depleting antibodies in specific populations of kidney transplant recipients: A systematic review and meta‑analysis. Transplant Rev (Orlando) 2023;37:100795.
- Durrbach A, Pestana JM, Florman S, et al. Long‑Term Outcomes in Belatacept‑ Versus Cyclosporine‑Treated Recipients of Extended Criteria Donor Kidneys: Final Results From BENEFIT‑EXT, a Phase III Randomized Study. Am J Transplant 2016;16:3192–3201.
- Budde K, Prashar R, Haller H, et al. Conversion from Calcineurin Inhibitor‑ to Belatacept‑Based Maintenance Immunosuppression in Renal Transplant Recipients: A Randomized Phase 3b Trial. J Am Soc Nephrol 2021;32:3252–3264.
- Bunnapradist S, Gritsch HA, Peng A, et al. Dual kidneys from marginal adult donors as a source for cadaveric renal transplantation in the United States. J Am Soc Nephrol 2003;14:1031–1036.
- Gill J, Cho YW, Danovitch GM, et al. Outcomes of dual adult kidney transplants in the United States: an analysis of the OPTN/UNOS database. Transplantation 2008;85:62–68.
- Kategorie: Přehledové články
- Klíčová slova: biopsie; dárce ECD ; transplantace ledvin