Rituximab a mepolizumab v léčbě eozinofilní granulomatózy s polyangiitidou u pacienta trpícího závažným multiorgánovým postižením
Klíčová slova: akutní poškození ledvin – ANCA asociovaná vaskulitida – eozinofilní granulomatóza s polyangiitidou – imunosupresivní léčba – srdeční selhání
Kazuistika
Dvaatřicetiletý pacient s anamnézou rok trvajícího perzistujícího bronchiálního astmatu byl přijat na naše pracoviště pro několik dní progredující dušnost, kašel, akutní poškození ledvin (AKI) a narůstající zánětlivou aktivitu nereagující na antibiotickou terapii.
Pacient byl rok léčen pro asthma bronchiale, v anamnéze udával alergii na penicilin (kožní projevy), jinak bez sledovaných onemocnění, rodinná anamnéza bez pozoruhodností, dlouholetý exkuřák, v medikaci kromě inhalačních kortikoidů a bronchodilatancií bez další pravidelné terapie.
Pacient popisoval nevýrazné, asi dva měsíce trvající, migrující myalgie a občasné přechodné zhoršení dechových obtíží. Týden před hospitalizací se objevil neproduktivní kašel, v úvodu netypické bolesti na hrudi a progredující potíže s dušností. Praktickým lékařem byla nasazena empiricky antibiotika (cefprozil) a po několika dnech pro progresi obtíží bylo doplněno laboratorní vyšetření krve s nálezem elevace hodnot C‑reaktivního proteinu (CRP) 57 mg/l, leukocytózy 23 tisíc, kreatininu 155 µmol/l a s výsledky byl pacient odeslán na plicní kliniku Fakultní nemocnice Ostrava k došetření a léčbě. Vstupně byl doplněn rentgenový snímek plic s nálezem pneumonických změn vpravo (obr. 1), byla vyloučena virová infekce včetně covidu‑19 a následující den, kdy došlo k progresi stavu klinicky (dušnost až ortopnoe, potřeba oxygenoterapie s nízkým průtokem) i laboratorně (CRP 116 mg/l, kreatinin 191 µmol/l, leukocytóza 25 tisíc s 52,8 % eozinofilů, absolutně 13,2 × 109/l) byl pacient přeložen na interní jednotku intenzivní péče (JIP).
Diagnosticky s ohledem na podezření na eozinofilní granulomatózu s polyangiitidou (EGPA) jsme doplnili výpočetní tomografii s vysokým rozlišením (high resolution computed tomography, HRCT) plic a hlavy (viditelné oboustranné pneumonické infiltrativní změny, pansinusitida, malé pleurální i perikardiální výpotky), echokardiografii (dysfunkce levé komory s ejekční frakcí levé komory [EF LK] 35 % a suspektním trombem v hrotu levé komory) a imunologické vyšetření, které bylo negativní (anti‑PR3/proteináza 3, anti‑MPO/myeloperoxidáza, anti‑GBM / protilátky proti glomerulární bazální membráně). Hodnoty komplementu byly normální, signifikantně zvýšené byly sérové koncentrace protilátek imunoglobulinu E (IgE) (701 kU/l, norma v laboratoři do 158 kU/l). V dalších dnech s ohledem na echokardiografický nález a vysoké hodnoty N‑terminálního fragmentu natriuretického propeptidu typu B (NT‑proBNP) převyšující 35 tisíc ng/l byla doplněna magnetická rezonance (MR) srdce s potvrzením trombu v levé komoře a nálezem pankarditidy, s odstupem provedená koronarografie byla negativní. Den po přijetí na JIP dosáhla hodnota kreatininu 263 µmol/l, poměr albumin/kreatinin (ACR) v moči 22,8 g/mol, byla zaznamenána mikroskopická hematurie a nečetné hyalinní válce.
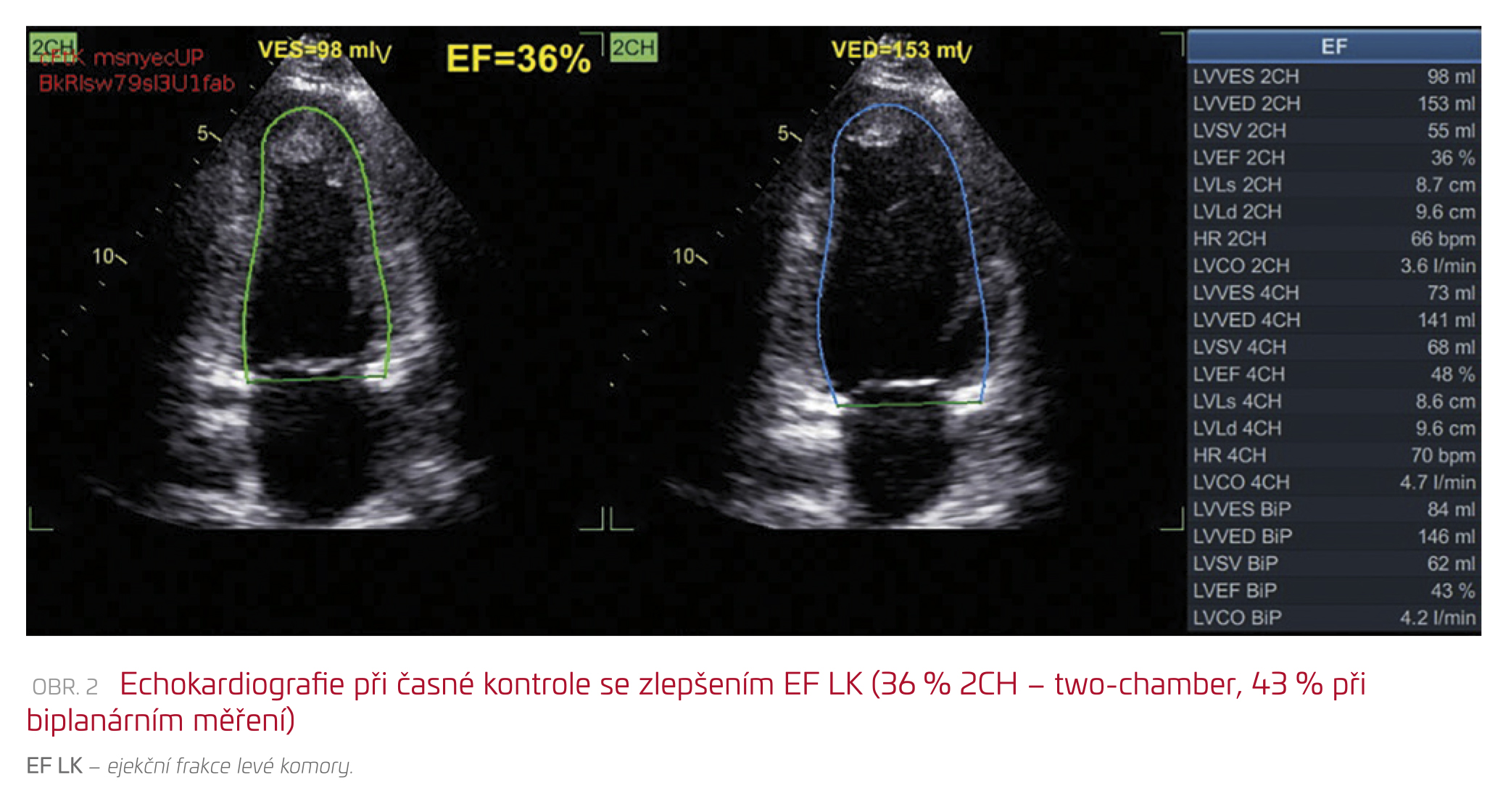
S ohledem na vysoce pravděpodobnou EGPA, prognosticky závažné multiorgánové postižení včetně srdečního selhávání a AKI (skóre FFS [Five Factor Score] 2) a také rychlou progresi stavu v posledních dnech a hodinách jsme terapii zahájili již v den přijetí na interní JIP (pátek 19. 8. 2022). V rámci indukční terapie jsme podali 1 000 mg metylprednisolonu (celkem po dobu tří dnů) a rituximab v dávce 375 mg/m2, celkově pak ve čtyřech dávkách v týdenních intervalech. Klinicky byl pacient již následující den (sobota 20. 8. 2022) výrazně subjektivně i objektivně zlepšen, bez potřeby oxygenoterapie, normotenzní. Laboratorně došlo po 48 hodinách od zahájení terapie k normalizaci počtu leukocytů, eozinofily již byly nulové, hodnoty CRP se normalizovaly po pěti dnech od přijetí a při propuštění po deseti dnech hospitalizace byla hodnota kreatininu 182 µmol/l (nejvyšší hodnota 263 µmol/l druhý den hospitalizace), přetrvává mikroskopická hematurie a albuminurie (ACR 57,4 g/mol), při kontrolní echokardiografii provedené při propuštění bylo již pozorováno zlepšení ejekční frakce levé komory z 35 % na 43 % (obr. 2). Biopsii ledviny jsme neprovedli v den přijetí (pátek, ortopnoe), ale až v pondělí 22. 8. 2022, vzorek byl malý, prokázal však nekrotizující vaskulitidu s jedním srpkem (1/4), eozinofilní materiál v tubulech, jinak eozinofilní infiltráty zachyceny nebyly (v době biopsie již byly nulové eozinofily v krvi po indukční imunosupresi). V imunofluorescenci glomerulus nebyl zastižen.
Léčebně jsme kromě indukční terapie kortikoidy (dávky dle doporučení KDIGO [Kidney Disease: Improving Global Outcomes] 2021) a rituximabem v „lymfomovém“ protokolu (4× 375 mg/m2 po týdnu) postupně eskalovali terapii srdečního selhávání (sakubitril/valsartan, dapagliflozin, metoprolol, spironolakton, furosemid) a pro trombus v levé komoře jsme nastavili antikoagulační terapii warfarinem. Další průběh již byl klinicky i laboratorně příznivý. Subjektivně byl pacient bez potíží, systolická dysfunkce levé komory se normalizovala po třech měsících terapie, přetrvávala diastolická dysfunkce I. stupně, funkce ledvin se během týdnů postupně zlepšila a přetrvávala na úrovni chronického onemocnění ledvin (CKD) stadia G2–3a (kreatinin 125–141 µmol/l, odhadovaná glomerulární filtrace [eGFR] 0,94–1,05 ml/s/1,73 m2), mikroskopická hematurie nebyla přítomna, ACR 5,4 g/mol, ANCA protilátky (protilátky proti cytoplazmě neutrofilů) nebyly pozitivní ani při průběžných vyšetřeních (imunofluorescenčně ani enzymatickou metodou).
Po šesti měsících od stanovení diagnózy onemocnění přetrvávala remise onemocnění a kompletní deplece CD19 lymfocytů. Po domluvě s pneumology jsme po schválení žádosti pojišťovnou přešli na udržovací imunosupresivní terapii mepolizumabem (monoklonální protilátka proti interleukinu 5). Léčba probíhá subkutánní aplikací 300 mg mepolizumabu každé čtyři týdny a je tolerována dobře. Pokračuje léčba prednisonem v dávce 5 mg, z další medikace pokračujeme v podávání maximálních dávek kombinace sakubitril/valsartan, dapagliflozinu, metoprololu a atorvastatinu, warfarinu zvykle, inhalační léčbou astmatu a antibiotickou profylaxí, diuretika byla vysazena.
Po 12 měsících léčby je pacient subjektivně bez potíží, normotenzní, terapii toleruje dobře, z komplikací se vyskytla pouze jedenkrát slizniční mykotická infekce, funkce ledvin stagnuje s eGFR kolem 1,0 ml/s/1,73 m2 (poslední eGFR 1,13 ml/s/1,73 m2, kreatinin v séru 121 µmol/l), ACR je 5,4 g/mol a mikroskopická hematurie není přítomna. Dysfunkce levé komory se upravila (EF LK 55 %), kontrolní magnetická rezonance srdce neprokázala aktivitu onemocnění a poslední hodnota NT‑proBNP je 424 ng/l.
Komentář
Literatura
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013;65:1–11.
- Emmi G, Bettiol A, Gelain E, et al. Evidence‑Based Guideline for the diagnosis and management of eosinophilic granulomatosis with polyangiitis. Nat Rev Rheumatol 2023;19:378–393.
- Guillevin L, Pagnoux C, Seror R, et al. The Five‑Factor Score Revisited: Assessment of Prognoses of Systemic Necrotizing Vasculitides Based on the French Vasculitis Study Group (FVSG) Cohort. Medicine 2011;90:19–27.
- Trivioli G, Terrier B, Vaglio A. Eosinophilic granulomatosis with polyangiitis: understanding the disease and its management. Rheumatology (Oxford) 2020;59(Suppl 3):iii84–iii94.
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int 2021;100: S1–S276.
- Hellmich B, Sanchez‑Alamo B, Schirmer JH, et al. EULAR recommendations for the management of ANCA‑associated vasculitis: 2022 update. Ann Rheum Dis 2023 Mar 16:ard‑2022‑223764. doi: 10.1136/ard‑2022‑223764. Epub ahead of print.
- Kategorie: Kazuistiky
- Klíčová slova: akutní poškození ledvin; ANCA asociovaná vaskulitida; eozinofilní granulomatóza s polyangiitidou; imunosupresivní léčba; srdeční selhání
Eozinofilní granulomatóza s polyangiitidou (dříve nazývána syndrom Churgův–Straussové) je vzácné onemocnění s udávanou incidencí 0,5–4,2 případu na milion obyvatel, jež patří mezi vaskulitidy malých cév, spolu s GPA (granulomatóza s polyangiitidou) a mikroskopickou polyangiitidou ji řadíme mezi ANCA asociované vaskulitidy.1 Prevalence je obdobná u žen i mužů a průměrný věk při stanovení diagnózy choroby je 50 let.2
Diagnózu zvažujeme především u pacientů s bronchiálním astmatem, rinosinusitidou, významnou eozinofilií v periferní krvi a případně s postižením dalších orgánů (srdce, ledviny, kůže, zažívací trakt, periferní a centrální nervový systém). S ohledem na absenci jednoznačných diagnostických kritérií u tohoto onemocnění s velmi heterogenní klinickou prezentací je diagnóza stanovena po komplexním, často multioborovém zhodnocení všech klinických, laboratorních a případně i histologických nálezů. Dostupná kritéria American College of Rheumatology (ACR, 1990) / European Alliance of Associations for Rheumatology (EULAR, 2022) jsou určena především ke klasifikaci onemocnění a stanovují specificitu a senzitivitu pro jednotlivé typy vaskulitidy. Skóre FFS z roku 1996 je používáno při stanovení diagnózy ke zhodnocení rizika úmrtí a zohledňuje hlavní nepříznivé faktory (AKI s koncentrací kreatininu v séru 140 µmol/l a více, proteinurie nad 1 g/den, kardiomyopatie, postižení zažívacího traktu a postižení centrálního nervového systému). I přes aktualizaci kritérií v roce 2011 se zohledněním vyššího věku (nad 65 let) a postižením horních cest dýchacích (ear‑nose‑throat symptoms, ENT) jako nepříznivých známek jsou ve studiích používána především původní kritéria.3 Ve studiích i běžné praxi používané Birminghamské skóre (Birmingham Vasculitis Activity Score, BVAS) je užíváno i u pacientů s EGPA.
ANCA protilátky jsou přítomny u 30–40 % pacientů, ve většině případů se jedná o protilátky proti myeloperoxidáze (MPO).4 ANCA negativní pacienti mají častěji kardiovaskulární postižení, což se zdá být hlavní příčinou jejich horší prognózy při porovnání s ANCA pozitivními pacienty. Pacienti s renálním postižením jsou téměř vždy ANCA pozitivní. V popisované kazuistice je však u pacienta raritní ANCA negativita přes zjevnou nekrotizující glomerulonefritidu, a to i při opakovaném testování. Pacienti s protilátkami proti proteináze 3 mají častěji plicní infiltráty a kožní projevy, méně často pak astma a eozinofilii. Genetické studie ukázaly odlišnosti u ANCA pozitivních a negativních pacientů s možným budoucím dopadem na volbu optimální léčby dle typu nalezených mutací.
Léčba ANCA asociovaných vaskulitid včetně EGPA je popsána v doporučeních KDIGO z roku 2021 nebo nověji v doporučeních EULAR z roku 2022 a poznatky pro praxi je možno/nutno čerpat i z výsledků publikovaných výzkumů po zhodnocení jejich relevance.5,6 Od roku 2018 funguje evropská skupina pro studium EGPA a s její podporou byla skupinou expertů nedávno (květen 2023) publikována v Nature Reviews Rheumatology doporučení a stanoviska zohledňující aktuální poznatky.2 Pro zhodnocení léčby je zásadní závažnost stavu a orgánové postižení.
Základem indukční terapie je vždy kortikoterapie (pulsní léčba s přechodem na perorální terapii) a u pacientů se závažným postižením (skóre FFS 1 více) pak terapie cyklofosfamidem, který je upřednostněn z důvodu dostupnosti dat podporujících tuto léčbu u pacientů s EGPA. Optimální délka léčby není jasná, ale pulsní léčbu cyklofosfamidem je obecně doporučeno podávat delší dobu než u jiných ANCA vaskulitid, minimálně šest měsíců, při pomalejším dosažení remise až 12 měsíců, a to z důvodu vyšší frekvence relapsů. Léčba rituximabem se zdá stejně efektivní pro dosažení remise, a to jak u pacientů ANCA pozitivních, tak i negativních. Mepolizumab (anti‑IL‑5 monoklonální protilátka) byl efektivní v indukci relabujících nebo refrakterních lehkých forem onemocnění (studie MIRRA), a to opět u ANCA pozitivních i negativních pacientů.
Pro udržovací léčbu máme dle zmíněných recentních doporučení k výběru rituximab, mepolizumab nebo antirevmatické léky modifikující chorobu (disease‑modifying antirheumatic drugs, DMARD), azathioprin zde uváděn není. Pro pacienty se závažným onemocněním je doporučen rituximab (500 mg každých šest měsíců), ke zvážení je i mepolizumab. S ohledem na absenci silných dat ze studií jsou v běžné praxi používány i DMARD.
V popisované kazuistice jsou přítomny jak typické rysy onemocnění (astma, pansinusitida, eozinofilie, postižení srdce a ledvin), tak i atypické projevy, jako je ANCA negativita při přítomném renálním postižení. Léčba s použitím rituximabu v indukci u mladého pacienta ve fertilním věku vedla k rychlé remisi včetně úpravy orgánových funkcí, především pak ke zmírnění vstupně závažné dysfunkce levé komory a započatá terapie mepolizumabem má dobrou toleranci i efektivitu.