Hemodialýza zachraňuje život, ale je nefyziologická
SOUHRN
Hemodialyzační procedura je intermitentní a eliminace katabolitů je neúplná. Přínos dialýzy je kompromisem mezi prodloužením života a komplikacemi indukovanými dialýzou.
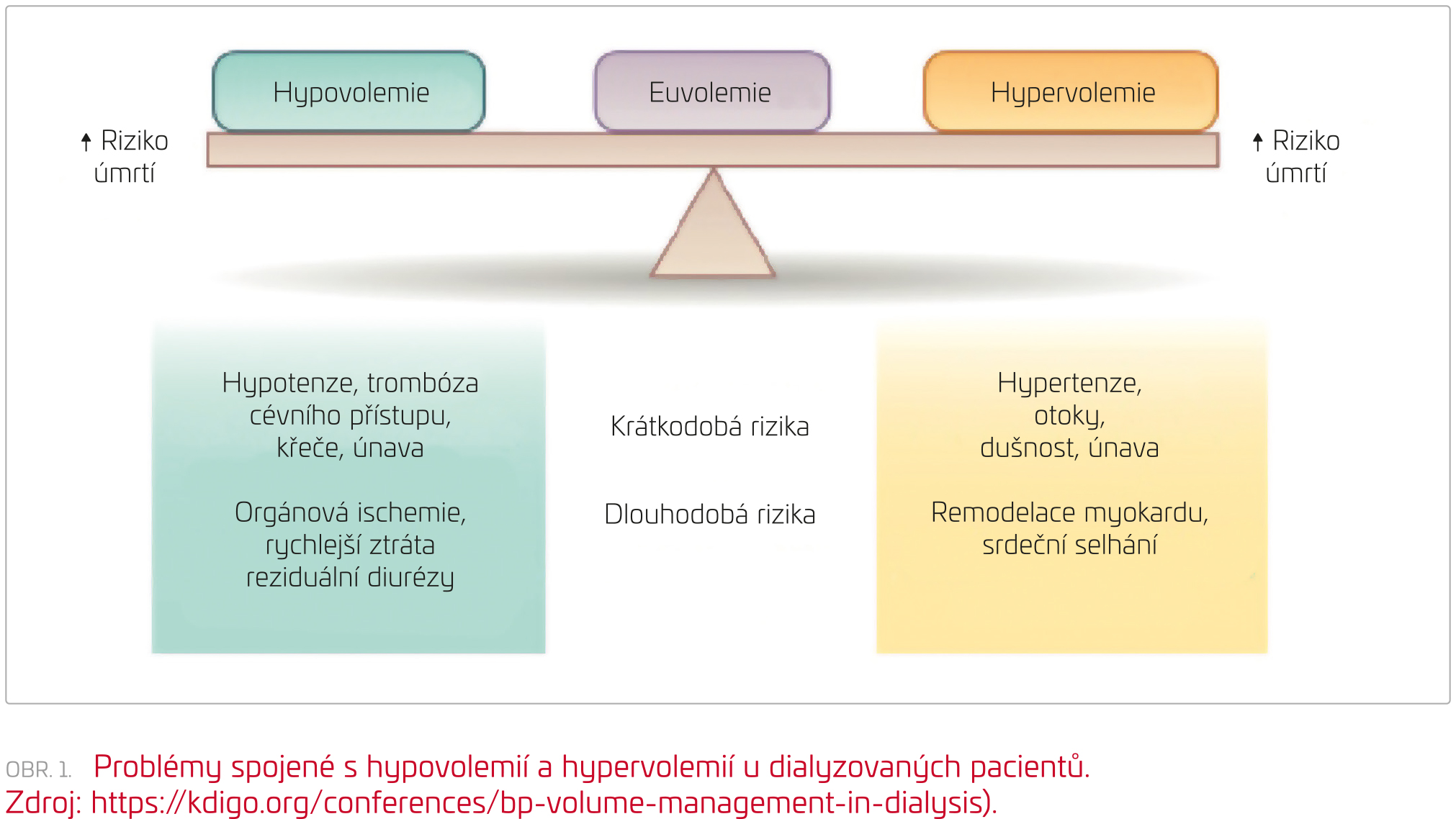
K závažným akutním komplikacím patří intradialyzační hypotenze (IDH), která je podmíněna nerovnováhou mezi snížením intravaskulárního objemu podmíněným ultrafiltrací a kompenzatorními regulačními mechanismy (zvýšení srdečního výdeje a zvýšení periferní cévní rezistence). Nepřiměřená ultrafiltrace, resp. ultrafiltrační rychlost, má i chronické důsledky ve smyslu poškození, jmenovitě poškození srdce, mozku, ledvin a dalších orgánů.
Hemodynamickou stabilitu významně ovlivňuje koncentrace sodíku v dialyzačním roztoku. Pokles koncentrace sodíku v krvi během dialýzy zvyšuje riziko intradialyzační hypotenze. Naopak pokud je sodíková bilance během dialýzy pozitivní, zvyšuje se mezidialyzační hmotnostní přírůstek, ale nejen to. Celkové množství sodíku v organismu je vyšší, než bychom usuzovali z koncentrace v extracelulární tekutině, resp. v krvi. Prokázalo se, že sodík přijatý do organismu, resp. v organismu retinovaný, se ukládá v osmoticky neaktivní formě do cév, kůže a svalů, což samo o sobě má negativní dopad.
Při znalosti, že pacienti mají svůj individuální sodíkový „set‑point“, tj. jejich natremie je v čase poměrně stabilní, je nyní trendem tzv. izonatremická dialýza. Při ní zůstane koncentrace sodíku v krvi stejná, avšak sodík z organismu se odstraní konvekcí, resp. ultrafiltrací. Tím se umožní, aby ve tkáních deponovaný sodík byl uvolněn. Předpokladem pro snížení sodíkové zátěže organismu je snížený přívod soli v mezidialyzačním období.
Nový „sodíkový modul“ umožňuje průběžně upravovat koncentraci sodíku v dialyzačním roztoku, a tedy izonatremickou dialýzu zajistit. Tato nová technologická inovace je další z možností, kterými lze nefyziologičnost dialýzy minimálně teoreticky zmírnit.
KLÍČOVÁ SLOVA: akumulace sodíku ve tkáních – hemodialýza – hemodialyzační nestabilita – sodíkový modul – sodík v dialyzačním roztoku – ultrafiltrace – ultrafiltrační rychlost
Hemodialyzační procedura je intermitentní a eliminace katabolitů je neúplná. Retence tekutin, zejména u anurických pacientů, je nevyhnutelná a vede k převodnění, které je třeba korigovat (odstranit) během několika hodin. Terapeutické okno je úzké, neboť převodnění i hemodynamická nestabilita jsou rizikové.
Dialýza je tedy určitým kompromisem mezi velkým přínosem pro pacienta a současně tím, že v důsledku své nefyziologičnosti může vyvolat (a vyvolává) komplikace.1,2
Důsledky nefyziologičnosti dialýzy jsou nejen akutní, ale i dlouhodobé. Bylo přesvědčivě dokumentováno poškození srdce („myocardial stunning“).3–5 Poprvé popsal důsledek postdialyzačního „poškození“ myokardu McIntyre. Přesvědčivě doložil, že průtok krve myokardem během dialýzy klesá. Pokles do 30 % není významný, avšak vyšší pokles je spojen s poklesem kontraktility myokardu o více než 10 %. S rozvojem tzv. myocardial stunning jsou spojeny především velká ultrafiltrační rychlost a hypertenze (tab. 1).
Je tedy patrné, že čím vyšší ultrafiltrace, tím větší riziko vzniku poškození myokardu po dialýze; současně platí, že čím vyšší pokles krevního tlaku během dialýzy, tím je riziko rovněž vyšší. Přitom však míra rizika je více spojena s ultrafiltrací a pro ultrafiltraci 2 litry během dialýzy je riziko zvýšené dokonce až více než 25krát! Naopak, pokles systolického tlaku o 30 mm Hg je svým rizikem spojeným se „stunning“ myokardu srovnatelné s ultrafiltrací 1 000 ml za dialýzu. V každém případě data ukazují, že dialýza je vlastně kardiotoxická a že čím více je dialýza z hlediska volumových a tlakových změn nefyziologická, tím je kardiotoxicita vyšší.4
Nedávná konference KDIGO (Kidney disease: improving global outcomes) zaměřená na „dialyzační stres“ uvádí, že pacienti, u kterých během dialýzy dojde k poškození myokardu ve smyslu „stunningu“, mají v horizontu jednoho roku o 20 % vyšší mortalitu ve srovnání s pacienty, u kterých tento fenomén nenastane (viz https://kdigo.org/c...ent‑in‑dialysis).
Analogicky byla doložena intradialyzační mozková hypoperfuze, dokonce i se snížením kognitivních funkcí.6,7 Dialyzovaní pacienti mají porušenou mozkovou autoregulaci vzhledem k cévnímu poškození, které je dáno koexistujícími nemocemi: diabetes mellitus, hypertenze, ateroskleróza, vyšší věk, zánět a cévní kalcifikace v důsledku poruchy fosfokalciového metabolismu (mediokalcinóza). Takto podmíněné cévní poškození zhoršuje schopnost regulovat cévní tonus (tzv. stiffening cév, ztráta elasticity a snížení poddajnosti). Současně dochází (může docházet) během dialýzy k depleci intravaskulární tekutiny a ke snížení osmolality plazmy, což vede k úbytku intracelulární tekutiny v buňkách centrálního nervového systému (CNS). Mozková hypoperfuze je provázena ischemií, která vede k zánětlivé a další reakci (lokální acidóza, tvorba volných kyslíkových radikálů, aktivace katabolických enzymů, s vyústěním do buněčného poškození až buněčné smrti).8
Ischemické důsledky postihují i další orgány (střevo, ledviny a další). V současné době jsou tyto důsledky shrnovány pod širší pojem (zahrnující více mechanismů než jen ty, které jsou podmíněny hemodynamickou nestabilitou) dialýzou indukovaný stres (dialysis induced stress).9
Převodnění: role vody i sodíku
Převodnění je obvykle spojeno se zvýšením krevního tlaku. Hypertenze (napsáno zjednodušeně) je dána expanzí extracelulární tekutiny a ztrátou elasticity tepen („stiffening“) podmíněnou zejména poruchou fosfokalciového metabolismu.
V současné době, kdy dialyzovaní pacienti jsou vyššího věku a mají četné komorbidity, je často nutné k léčbě hypertenze použít farmaka, antihypertenziva. Ta jsou však nekompletním, a někdy i nefunkčním řešením. V první řadě musí být normalizován intravaskulární objem tekutin, resp. nesmí trvat převodnění.
Ultrafiltrace při hemodialýze (stejně tak jako při online hemodiafiltraci) může odstranit tekutiny, avšak normalizace krevního tlaku nastává až po delším čase (několik týdnů), tato skutečnost se označuje jako „lag‑period“10 a je důležité ji v kontextu o současných znalostech sodíkové homeostázy znovu připomenout. Podmínkou normalizace krevního tlaku je totiž úprava nejen nadměrného množství tekutin, ale i úprava, resp. odstranění retinovaného sodíku. V praxi nás tedy nesmí mást, že sice snižujeme hyperhydrataci, ale vysoký krevní tlak nadále po určitou dobu zůstává. V tom případě je nutné se cíleně na sodík zaměřit.
Dialyzovaným pacientům často připomínáme nutnost omezení tekutin. Pokud však současně nevysvětlíme nutnost omezit/vynechat přívod soli ve stravě, je naše doporučení neúčinné.11 Pacient má při pokračujícím příjmu soli (a omezeném množství tekutin) extrémní žízeň a naši radu, resp. náš požadavek restrikce tekutin nemůže splnit. Víme, že doporučené maximální množství soli přijaté potravou je 5 gramů, tj. 2 gramy sodíku (85 mmol/l) za den.
Ultrafiltrace při hemodialýze
Jak uvedeno, dialýza je prakticky vždy spojena s potřebou odstranění tekutin, tedy s ultrafiltrací. Je však časté, že ultrafiltrace není ideální. Buď je příliš nízká, a potom přetrvává převodnění a jeho důsledky, nebo je naopak příliš vysoká. Hlavním důsledkem příliš vysoké ultrafiltrace (resp. ultrafiltrační rychlosti) je hemodynamická nestabilita (obr. 1).
Podle (starší) literatury postihuje až 20–30 % hemodialyzačních procedur. Dominujícím, ale nikoliv jediným důsledkem je symptomatická hypotenze (viz dále). Reálný skutečný počet je na našich pracovištích jistě nižší, přesná data ale nemáme. Sars a van der Sande uvádějí v práci z roku 2020 incidenci 10–12 % hemodialyzačních procedur,12 dokument konference KDIGO z téhož roku udává výskyt mezi 15 a 50 % a doplňuje, že daný rozptyl je podmíněn i rozdílnou definicí.13
Důležitým faktorem, který sám o sobě zasahuje proti intravaskulární hypovolemii, je zpětné doplňování tekutin během ultrafiltrace (tzv. refill). Hlavní hnací silou pro refill je hydrostatický tlak v intersticiu. Čím více je pacient převodněn, tím je tento tlak větší a tím snáze přestupuje tekutina z intersticia do cév. Na tomto principu jsou založeny tzv. ultrafiltrační profily. Refill je však podmíněn i koncentrací bílkovin (albuminu) v krvi, při hypoalbuminemii (malnutrici) je refill malý, pokud vůbec nastává. To jsou ty situace, kdy pacient má při ultrafiltraci hypotenzi, ale otoky dolních končetin nadále zůstávají. Další velmi důležitou okolností je sodíkový gradient mezi plazmatickou tekutinou a dialyzačním roztokem. Koncentrace sodíku v dialyzátu, které jsou nižší než koncentrace v krvi, způsobí mechanismem difuze (přechod sodíku z krve po koncentračním spádu do dialyzátu) hyponatremii. Pak chybí další hnací síla pro zpětné doplnění tekutin z intersticia do cév. Výslednou hemodynamickou situaci ovlivní i léky, zejména s antihypertenzním účinkem (jejich podání při převodnění je často neúčinné, a naopak, účinek se plně projeví při odstranění retinované tekutiny).14 K hemodynamické nestabilitě přispívá i anémie, malnutrice (hypalbuminemie, zejména spojená se zánětem) a pochopitelně zásadní důležitost má koncentrace sodíku v krvi i dialyzátu.
Ultrafiltrační rychlost (UFR) a ultrafiltrace není totéž. Dané množství tekutin lze odstranit i s menší ultrafiltrační rychlostí, pokud se zkrátí mezidialyzační interval či prodlouží délka dialyzační procedury. Pro praxi je užitečné vědět, že pokud ultrafiltrační rychlost převýší 10 ml/kg/h, významně se zhoršuje prognóza pacienta (při UFR nad 13 ml/kg/h až o téměř 60 %).15
Hypotenze během dialýzy
Hypotenze během dialýzy, resp. intradialyzační hypotenze (IDH) je podle guidelines KDIGO z roku 2005, citovaných v dokumentu KDIGO z roku 2020,13 definována jako pokles systolického tlaku o 20 a více mm Hg nebo jako pokles středního krevního tlaku o 10 a více mm Hg spolu se symptomy (křeče, bolesti hlavy, světloplachost, zvracení nebo bolesti na hrudi či nutnost intervence – tj. redukce ultrafiltrace nebo doplnění tekutin).
Situace je však komplikována existencí dalších definic IDH. K nim patří například jakýkoliv pokles systolického krevního tlaku, který vyžaduje intervenci typu doplnění tekutin, případně koncentrovaného NaCl, zpomalení či přerušení ultrafiltrace nebo zpomalení otáček krevní pumpy. Další definice definuje konkrétní pokles krevního tlaku, přitom tento pokles může být různý, o 20 či 30 či 40 mm Hg. Důležitá definice se opírá o nejnižší naměřenou hodnotu systolického tlaku během hemodialýzy, opět i zde je hranice různá (90, 95 či 100 mm Hg). Je doložen minimální systolický krevní tlak nižší než 90 mm Hg, u pacientů s predialyzačním krevním tlakem vyšším než 160 mm Hg je spojen se zvýšenou mortalitou.13
Právě spojení mezi rizikem mortality a hodnotou nejnižšího systolického TK během HD méně než 90 mm Hg vedlo k nově navržené definici dle KDIGO:13 jakýkoliv pokles systolického krevního tlaku nebo nejnižší systolický krevní tlak méně než 90 mm Hg má vést k opakování měření krevního tlaku a přehodnocení „managementu“ ultrafiltrace, resp. stanovené „suché“ hmotnosti pacienta.
V multicentrické americké studii s více než 4 300 pacienty, u kterých v době sledování bylo provedeno více než 785 tisíc dialyzačních procedur, bylo dokumentováno důležité spojení času (doby), ve kterém během hemodialýzy nastane hypotenze s klinickými parametry, a mortalitou. Za „časný“ nástup hypotenze byl považován vznik IDH v první polovině dialýzy. Ve srovnání s výskytem IDH v druhé polovině dialýzy byl významně víc rizikový z hlediska dlouhodobých důsledků.17
Hypotenze při dialýze je spojena s akutními, ale i následnými komplikacemi (vyšší riziko trombózy arteriovenózní fistule, vyšší riziko mezenteriální ischemie, ischemizace orgánů (srdce, mozek, ledviny – rychlejší ztráta reziduální diurézy), akutní a později i chronické kardiovaskulární komplikace, vyšší počet hospitalizací, riziko úmrtí.
Je velmi důležité, abychom intradialyzační hypotenzi předcházeli. Dříve oblíbené „profilování koncentrace sodíku v dialyzačním roztoku“ je ze současného pohledu rizikové, neboť obvykle vede k pozitivní sodíkové bilanci, resp. nikdy nemáme jistotu, že zprvu dodaný sodík bude v dalším čase skutečně všechen odstraněn. Zkušenosti ukazují, že profilování koncentrace sodíku sice zlepší hemodynamickou toleranci procedury jako takové, ale o 36 % zvýší riziko celkové mortality a o 34 % riziko úmrtí z kardiovaskulárních příčin. Přibližně o jednu pětinu se zvýší i riziko nefatálních kardiovaskulárních příhod. Současně zvýší krevní tlak i mezidialyzační přírůstky neboli zvýší pravděpodobnost intradialyzační hypotenze při dalších mimotělních eliminačních procedurách. V současné době se profilování sodíku nedoporučuje.13
Jak již bylo výše uvedeno, vznik IDH však závisí nejen na velikosti ultrafiltrace, ale i na individuálních kompenzatorních mechanismech, které se fyziologicky aktivují při poklesu intravaskulárního objemu. Vlastní ultrafiltraci částečně kompenzuje zpětné doplňování tekutiny z intersticia do cév (tzv. refill).
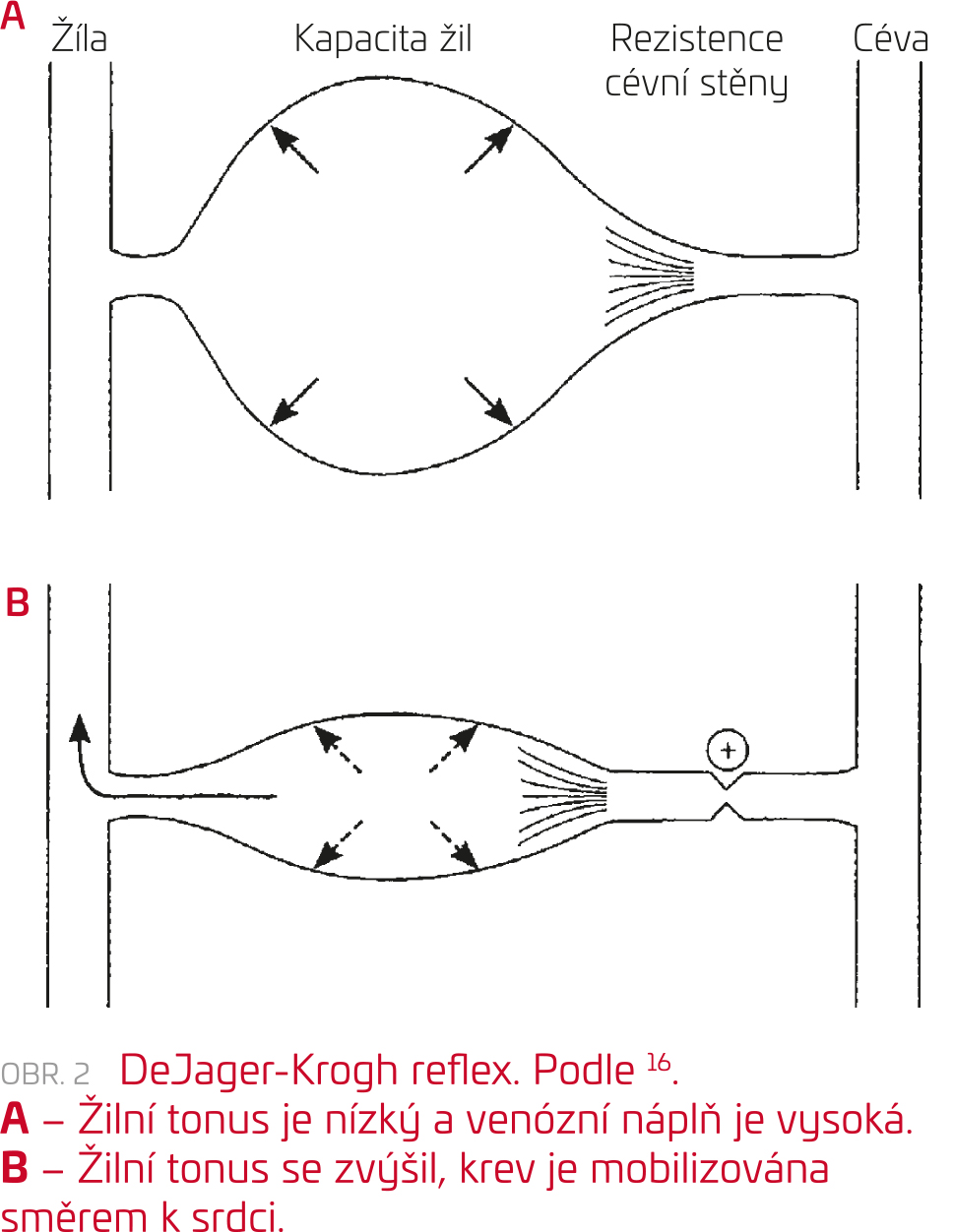
Ke kompenzatorním mechanismům na pokles intravaskulárního objemu (který je výslednicí mezi ultrafiltrací a zpětným doplňováním tekutin z intersticia do cévního řečiště) patří především zvýšení periferní cévní rezistence, aktivace žilního návratu (Jager fenomén)16 (obr. 2) a zvýšení srdečního výdeje. Srdeční výdej se zvyšuje dvojím mechanismem: zvýšením srdeční kontraktility a zvýšením srdeční frekvence.
Pokud jsou kompenzatorní mechanismy dysfunkční, intradialyzační hypotenze vznikne snáze. Víme, že srdeční výdej je u mnoha dialyzovaných pacientů snížen, že ejekční frakce je nízká a nelze ji automaticky zvýšit. Mnoho pacientů užívá betablokátory a pak zvýšení srdeční frekvence nenastane. Dialyzovaní pacienti mají i autonomní neuropatii, která rovněž kardiovaskulární kompenzatorní možnosti snižuje. Cévní rezistence při arterioskleróze klesne jen obtížně, cévy mají malou elasticitu. Antihypertenziva působící na cévní rezistenci (například blokátory kalciového kanálu) tuto odpověď zablokují.
Jak již bylo uvedeno, zásadní význam pro vznik hemodynamické nestability a IDH má příliš velká ultrafiltrační rychlost, která převýší regulační možnosti organismu. Pak je nutno ultrafiltrační rychlost snížit. K tomu jsou dvě možnosti, které lze kombinovat: prodloužení dialýzy a/nebo zvýšení počtu dialýz v týdnu (obě znamenají prodloužení týdenní doby dialýzy). Ještě důležitější je potřebě vysoké ultrafiltrace předcházet. K tomu je třeba omezení příjmu sodíku (a vody).
Trojkompartmentový model rozložení sodíku v organismu
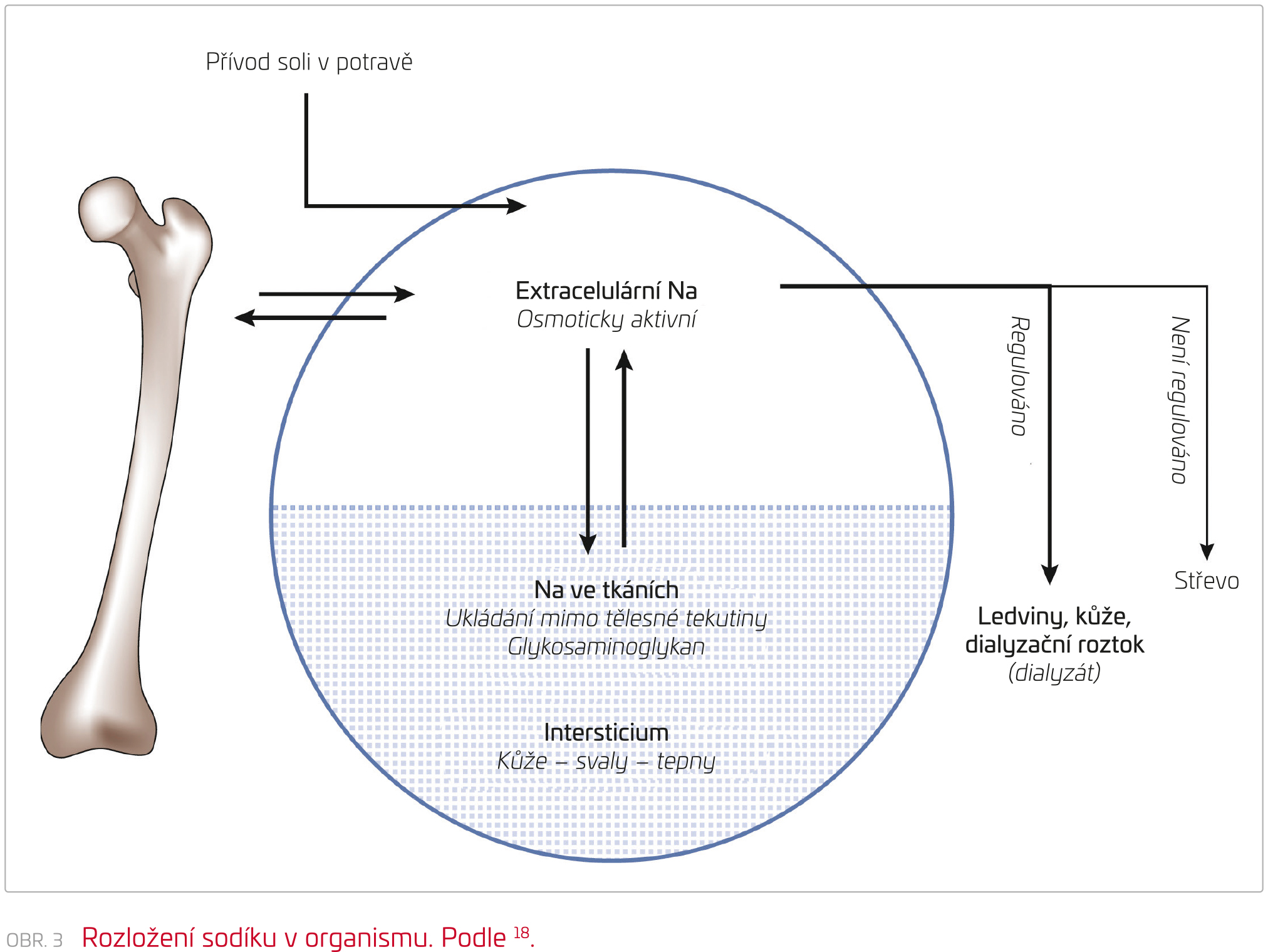
Klasické rozložení sodíku v organismu uvádí dva kompartmenty: intracelulární a extracelulární, kdy extracelulární je totožný s intersticiálním plus intravaskulárním. Extracelulárně lokalizovaný sodík je osmoticky aktivní. Intravaskulární a intersticiální koncentrace sodíku jsou za rovnovážných podmínek shodné. Během hemodialýzy se však v závislosti na koncentraci sodíku v dialyzátu mění koncentrace sodíku v krvi (v intravaskulárním prostoru), a až následně se mění koncentrace v intersticiální tekutině (se zpožděním).
V současnosti je však přesvědčivě doložena existence dalšího sodíkového kompartmentu (obr. 3).18
Osmoticky aktivní sodík ovlivňuje hemodynamiku a tonicitu. S osmoticky aktivním sodíkem je velmi těsně spojeno množství extracelulární tekutiny, srdeční výdej, krevní tlak i tkáňová perfuze; tonicita podmiňuje distribuci vody a objem vody v těle.
Osmoticky aktivní sodík je rozložen v extracelulárním prostoru (ECT), tedy nejen v intersticiu, ale i intravaskulárně. Při onemocnění/selhání ledvin dochází vlivem sodíku a tekutin k expanzi ECT, tj. k převodnění s následným přetížením kardiovaskulárního systému.
Sodík deponovaný ve tkáních (= ve třetím prostoru) je osmoticky neaktivní. Preferenční lokalizací, jak ukázaly studie se značeným izotopem (23Na+) při vyšetření magnetickou rezonancí, jsou kůže (zde se sodík ukládá pod keratinovou vrstvu), svaly a cévy (zde je preferenčně uložen v endoteliální výstelce). Sodík navázaný na glykosaminy, proteoglykany či adsorbované plazmatické proteiny pokrývající vnitřní výstelku cév působí významné poškození funkce endotelu i cévní stěny.
Se znalostí fenoménu „sodíkový set‑point“ (viz dále) nepřekvapí, že pozitivní sodíková bilance nezmění natremii, ale změní (zvýší) hlavně obsah sodíku v uvedených tkáních. Tkáňová depozita sodíku jsou vyšší nejen u pacientů s CKD a terminálním stadiem selhání ledvin (ESRD), ale i u diabetiků a pacientů s jinými onemocněními. Byť je tento sodík osmoticky neaktivní, má stále aktivitu biologickou, mimo jiné zhoršuje průběh daných onemocnění (viz dále).
Akumulace sodíku ve tkáních byla měřena magnetickou rezonancí s využitím značeného sodíku (23Na+‑MR). Vzhledem k tomu, že měření sodíku bylo při dané metodice spíše podhodnoceno, udávají autoři výsledek v arbitrárních jednotkách.19 Zajímavé je zjištění, že po úspěšné transplantaci se sodík z tkání uvolní.20
Důsledky akumulace sodíku ve tkáních
Byla dokonce dokumentována souvislost mezi obsahem sodíku v kůži a hypertrofií levé komory, a to nezávisle na hydrataci či na krevním tlaku.21 Dále bylo doloženo, že hemodialyzovaní pacienti s kardiovaskulárním onemocněním mají vyšší obsah sodíku v tkáních ve srovnání s pacienty bez kardiovaskulárního poškození.19 V této zcela recentní studii měli hemodialyzovaní pacienti s předchozí kardiovaskulární komplikací vyšší obsah sodíku v kůži (30,2 vs. 21,7 arbitrárních jednotek oproti dialyzovaným pacientům bez předchozí KV komplikace), analogicky, byť s menším rozdílem, byl i vyšší obsah sodíku ve svalové tkáni (24,7 vs. 21,5 arbitrárních jednotek), přitom hydratace, resp. převodnění (měřeno biospektroskopií) byly srovnatelné. Všichni pacienti byli ve věku nad 50 let a byli dialyzováni déle než šest měsíců.
Studií o orgánových a dalších dopadech osmoticky neaktivního, ale přesto v organismu retinovaného sodíku je zatím poměrně málo. Je však doloženo, že osmoticky neaktivní sodík přispívá ke svalovému úbytku a slabosti, k remodelaci srdce i cév, k inzulinové rezistenci; zvyšuje zánět (inflamaci), lymfangiogenezi, poškození CNS, plic a dalších orgánů a vyvolává lokální (nikoliv systémovou) hypertonicitu.19
Určitou (vizionářskou) predikci tkáňového ukládání sodíku uvedl již Charra v roce 1998, kdy vysvětloval tzv. lag‑fenomén neboli zpožděnou úpravu hypertenze po úpravě hyperhydratace a dosažení suché váhy tím, že musí být uvolněn i „water‑free“ sodík v hladké cévní svalovině, což může trvat i několik měsíců.10
Salerno a spol.22 studovali 52 dialyzovaných pacientů, u kterých stanovili obsah sodíku v kůži (Na+‑MR).23 Ukázali, že stoupající obsah Na v kůži je spojen s kratší dobou přežívání (nejen úmrtí, ale i významná KV příhoda); čtvrtý kvartil (rozdělení podle koncentrace sodíku v kůži) má čtyřikrát vyšší mortalitu. Multivariantní regresní model ukázal, že obsah sodíku v kůži závisí na obsahu sodíku v dialyzátu a je zvýšen i při městnavém srdečním selhání a nízké koncentraci albuminu v krvi.
Je třeba doplnit, že byl popsán i negativní metabolický a zánětlivý důsledek akumulace sodíku ve tkáních dialyzovaných pacientů.9
Sodík v dialyzačním roztoku
Koncentrace sodíku v dialyzátu, resp. v dialyzačním roztoku, je opakovaně a velmi široce diskutována od počátku dialyzačního léčení. V dobách, kdy délka dialýzy byla 8–12 hodin, byla koncentrace sodíku v dialyzačním roztoku celkem uniformně kolem 130 mmol/l. Zkrácení dialýzy na čtyři hodiny však významně ovlivnilo ultrafiltrační rychlost, která se nutně zvýšila. S vyšší ultrafiltrační rychlostí, navíc u pacientů s kardiovaskulárními a dalšími komplikacemi, se zákonitě často objevila hemodynamická nestabilita.
Zatímco v osmdesátých letech minulého století byla obvyklá koncentrace sodíku v dialyzátu 134–136 mmol/l, před koncem století to bylo již 138–140 mmol/l. V roce 2010 se koncentrace sodíku v dialyzačním roztoku pohybovala mezi 136 až 149 mmol/l, optimální koncentrace nebyla známa, avšak vědělo se, že terapeutické okno mezi převodněním spojeným s akumulací sodíku a riziko intradialyzační hypotenze při příliš velkém/rychlém odstranění sodíku z organismu je poměrně úzké. Medián byl 140 mmol sodíku v jednom litru dialyzátu, resp. dialyzačního roztoku (obr. 4).23
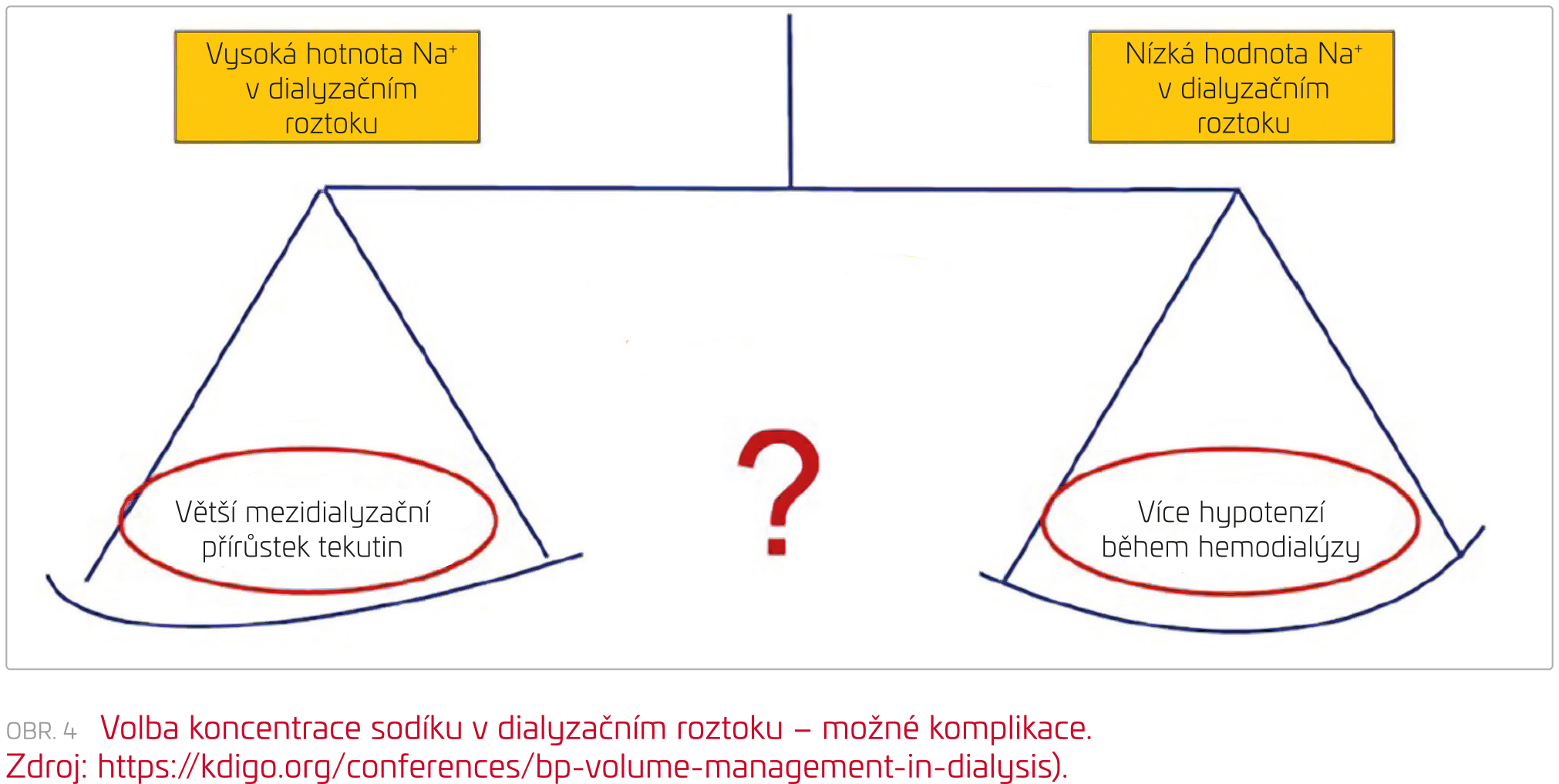
Před šesti lety byla publikována metaanalýza 23 studií s více než 76 tisíci pacientů, které srovnávaly různé koncentrace sodíku v dialyzačním roztoku.24 Jen tři studie sledovaly mortalitu a všechny tři byly observační. Riziko úmrtí bylo větší při větším sodíkovém gradientu. Pacienti léčení s použitím vyšších koncentrací sodíku měli vyšší mezidialyzační hmotnostní přírůstek, některé studie s použitím nižších koncentrací sodíku referovaly více intradialyzačních hypotenzí. Víme tedy, že podstatným cílem je volit takovou koncentraci sodíku (obr. 4), která by sodíkový gradient (viz níže) co nejvíce minimalizovala. Z tohoto pohledu by ideální koncentrace sodíku měla být shodná jako koncentrace v krvi, taková dialýza by byla izotonická.
Důležitým pojmem je sodíkový „set point“: koncentrace sodíku v séru je u každého pacienta stabilní, a to bez ohledu na koncentraci sodíku v dialyzátu. Tj. pozitivní bilance Na během HD nevede ke zvýšení natremie. Mezi pacienty se však koncentrace sodíku ve smyslu „set‑point“ individuálně liší.25
Dalším důležitým pojmem je sodíkový gradient. Je definován jako rozdíl mezi koncentrací sodíku v krvi a koncentrací sodíku v dialyzačním roztoku. Zvýšení gradientu o 1 mmol/l zvyšuje o třetinu mezidialyzační hmotnostní přírůstek s potřebou ultrafiltrační rychlosti vyšší než 10 ml/kg/h, přitom je doloženo, že tato rychlost je již prognosticky nepříznivá. Je žádoucí, aby sodíkový gradient byl s využitím technických možností minimalizován, avšak současně aby byla zajištěna eliminace sodíku z organismu (ta je dominantně pak zajištěna konvekcí, ultrafiltrací). Bylo doloženo, že aktivní kontrola sodíku v dialyzátu (s využitím zpětné vazby, viz dále) snižuje sodíkový gradient.26
Hlavní cíl izonatremické/izotonické HD je stabilní buněčná hydratace. Při hyponatremii (hypotonii) se buňky naplní vodou (snaha po dosažení identické osmolality v celém organismu), při hypernatremii se buňky „dehydratují“. Obojí je provázeno klinickými komplikacemi. Požadavek na stabilní buněčnou hydrataci během hemodialýzy je tedy požadavkem zásadním. Technické možnosti současných dialyzačních přístrojů nabízejí v tomto směru řešení. Pro správné stanovení koncentrace sodíku směřující k zachování izotonicity (izonatremie) jsou k dispozici dvě technické možnosti: (i) stanovení Na+ v laboratoři, (ii) odvození od konduktivity. Obě možnosti zajistí izotermickou hemodialýzu, avšak obě jinou.27
Sodíkový modul
Jak vyplývá z dosavadního rozboru, snad nejlepší cestou k eliminaci zátěže organismu sodíkem by byla dialýza s neutrálním (nulovým) rozdílem mezi koncentrací sodíku v krvi a v roztoku. Nadbytečný sodík by se odstranil konvekcí a žádný sodík z dialyzátu by nebyl dodán, sodíková bilance procedury by byla negativní. K udržení set pointu by se sodík uvolňoval v mezidobí do intersticiální tekutiny, avšak aby byla tato strategie opravdu účinná, je třeba, aby pacient byl srozuměn s nízkosodíkovou dietou (max. 2 gramy sodíku, tj. 5 gramů NaCl) a dodržoval ji.
Nové technické možnosti umožňují, aby dialýza byla izotonická. Během takovéto hemodialýzy je udržena stabilní koncentrace sodíku v krvi, a je tedy zachován „set point“ (který je při všech jiných postupech vlivem dialyzační procedury narušen). Současná aplikace opěrných bodů v sodíkovém dialyzačním managementu („Na handling“) zahrnuje tři na sebe navazující body.28 Patří k nim: (i) ochrana reziduální funkce ledvin plus případně diuretika a souběžně dodržování neslané diety, (ii) optimalizace léčebného schématu (čas/délka dialýzy, frekvence, technické provedení) a (iii) automatizovaná a kontrolovaná sodíková bilance pomocí „sodíkového modulu“ (který je součástí dialyzačních přístrojů, konkrétně přístrojů 6008, firma Fresenius) (obr. 5).
Je inspirující vidět vizionářské přístupy, zejména pokud se naplní. Vídáme je pochopitelně i v dialyzační nefrologii. Výše byla uvedena hypotéza Charry10 ohledně akumulace sodíku v cévách, a to v souvislosti s důležitou klinickou okolností (lag‑time). Jen o sedm let později, v roce 2005, předpovídal Locatelli, že v budoucnu dosáhneme kardiovaskulární stability během hemodialýzy tím, že předepsaná koncentrace sodíku v dialyzačním roztoku bude taková, aby vstupní a a postdialyzační koncentrace sodíku zůstala stejná (a odstranění sodíku z organismu se bude dít konvekcí, resp. ultrafiltrací).29 V tomto roce již byla k dispozici stále dosud užívaná a stále moderní technická vylepšení: měření konduktivity („ionic dialyzance“) a online měření dialyzační dávky, online měření recirkulace v cévním přístupu s využitím termodilučního principu, izotermická dialýza, monitorování změn relativního objemu krve během dialýzy. Na splnění své vize si však autor musel počkat prakticky více než 15 let. Podobným způsobem uvažovali i Covic a spol. o osm let později. Myšlenku sodíkové řízené bilance s využitím biofeedback principu v té době však považovali za „fatu morgánu“.
Individualizace a biofeedback řízení koncentrace sodíku v dialyzačním roztoku není dnes hudbou budoucnosti. Systém monitoruje koncentraci sodíku v dialyzátu (s využitím konduktivity) a souběžně stanovuje koncentraci sodíku v krvi. Při „pasivním“ zapojení se nastavená koncentrace sodíku v dialyzátu nemění, zůstává konstantní. Je však načtena sodíková bilance během dialýzy (odstraněné celkové množsví NaCl v gramech, s rozlišením celkového odstraněného množství a množství odstraněného difuzí). Množství odstraněné difuzí může být záporné (tj. difuzivní bilance procedury je pozitivní), pokud je koncentrace sodíku v krvi nižší než koncentrace v dialyzátu. Množství odstraněného sodíku tak mimo jiné závisí na sodíkovém gradientu a také na ultrafiltraci. Při aktivním zapojení se koncentrace sodíku v dialyzačním roztoku průběžně upravuje podle námi zadaných podmínek. Pokud je požadavkem provést izonatremickou hemodialýzu či hemodiafiltraci, průběžně se mění koncentrace sodíku v dialyzačním roztoku tak, aby kopírovala sodík v krvi. Tímto způsobem se zcela minimalizuje sodíkový gradient.
Je třeba doplnit, že systém je vyvinut, je k dispozici (i u nás) a je funkční, ale skutečný přínos pro praxi, pro (další) zlepšení péče o pacienty je dosud pouze teoretický, byť teoretický podklad je robustní. Na definitivní „tvrdá data“ si ještě budeme muset počkat.31 Přesto však současné podklady mohou být pro praxi využity. K ulehčení této možnosti by tento článek snad mohl přispět
Literatura
- Kjellstrand CM, Evans RL, Petersen RJ, et al. The “unphysiology” of dialysis: a major cause of dialysis side effects? Kidney Int Suppl 1975;(2):30–34.
- Kim GH. Dialysis unphysiology and sodium balance. Electrolyte Blood Press 2009;7:31–37.
- Burton JO, Jefferies HJ, Selby NM, et al. Hemodialysis‑induced cardiac injury: determinants and associated outcomes. Clin J Am Soc Nephrol 2009;4:914–920.
- McIntyre CW. Haemodialysis‑induced myocardial stunning in chronic kidney disease – a new aspect of cardiovascular disease. Blood Purif 2010;29:105–110.
- Huang SH, Crowley LE, Jefferies HJ, et al. The impact of hemodialysis on segmental and global longitudinal myocardial strain. Can J Cardiol 2014;30:1422–1428.
- McIntyre CW, Goldsmith DJ. Ischemic brain injury in hemodialysis patients: which is more dangerous, hypertension or intradialytic hypotension? Kidney Int 2015;87:1109–1115.
- Eldehni MT, Odudu A, Mcintyre CW. Brain white matter microstructure in end‑stage kidney disease, cognitive impairment, and circulatory stress. Hemodial Int 2019;23:356–365.
- Wolfgram DF. Intradialytic Cerebral Hypoperfusion as Mechanism for Cognitive Impairment in Patients on Hemodialysis. J Am Soc Nephrol 2019;30:2052–2058.
- Canaud B, Stephens MP, Nikam M, et al. Multitargeted interventions to reduce dialysis‑induced systemic stress. Clin Kidney J 2021;14(Suppl 4):i72–i84.
- Charra B, Bergström J, Scribner BH. Blood pressure control in dialysis patients: importance of the lag phenomenon. Am J Kidney Dis 1998;32:720–724.
- Thomson CR. Advising dialysis patients to restrict fluid intake without restricting sodium intake is not based on evidence and is a waste of time. Nephrol Dial Transplant 2001;16:1538–1542.
- Sars B, van der Sande FM, Kooman JP. Intradialytic Hypotension: Mechanisms and Outcome. Blood Purif 2020;49:158–167.
- Flythe JE, Chang TI, Gallagher MP, et al. Blood pressure and volume managemet in dialysis: conclusion from a Kidney Disease: Improving Global Outcomes (KDIGO) controversies conference. Kidney Int 2020;97:861–876.
- Chang TI. Impact of drugs on intradialytic hypotension: Antihypertensives and vasoconstrictors. Semin Dial 2017;30:532–536.
- Flythe JE, Kimmel SE, Brunelli SM. Rapid fluid removal during dialysis is associated with cardiovascular morbidity and mortality. Kidney Int 2011;79:250–257.
- Daugirdas T. Dialysis hypotension. A hemodynamic analysis. Editorial review. Kidney Int 1991;39:233–246.
- Keane DF, Raimann JG, Zhang H, et al. The time of onset of intradialytic hypotension during a hemodialysis session associates with clinical parameters and mortality. Kidney Int 2021;99:1408–1417.
- Canaud B, Kooman J, Selby NM, et al. Sodium and water handling during hemodialysis: new pathophysiologic insights and management approaches for improving outcomes in end‑stage kidney disease. Kidney Int 2019;95:296–309.
- Friedrich AC, Linz P, Nagel AM, et al. Hemodialysis Patients with Cardiovascular Disease Reveal Increased Tissue Na+ Deposition. Kidney Blood Press Res 2022;47:185–193.
- Dahlmann A, Linz P, Zucker I, et al. Reduction of Tissue Na+ Accumulation After Renal Transplantation. Kidney Int Rep 2021;6:2338–2347.
- Schneider MP, Raff U, Kopp C, et al. Skin Sodium Concentration Correlates with Left Ventricular Hypertrophy in CKD. J Am Soc Nephrol 2017;28:1867–1876.
- Salerno FR, Akbari A, Lemoine S. Outcomes and predictors of skin sodium concentration in dialysis patients. Clin Kidney J 2022; 15:1129–1136.
- Flythe JE, Mc Causland FR. Dialysate Sodium: Rationale for Evolution over Time. Semin Dial 2017 Mar; 30:99–111.
- Basile C, Pisano A, Lisi P, et al. High versus low dialysate sodium concentration in chronic haemodialysis patients: a systematic review of 23 studies. Nephrol Dial Transplant 2016;31:548–563.
- Trinh E, Weber C. The Dialysis Sodium Gradient: A Modifiable Risk Factor for Fluid Overload. Nephron Extra 2017;7:10–17.
- Ságová M, Wojke R, Maierhofer A, et al. Automated individualization of dialysate sodium concentration reduces intradialytic plasma sodium changes in hemodialysis. Artif Organs 2019;43:1002–1013.
- Gaillard F, Petitclerc T. From Isonatric to Isotonic Hemodialysis. Blood Purif 2018;46:77–80.
- Canaud B, Morena‑Carrere M, Leray‑Moragues H, et al: Fluid Overload and Tissue Sodium Accumulation as Main Drivers of Protein Energy Malnutrition in Dialysis Patients. Nutrients 2022;14:4489.
- Locatelli F, Buoncristiani U, Canaud B, et al. Haemodialysis with on‑line monitoring equipment: tools or toys? Nephrol Dial Transplant 2005;20:22–33.
- Covic A, Voroncanu L. Dialysis fata morgana: can we finally successtuly tackle intradialysis hypotension with plasma sodium biofeedback system? Nephrol Dial Transplant 2013;28:250–253.
- Petitclerc T, Mercadal L. Automated adjustment of dialysate sodium by the hemodialysis monitor: Rationale, implementation, and clinical benefits. Semin Dial 2022 Dec 2. Epub ahead of print
- Kategorie: Přehledové články
- Klíčová slova: akumulace sodíku ve tkáních ; hemodialyzační léčba; hemodialyzační nestabilita; sodík v dialyzačním roztoku; sodíkový modul; ultrafiltrace; ultrafiltrační rychlost