Močové infekce u seniorů a léčba asymptomatické
Souhrn
Tento článek je zaměřen na definici asymptomatické bakteriurie (ABU) a jsou diskutovány situace, ve kterých je plně indikována antibiotická terapie ABU a kdy je naopak tato léčba nevhodná. Je také diskutován přístup k diagnostice a léčbě infekce močového traktu (IMT) se zaměřením na rozpoznání klinických situací, ve kterých senioři profitují z antibiotické léčby a kdy nikoli. Jsou uvedeny principy antimikrobiální léčby IMT u seniorů.
Klíčová slova: asymptomatická bakteriurie – infekce močového traktu – seniorský věk
Infekce močového traktu je významnou příčinou morbidity seniorů, avšak předepisování antibiotik pro klinické obtíže, které nejsou specifické pro IMT, pouze na podkladě močového nálezu, je nevhodné a je příčinou stupňujícího se problému rezistence bakteriálních kmenů vůči antibiotikům. U mladších jedinců je klinická symptomatologie IMT typická a diagnóza většinou nečiní obtíže. Jinak je tomu u seniorů, zejména těch, kteří jsou klienty ústavů sociální péče. Symptomatologie IMT u nich bývá nespecifická a interpretaci může modifikovat výchozí kognitivní porucha, která omezuje odebírání anamnézy. Správné stanovení diagnózy IMT ztěžují u seniorů i) špatně definovaná klinická diagnostická kritéria; ii) spoléhání se na laboratorní kritéria IMT; iii) omezené pokyny pro použití a interpretaci diagnostických testů a iv) obtížné odlišení ABU od IMT. Tyto faktory vedou k „alibistickému“ podávání empirické antibiotické terapie (ABT) v nejistých případech a k nadměrnému užívání antibiotik, jež zhoršuje problém rezistence mikrobů na antibiotika a zvyšuje riziko poruchy střevního a močového mikrobiomu rezultující do dysmikrobiálních průjmů, klostridiové kolitidy a zvýšeného výskytu plísňových infekcí. Zvyšuje rovněž riziko nežádoucích účinků ABT v důsledku lékových interakcí.
ABU je kvantitativně definovaná bakteriurie ve vzorku moči odebrané jedinci bez příznaků IMT. Prahovou hodnotu ABU ze středního proudu moči představuje izolace jednoho typu bakteriálního organismu v počtu ≥ 105 jednotek tvořících kolonie (CFU)/ml.1 U žen by měl být získán druhý vzorek (nejlépe do dvou týdnů), aby se potvrdil růst stejného organismu přes stejný kvantitativní práh. Prahovou hodnotou ABU ze vzorku moči získané katetrizací močového měchýře je izolace jednoho typu organismu v počtu ≥ 105 CFU/ml.2 Vzorek se pro potvrzení nemusí opakovat. Pacienti s dlouhodobě zavedenými močovými katétry mívají bakteriurii nízké úrovně, často s více organismy, což odráží kolonizaci katétru. U asymptomatických pacientů je proto práh pro významnou bakteriurii vyšší než u pacientů se symptomy IMT, aby se zvýšila specificita a snížilo se nadměrné užívání antimikrobiálních látek.1 Bakteriální kmeny asociované s ABU mohou být méně virulentní, a proto nemusejí být nutně skutečnými patogeny. Výskyt ABU stoupá s věkem. Prevalence ABU je vysoká zejména u institucionalizovaných seniorů (15–50 %).3 V pečovatelských domovech je velmi častá kolonizace močových cest rezidentů multirezistentními organismy, které se šíří do dalších prostředí spolu s kolonizovanými pacienty. Tyto multirezistentní bakterie produkují beta‑laktamázu s rozšířeným spektrem (ESBL), mohou to být karbapenem‑rezistentní Enterobacteriaceae (CRE) a v poslední době i gramnegativní bakterie rezistentní na kolistin. Močové katétry jsou nejdůležitějším rizikovým faktorem pro ABU i rozvoj IMT. Fungují jako vstupní brány pro bakterie a bakteriurie je u katetrizovaných jedinců všudypřítomná. Antibiotika mohou sice dočasně sterilizovat moč, po jejich vysazení však dochází rychle k opětovné bakteriální kolonizaci močových cest. Setrvale sterilní kultivace moči není proto pro pacienta se zavedeným močovým katétrem realistickým cílem a pokus o eliminaci bakteriurie opakovaným předepisováním antibiotik vede k selekci multirezistentních organismů. ABU nezvyšuje (po adjustaci na další komorbidity) mortalitu seniorů. Antibiotika podávaná pro ABU nesnižují četnost následných komplikací a paradoxně mohou zvyšovat riziko následné IMT.
Screening ABU a preventivní léčba ABU jsou indikovány pouze u jedinců před urologickými procedurami traumatizujícími sliznici močového traktu. Naopak není vhodné pátrat po bakteriurii a léčit ABU u institucionalizovaných seniorů, jedinců s dysfunkčními nebo rekonstruovanými močovými cestami, s permanentním močovým katétrem (PMK) a před plánovanou náhradou kloubů.4
V klinické praxi se často přeceňuje laboratorní nález leukocyturie. Přítomnost významné leukocyturie (≥ 10 leukocytů/µl v necentrifugované moči) není zástupným laboratorním příznakem bakteriurie nebo IMT. Pyurie je citlivá, ale není specifická pro IMT, zejména u katetrizovaných pacientů, u kterých je pyurie všudypřítomná. Absence leukocyturie vylučuje IMT, přítomnost leukocyturie diagnózu IMT nepotvrzuje!
Potvrzení diagnózy IMT vyžaduje současné splnění tří diagnostických komponent: i) klinické příznaky lokalizující infekci do močového traktu nebo nespecifické příznaky při absenci příznaků naznačujících infekci jinde; ii) laboratorní průkaz pyurie a bakteriurie; iii) nepřítomnost jiné infekce nebo neinfekčního procesu, kterému lze snadno připsat pacientovy symptomy.
Akceptovaná klinická kritéria pro lokalizaci infekce do močového traktu zahrnují dysurii samotnou nebo horečku doprovázenou frekvencemi (časté nucení na močení), suprapubickou bolestí, velkou hematurií, citlivostí v kostovertebrálním úhlu, novou či zhoršující se urgencí (urgentní nucení na močení) nebo inkontinencí moči. Nespecifické příznaky, jako je horečka provázená celkovým útlumem nebo amentním/amentně‑delirantním stavem či nově se objevivší bolest v kostovertebrálním úhlu, bývají předzvěstí s permanentním katétrem asociované IMT (catheter‑associated urinary tract infection, CAUTI). CAUTI je často spojena s rozvojem urosepse. Tyto příznaky se mohou rozvinout i do 48 hodin po odstranění PMK. Správné posouzení souvislosti mezi IMT a apatií či amencí/amentně‑delirantním stavem je pro personál ošetřovatelských institucí obtížné. Naštěstí je dysurie (název zahrnuje bolestivé močení, frekvence, urgence, náhle vzniklou inkontinenci) identifikována spolehlivě. Přítomnost dysurie se zdá být jedním z nejsilnějších prediktorů bakteriurie a pyurie u rezidentů pečovatelských institucí. Nově vzniklá dysurie je nejužitečnějším klinickým nálezem při identifikaci IMT u seniorů. K dezinterpretaci může dojít u starých žen, které trpí genitourinárním syndromem, způsobeným hypoestrogenním stavem, imitujícím dysurie nepříjemnými senzacemi v oblasti zevního genitálu.5 Jiné příznaky mohou být zavádějící a často jsou nesprávně interpretovány jako symptomatická IMT. Například pády jsou často považovány za projev IMT. Asociace pádů a IMT je kontroverzní a prospektivní studie nenašly souvislost mezi pády a přítomností bakteriurie a pyurie. Také zákal moči, barva sedimentu a zápach spolehlivě nekorelují s přítomností močové infekce a samy o sobě nejsou příznaky IMT; jsou však spojeny s nadměrným předepisováním antibiotik. Takové změny v moči mohou naznačovat potřebu zvýšené perorální hydratace odrážející snížený pocit žízně u seniorů nebo mohou být způsobeny léky (např. multivitaminy) nebo některými potravinami.
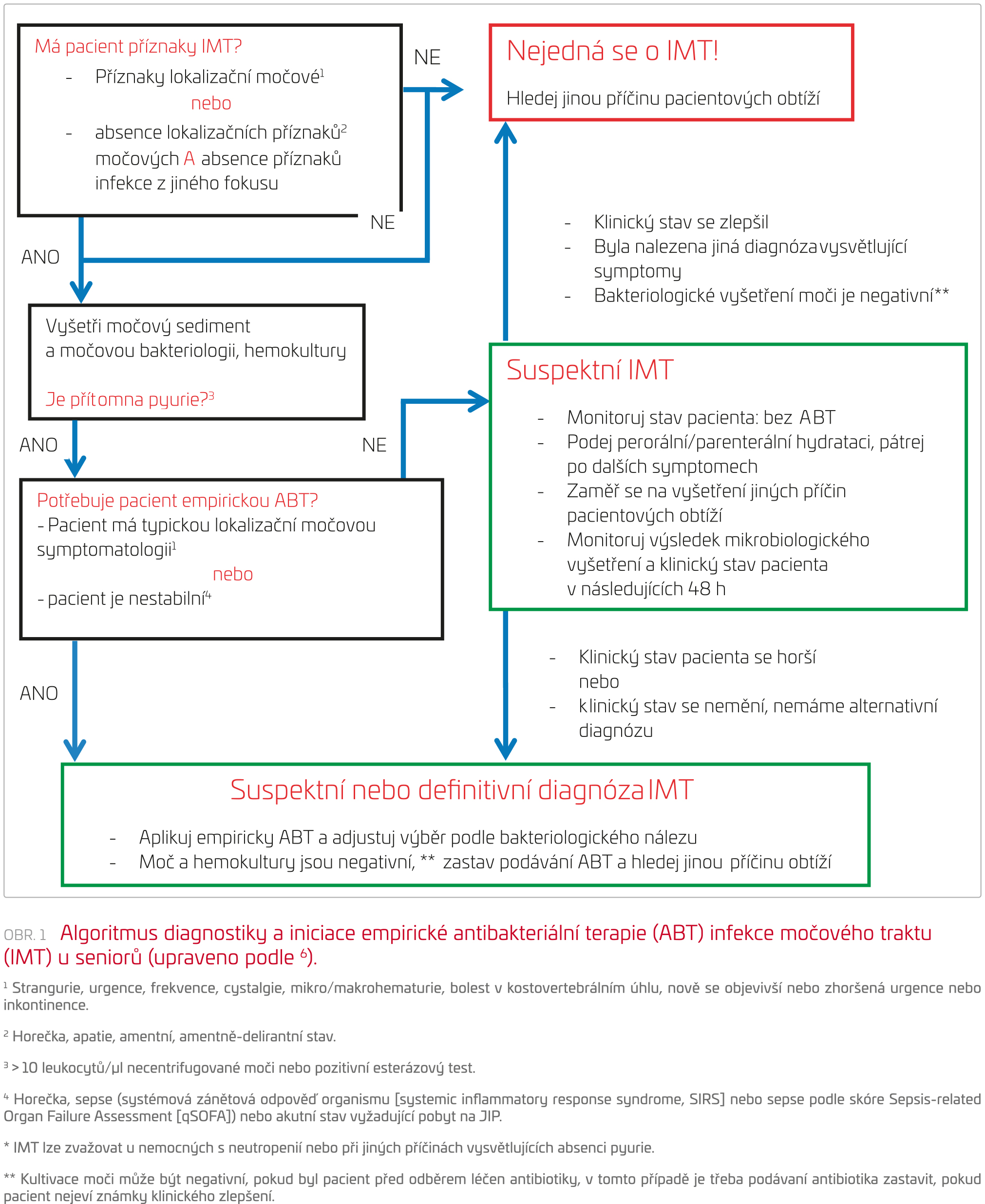
V klinické praxi je důležité rozpoznat situaci, kdy je iniciace empirické ABT nezbytná, a odlišit ji od situace, ve které je možné vyčkávat na další klinický vývoj a výsledky vyšetření. Pacienta se spektrem příznaků, které mohou souviset s fokusem bakteriální infekce v močovém traktu, nebo horečnatého nemocného bez zjevných klinických příznaků bakteriálního fokusu v jiné lokalizaci, než jsou močové cesty (například pneumonie), podrobíme vyšetření močového sedimentu a odebereme moč a krev k bakteriologickému vyšetření. Iniciace empirické ABT závisí na klinickém stavu pacienta. Neváháme s podáním antibiotika u nemocného se zjevnou symptomatologií IMT a/nebo u hemodynamicky nestabilního pacienta s počínajícími příznaky sepse. ABT měníme podle výsledků mikrobiologického vyšetření. U stabilních nemocných bez jednoznačných lokalizačních symptomů IMT lze vyčkat a postupovat podle vývoje klinického stavu a dát přednost hydratační terapii před antibiotiky. Schéma upravené podle pracovní skupiny Cortése‑Penfielda6 lze použít k odlišení seniorů, kteří pravděpodobně budou mít prospěch z užívání antibiotik, od těch, kteří z ABT profitovat nebudou (obr. 1).
Volba antimikrobiálního přípravku bude významně závislá na posouzení rizikových faktorů IMT v individuální anamnéze. U nemocných často hospitalizovaných nebo rezidentů ošetřovatelských ústavů, kteří byli v nedávné době léčeni antibiotiky a/nebo mají v recentní anamnéze nález multirezistentních kmenů bakterií z jakéhokoli fokusu infekce a/nebo měli přechodně močový katétr či trpí závažnou urologickou komorbiditou a mají zavedený PMK nebo jinou arteficiální derivaci močových cest, lze předpokládat IMT způsobenou nozokomiálními bakteriemi rezistentními na běžně užívaná antibiotika. Gramnegativní patogeny ESBL+ jsou rezistentní nejenom na betalaktamová, ale také na nebetalaktamová antibiotika (fluorochinolony, aminoglykosidy, kotrimoxazol). Kromě ESBL+ kmenů (Escherichia coli, Klebsiella pneumoniae) musíme počítat i s gramnegativními kmeny bakterií produkujícími karbapenemázu a s multirezistentními kmeny Acinetobacter a Pseudomonas aeruginosa. Výběr antibiotika je u těchto nemocných obtížnější a vyžaduje konzultace s problémově zaměřeným mikrobiologem, který je obeznámen s lokální situací rezistence. V každém případě lze považovat za postup non lege artis zahájení ABT bez předchozího zajištění biologického materiálu k mikrobiologickému vyšetření. Preferujeme parenterální aplikaci empiricky zvoleného antibiotika, přinejmenším v prvních dnech léčby. V první volbě zůstávají karbapenemy a piperacilin/tazobaktam. Cefalosporiny 3. generace jsou většinou aktivní proti fluorochinolon‑rezistentním kmenům gramnegativních bakterií. Ceftriaxon a cefotaxim nejsou vhodné pro terapii IMT způsobenou kmeny Pseudomonas aeruginosa. Ceftazidim je aktivní proti fluorochinolon‑rezistentním a mnohým kmenům karbapenem‑rezistentních gramnegativních bakterií, u nás je vyhrazen jen pro terapii Pseudomonas aeruginosa. Karbapenemy jsou účinné vůči ceftriaxon‑rezistentním a fluorochinolon‑rezistentním gramnegativním bakteriálním kmenům. Ceftozolam/tazobaktam a ceftazidim/avibaktam jsou rezervou pro léčbu IMT, která je způsobena multirezistentními gramnegativními bakteriemi. Oba přípravky jsou vyhrazeny pro nemocné s život ohrožující urosepsí. Aminoglykosidy by neměly být používány v monoterapii. Účinnost antibakteriální léčby je nutné kontrolovat opakovaným mikrobiologickým vyšetřením. Deeskalace ABT na perorální formu není možná v případech následně zjištěné rezistence bakteriálního kmenu na antibiotika, která lze podávat perorálně.
Závěr
Vysoká prevalence ABU u seniorů provázená pyurií často svádí k tomu, že zhoršení jejich klinického stavu, které vyžaduje pečlivou diferenciální diagnózu, je zjednodušeně interpretováno jako projev IMT, a tak dochází relativně často k neindikovanému podávání antibiotické léčby nebo opožděnému stanovení jiné diagnózy. Diagnóza IMT u seniorů by měla být diagnózou per exclusionem, pokud nejsou přítomny zcela typické symptomy. Velká část nevhodného předepisování antibiotik pro IMT pochází z diagnózy založené na nespecifických nálezech, jako jsou leukocytóza, leukocyturie, slabost, malátnost, zhoršení mobility a soběstačnosti. Riziko poškození při oddálení léčby IMT u klinicky stabilních pacientů je nízké.7 Poměr rizika a přínosu upřednostňuje opatrný přístup k diagnostice a předepisování antibiotik pro IMT, když nejsou přítomny příznaky lokalizující bakteriální infekci do močového traktu a/nebo klinický stav hrozící rozvojem sepse.
Literatura
- Nicolle LE, Gupta K, Bradley SF, et al. Clinical Practice Guideline for the Management of Asymptomatic Bacteriuria: 2019 Update by the Infectious Diseases Society of America. Clin Infect Dis 2019;68:e83–e110.
- Hooton TM, Bradley SF, Cardenas DD, et al.; Infectious Diseases Society of America. Diagnosis, prevention, and treatment of catheter‑associated urinary tract infection in adults: 2009 International Clinical Practice Guidelines from the Infectious Diseases Society of America. Clin Infect Dis 2010;50:625–663.
- Nicolle LE, Bradley S, Colgan R, et al. Infectious diseases society of America guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults. Clin Infect Dis 2005;40:643–654.
- Boncat G, Bartoletti R, Bruyère F, et al. EAU Guidelines on Urological Infections 2022. https://d56bochluxqnz.cloudfront.net/documents/full‑guideline/EAU‑Guidelines‑on‑Urological‑Infections‑2022.pdf. Navštíveno 21. 11. 2022.
- Angelou K, Grigoriadis T, Diakosavvas M, et al. The Genitourinary Syndrome of Menopause: An Overview of the Recent Data. Cureus 2020;12:e7586.
- Cortes‑Penfield NW, Trautner BW, Jump RLP. Urinary Tract Infection and Asymptomatic Bacteriuria in Older Adults. Infect Dis Clin North Am 2017;31:673–688.
- Knottnerus BJ, Geerlings SE, Moll van Charante EP, ter Riet G. Women with symptoms of uncomplicated urinary tract infection are often willing to delay antibiotic treatment: a prospective cohort study. BMC Fam Pract 2013;14:71.
- Kategorie: Názor hosta
- Klíčová slova: asymptomatická bakteriurie ; infekce; infekce močového traktu ; seniorský věk