Steroid rezistentní nefrotický syndrom u dětí a jeho léčba
Souhrn
Steroid‑rezistentní nefrotický syndrom (SRNS) dětského věku představuje závažné onemocnění spojené s vysokým rizikem progrese do terminálního stadia chronického onemocnění ledvin. Nejčastěji se setkáváme s idiopatickým SRNS, u 30–40 % dětí lze ale molekulárně‑genetickým vyšetřením identifikovat mutaci v některém z více než 70 v současnosti známých genů asociovaných s monogenní formou této nemoci. Léky první volby u dětí s idiopatickým SRNS jsou kalcineurinové inhibitory, v případě nálezu genetické etiologie je namístě přerušení kortikosteroidní terapie.
Klíčová slova: diagnostika – genetické vyšetření – imunosupresivní léčba – steroid‑rezistentní nefrotický syndrom
Úvod
Nefrotický syndrom (NS) je onemocnění charakterizované nefrotickou proteinurií (> 1 000 mg/m2/den), hypoalbuminemií (< 25 g/l) a otoky. Incidence se v západní Evropě udává 1,2 až 6,7 případu na 100 000 dětí a rok.1 Přestože většina pacientů zareaguje na léčbu kortikosteroidy poklesem proteinurie do plné remise, u 10–15 % dětí úplného ústupu proteinurie nedosáhneme a klasifikujeme je jako steroid‑rezistentní.2,3 Steroid‑rezistence je definována jako nedosažení remise podáváním prednisonu v dávce 60 mg/m2/den po dobu čtyř týdnů.1 Definici jednotlivých klasifikačních pojmů pro NS shrnuje tabulka 1. Rezistence ke kortikosteroidům se obvykle objevuje již během iniciální léčby kortikosteroidy, můžeme se s ní ale setkat i později, během léčby relapsu, v takových případech hovoříme o pozdní rezistenci. Právě reakce na léčbu kortikosteroidy je hlavním prognostickým ukazatelem u dětí s NS. SRNS je spojen s významným rizikem postupné ztráty funkce ledvin, až 50 % dětí s rezistencí na kortikosteroidy dosáhne terminálního stadia chronického onemocnění ledvin do 15 let od manifestace onemocnění.2 Díky rozvoji molekulárně‑genetických vyšetření se v poslední době podařilo identifikovat řadu genů asociovaných se SRNS. Odhalení genetické příčiny je důležité pro zvolení správného léčebného postupu, k odhadu prognózy a k případnému genetickému poradenství pro rodinu nemocného dítěte.
Etiologie
Největší skupinu dětí se SRNS tvoří jedinci s idiopatickou formou. Za pravděpodobnou příčinu NS u těchto pacientů se v současné době považuje přítomnost solubilních cirkulujících faktorů, které zvyšují propustnost glomerulární filtrační bariéry ledvin. Jedním z důkazů této teorie je fakt, že u dětí s negenetickým SRNS často dochází k rekurenci onemocnění po transplantaci ledviny a následně dobře reagují na léčbu plazmaferézami nebo imunoadsorpcí. Také podání plazmy jedinců se SRNS laboratorním zvířatům indukovalo vznik proteinurie. Navzdory snahám mnoha vědeckých týmů se ale cirkulující faktor doposud nepodařilo identifikovat.  Na druhou stranu pokroky v molekulárně‑genetických metodách umožňují v současnosti nalézt genetickou podstatu SRNS u jedné třetiny pacientů.3 Dnes známe více než 70 genů asociovaných se vznikem SRNS. Většina těchto genů kóduje proteiny, které mají zásadní roli v ovlivnění struktury a funkce glomerulární filtrační bariéry tvořené fenestrovaným endotelem, glomerulární bazální membránou a epiteliálními buňkami zvanými podocyty. Štěrbinová membrána mezi výběžky podocytů zvanými pedicely tvoří pomyslná očka sítka propustnosti ledvin pro bílkoviny. Právě porušení morfologie filtrační bariéry a zejména strukturální abnormality podocytů představují typický histologický obraz ledvin jedinců s NS. U dětí s geneticky podmíněným SRNS se nejčastěji setkáváme s mutacemi genů kódujících proteiny, které jsou důležitou součástí štěrbinovité membrány, cytoskeletu podocytů či glomerulární bazální membrány. Dále sem patří geny pro transkripční faktory, nukleární proteiny, mitochondriální proteiny a další. NS může být také součástí některých genetických syndromů. V longitudinální studii dětí se SRNS z Česka a Slovenska byly nejčastěji identifikovány mutace v genech NPHS2, WT1 a NUP93.4 Tabulka 2 ukazuje hlavní klinické projevy spojené s genetickou příčinou SRNS.
Na druhou stranu pokroky v molekulárně‑genetických metodách umožňují v současnosti nalézt genetickou podstatu SRNS u jedné třetiny pacientů.3 Dnes známe více než 70 genů asociovaných se vznikem SRNS. Většina těchto genů kóduje proteiny, které mají zásadní roli v ovlivnění struktury a funkce glomerulární filtrační bariéry tvořené fenestrovaným endotelem, glomerulární bazální membránou a epiteliálními buňkami zvanými podocyty. Štěrbinová membrána mezi výběžky podocytů zvanými pedicely tvoří pomyslná očka sítka propustnosti ledvin pro bílkoviny. Právě porušení morfologie filtrační bariéry a zejména strukturální abnormality podocytů představují typický histologický obraz ledvin jedinců s NS. U dětí s geneticky podmíněným SRNS se nejčastěji setkáváme s mutacemi genů kódujících proteiny, které jsou důležitou součástí štěrbinovité membrány, cytoskeletu podocytů či glomerulární bazální membrány. Dále sem patří geny pro transkripční faktory, nukleární proteiny, mitochondriální proteiny a další. NS může být také součástí některých genetických syndromů. V longitudinální studii dětí se SRNS z Česka a Slovenska byly nejčastěji identifikovány mutace v genech NPHS2, WT1 a NUP93.4 Tabulka 2 ukazuje hlavní klinické projevy spojené s genetickou příčinou SRNS.
Diagnostika
Prvním krokem v diagnostice SRNS je důkladná anamnéza a fyzikální vyšetření. Někteří pacienti mohou mít další extrarenální projevy v rámci syndromů asociovaných se SRNS. Základní laboratorní vyšetření séra a moči potvrdí diagnózu NS. V rámci diagnostiky se zaměřujeme hlavně na vyloučení sekundární příčiny – imunologické vyšetření (imunoglobuliny, komplement, autoprotilátky, postvakcinační protilátky), sérologie hepatitidy B, C, HIV. Biopsie ledviny představuje důležitou diagnostickou metodu u dětí se SRNS. Vzorek tkáně je vyšetřen světelnou mikroskopií, imunofluorescencí a elektronovou mikroskopií. Nejčastěji u těchto pacientů nacházíme syndrom minimálních změn, IgM nefropatii, fokálně segmentální glomerulosklerózu, mezangioproliferativní glomerulonefritidu, vzácněji jinou chronickou glomerulonefritidu. Ukazuje se, že syndrom minimálních změn postupem času přechází u některých pacientů ve fokálně segmentální glomerulosklerózu, jedná se tedy v těchto případech nejspíše o kontinuum jedné histologické jednotky. Nález v renální biopsii nám nicméně nepomůže k odlišení genetické a negenetické formy NS. Stejně tak se neliší klinické příznaky mezi jednotlivými histologickými diagnózami, proto je velmi důležité provedení molekulárně‑genetického vyšetření s cílem identifikovat případné mutace genů asociovaných se vznikem NS.4
Léčba idiopatického SRNS
Hlavním cílem léčby dětí se SRNS je dosažení kompletní remise základního onemocnění. I navození parciální remise je v některých případech léčebným úspěchem. U dětí s idiopatickým SRNS jsou lékem první volby kalcineurinové inhibitory (CNI) podávané po dobu prvních šest měsíců spolu s kortikosteroidy, které je vhodné zpočátku aplikovat parenterálně. Podle výsledků studií z poslední doby tímto režimem dosáhne parciální nebo kompletní remise až 80 % léčených dětí. Předpokládáme dvojí terapeutický efekt CNI: 1. imunosupresivní blokádu proliferace T lymfocytů a tvorby interleukinu 2, 2. neimunitní přímý efekt na stabilizaci cytoskeletu podocytu. Limitací dlouhodobé léčby CNI je jejich nefrotoxicita. Většina studií popisuje srovnatelný efekt cyklosporinu A i takrolimu, některé práce udávají nižší nefrotoxický potenciál takrolimu. U cyklosporinu A se také ve větší míře vyskytují kosmetické nežádoucí účinky jako hirsutismus a hypertrofie gingiv.4 Dalším přípravkem používaným v léčbě pacientů se SRNS je mykofenolát mofetil (MMF), selektivní inhibitor replikace DNA v T a B lymfocytech. Využívá se především v léčbě dětí se steroid‑senzitivním NS a u většiny z nich je schopen efektivně navodit dlouhodobou remisi. Na základě současných poznatků je MMF v monoterapii méně účinný v léčbě SRNS v porovnání s CNI, nicméně terapie MMF vede u některých jedinců k částečné nebo úplné remisi. Výhodou MMF je také to, že není nefrotoxický, uplatňuje se často jako přídatný přípravek u dětí již léčených CNI nebo rituximabem (RTX). Pacienti s idiopatickou formou SRNS a nedostatečnou odpovědí na kombinovanou imunosupresi představují velkou výzvu pro dětské nefrology. Těmto dětem lze podat RTX, chimérickou monoklonální protilátku, jež se váže na buňky s povrchovým antigenem CD20, vede tedy k depleci B lymfocytů. RTX je velmi účinný u steroid‑senzitivních forem, v případě SRNS jsou závěry studií nejednotné. Obecně je u těchto pacientů udávána významně nižší efektivita v porovnání s dětmi se steroid‑senzitivním NS.5 Stejně jako u kalcineurinových inhibitorů i rituximab má vedle svého imunosupresivního účinku rovněž přímý efekt na stabilitu cytoskeletu podocytů. Některé studie ukazují, že u pacientů se SRNS je zapotřebí podat vyšší kumulativní dávku RTX vzhledem k jeho ztrátám do moči při významné proteinurii. Podání RTX se jeví jako poměrně bezpečné, i když vzácně se popisují i závažné infekční komplikace, postižení plic a progresivní leukoencefalopatie. Pro pacienty s nedostatečnou odpovědí na RTX, případně s nesnášenlivostí této látky je možným lékem volby ofatumumab, plně humanizovaná monoklonální protilátka s vazbou na antigen CD20. Další testovanou monoklonální protilátkou s potenciálně příznivým léčebným efektem u jedinců se SRNS je abatacept, který blokuje aktivaci, proliferaci, diferenciaci a přežívání T lymfocytů. Nejenom v případě tohoto přípravku je nutno vyčkat výsledků randomizovaných studií u dětí.6 Byla publikována také kazuistická sdělení o úspěšném využití extrakorporálních metod – plazmaferézy, imunoadsorpce a lipidové aferézy v léčbě NS rezistentního na kombinovanou imunosupresivní léčbu. Také k potvrzení účinnosti těchto léčebných modalit musíme vyčkat výsledků prospektivních klinických studií.7 Obrázek 1 ukazuje algoritmus léčby SRNS v dětském věku.
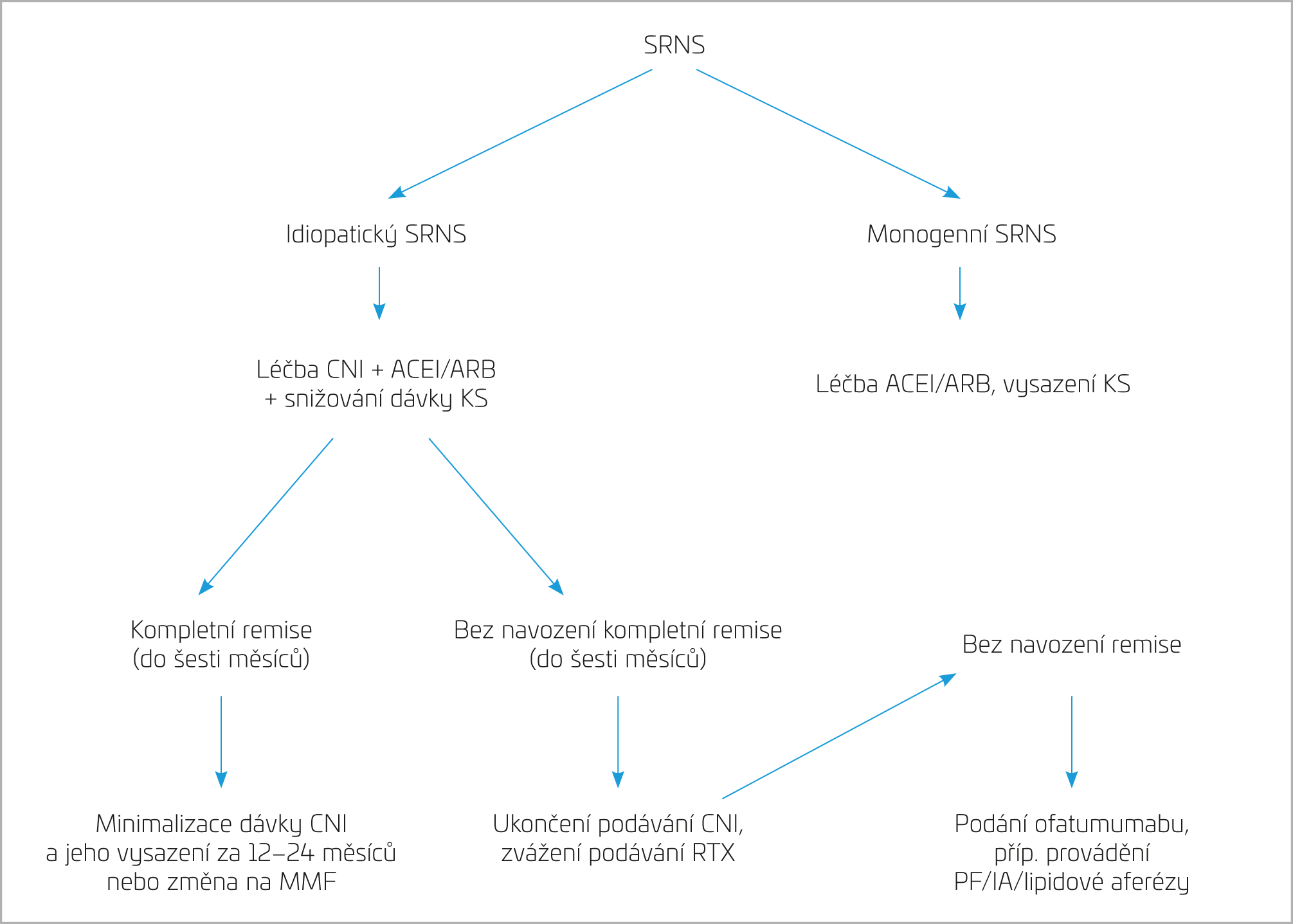
OBR. 1 Schéma léčby SRNS u dětí (převzato a upraveno z 1).
ACEI – inhibitory angiotenzin konvertujícího enzymu; ARB – blokátory receptorů AT1 pro angiotenzin II; CNI – kalcineurinové inhibitory; IA – imunoadsorpce; KS – kortikosteroidy; MMF – mykofenolát mofetil; PF – plazmaferéza; RTX – rituximab; SRNS – steroid‑rezistentní nefrotický syndrom.
Léčba geneticky podmíněného SRNS
Přestože je většina pacientů s monogenní formou SRNS rezistentní k jakékoliv formě imunosupresivní terapie, může podle současných studií část nemocných dosáhnout alespoň částečné remise při terapii CNI.8 Léčebný efekt se vysvětluje přímým působením CNI na cytoskelet podocytu. Cyklosporin A také zvyšuje rezistenci vas afferens, což vede ke snížení průtoku krve ledvinami, poklesu filtračního tlaku v glomerulu a ve výsledku ke snížení proteinurie. Částečnou reakci na imunosupresivní terapii někteří autoři vysvětlují i tím, že poškozený gen může hrát roli v imunitní odpovědi organismu. Velkým přínosem pro děti s geneticky prokázanou etiologií NS je možnost přerušit kortikoidní terapii. Při zahájení imunosupresivní léčby u dětí se SRNS je nutno brát v potaz, že tím prohlubujeme imunodeficitní stav spojený se ztrátami imunoglobulinů a faktorů komplementu do moči. Použití inhibitorů CNI u monogenní formy SRNS by vždy mělo být pečlivě zváženo s ohledem na jejich četné nežádoucí účinky – zejména nefrotoxicitu a zvýšené riziko infekce. V současné době se doporučuje začít podávat CNI spolu s kortikosteroidy v rámci léčby SRNS k posouzení jejího efektu do obdržení výsledků genetického vyšetření a další eventuální podávání této imunosupresivní léčby indikovat individuálně.8 Výjimku v léčbě genetické formy SRNS tvoří mutace genů odpovědných za syntézu koenzymu Q10, jenž je nezbytnou součástí dýchacího řetězce na membráně mitochondrií. Jeho deficit způsobuje skupinu vzácných autozomálně recesivních chorob, jež se vyznačují především symptomy poškození centrálního a periferního nervového systému a kosterních svalů. Část těchto pacientů má také steroid‑rezistentní nefrotický syndrom, který se projevuje nejčastěji během prvních let života. Včasná léčba suplementací koenzymu Q10 může významně zmírnit klinické symptomy nemoci, v případě NS snižuje proteinurii a riziko progrese chronického onemocnění ledvin.9
Symptomatická léčba SRNS
SRNS je spojen s řadou komplikací souvisejících s patofyziologií této nemoci. K pacientům s otoky je nutno přistupovat individuálně, dle klinického stavu se podávají diuretika, případně albumin u jedinců s intravaskulární tekutinovou deplecí. Zahájení léčby ovlivňující osu renin‑angiotenzin‑aldosteron s antiproteinurickým účinkem je namístě u jedinců, u nichž se nepodaří navodit plnou remisi základního onemocnění. Názory na profylaktické podávání antibiotik v rámci prevence infekčních komplikací nejsou jednotné. Děti se SRNS je vhodné očkovat pneumokokovou vakcínou a každý rok přeočkovat proti chřipce. SRNS je spojen s vyšším rizikem vzniku žilní i tepenné trombózy, nicméně také pro dlouhodobé profylaktické podávání antikoagulační léčby nemocným bez přidružených dalších rizikových faktorů nemáme jasná podpůrná data. Antikoagulační léčba je indikována u pacientů s tromboembolickou nemocí v osobní anamnéze, infekcí, pozitivním screeningem hereditárních trombofilních stavů, rizikem dehydratace a u dětí se zavedeným centrálním žilním katétrem.10 Také smíšená hyperlipidemie patří mezi komplikace SRNS. Na základě současných doporučení je vhodné zvážit podání statinů při hodnotách LDL cholesterolu (cholesterolu v lipoproteinech o nízké hustotě) > 4,1 mmol/l, u dětí s dalšími kardiovaskulárními rizikovými faktory již při hodnotě 3,4 mmol/l.1
Závěr
Pokroky v porozumění patogenezi a diagnostice SRNS změnily v posledních desetiletích pohled na tuto heterogenní skupinu onemocnění. Doposud se nepodařilo identifikovat cirkulující faktor, který by měl být zodpovědný za porušení glomerulární filtrační bariéry. Genetické testování dětí se SRNS je nyní nezbytnou součástí diagnostiky, jelikož u velké části pacientů umožňuje určit příčinu NS. Léčebná strategie závisí na etiologii onemocnění, léky první volby u idiopatického SRNS jsou CNI, u dětí s prokázanou genetickou formou je vhodné tato imunosupresiva podávat do výsledku molekulárně-genetické analýzy. Důležitou součást terapeutického přístupu k dětem se SRNS představuje symptomatická léčba
Literatura
- Trautmann A, Vivarelli M, Samuel S, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid‑resistant nephrotic syndrome. Pediatr Nephrol 2020;35:1529–1561.
- Mekahli D, Liutkus A, Ranchin B, et al. Long‑term outcome of idiopathic steroid‑resistant nephrotic syndrome: a multicenter study. Pediatr Nephrol 2009;24:1525–1532.
- Tullus K, Webb H, Bagga A. Management of steroid‑resistant nephrotic syndrome in children and adolescents. Lancet Child Adolesc Health 2018;2:880–890.
- Bezdicka M, Stolbova S, Seeman T, et al. Genetic diagnosis of steroid‑resistant nephrotic syndrome in a longitudinal collection of Czech and Slovak patients: a high proportion of causative variants in NUP93. Pediatr Nephrol 2018;33:1347–1363.
- Kallash M, Smoyer WE, Mahan JD. Rituximab Use in the Management of Childhood Nephrotic Syndrome. Front Pediatr 2019;7:178.
- Lee JM, Kronbichler A, Shin JI, Oh J. Current understandings in treating children with steroid‑resistant nephrotic syndrome. Pediatr Nephrol 2020 Feb 21. doi: 10.1007/s00467‑020‑04476‑9. Epub ahead of print. PMID: 32086590.
- Raina R, Krishnappa V. An update on LDL apheresis for nephrotic syndrome. Pediatr Nephrol 2019;34:1655–1669.
- Wei C, El Hindi S, Li J, et al. Circulating urokinase receptor as a cause of focal segmental glomerulosclerosis. Nat Med 2011;17:952–960.
- Bezdicka M, Dluholucky M, Cinek O, Zieg J. Successful maintenance of partial remission in a child with COQ2 nephropathy by coenzyme Q10 treatment. Nephrology (Carlton) 2020;25:187–188.
- Carpenter SL, Goldman J, Sherman AK, et al. Association of infections and venous thromboembolism in hospitalized children with nephrotic syndrome. Pediatr Nephrol 2019;34:261–267.
- Kategorie: Názor hosta
- Klíčová slova: genetika; imunosupresivní léčba; kortikosteroidy; steroid rezistentní nefrotický syndrom
