Syndrom nádorového rozpadu
Souhrn
Syndrom nádorového rozpadu (tumor lysis syndrome, TLS) je urgentní onkologický stav, kdy v krátkém čase dochází k náhlému rozpadu velkého množství nádorových buněk a k uvolnění jejich obsahu do cirkulace. Koncentrace kyseliny močové, draslíku a fosforu rostou rychleji, než je ledviny dokáží odstranit. Přebytek fosforu může vyvázat vápník, což vede ke snížení hodnoty vápníku v krvi. Změny koncentrací kyseliny močové, draslíku, fosforu a vápníku v krvi mohou nepříznivě ovlivnit fungování řady klíčových orgánů, zejména ledvin, ale také srdce, mozku, svalů i gastrointestinálního traktu. Největší riziko rozvoje TLS mají pacienti s velkou „nádorovou zátěží“, s nádory s vysokým podílem rychle se dělících buněk, chemosenzitivními malignitami. TLS se neomezuje pouze na pacienty léčené tradiční chemoterapií; může se také objevit u pacientů užívajících steroidy, hormonální terapii, cílenou nebo radiační léčbu. U pacientů s dehydratací nebo s dysfunkcí ledvin je riziko vzniku TLS také vyšší. Nejracionálnější strategií je prevence TLS (volba protinádorové terapie, hydratace, alopurinol, rasburikáza atd.). Pokud dojde k rozvoji TLS, jsou léčebná opatření podobná těm preventivním, v některých případech vyžaduje nemocný intenzivní péči, případně akutní dialýzu.
Klíčová slova: akutní dialýza – akutní stavy v onkologii – hyperurikemie – chemoterapie – tumor – zhoubný nádor
Tumor lysis syndrom (TLS) je akutní onkologický stav, který je způsoben masivním rozpadem nádorových buněk a uvolňováním velkého množství draslíku, fosfátu a kyseliny močové do systémového oběhu. Usazování krystalů kyseliny močové nebo fosforečnanu vápenatého v renálních tubulech může vést k akutnímu poškození ledvin s vývojem oligurie nebo anurie. Katabolismus nukleových kyselin na kyselinu močovou vede k hyperurikemii; výrazné zvýšení vylučování kyseliny močové může mít za následek její vysrážení v renálních tubulech a renální vazokonstrikci, poruchu autoregulace, snížení průtoku ledvinami, oxidaci a zánět, což vede k akutnímu poškození ledvin.1 Hyperfosfatemie s depozicí fosforečnanu vápenatého v renálních tubulech může také způsobit akutní poškození ledvin. Vysoké koncentrace kyseliny močové a fosfátu toto riziko potencují, protože kyselina močová se snáze vysráží v přítomnosti fosforečnanu vápenatého a naopak. Syndrom je charakterizován rychlým rozvojem hyperurikemie, hyperkalemie, hyperfosfatemie, hypokalcemie a akutního poškození ledvin. TLS je definován jak laboratorními kritérii (tab. 1), tak klinickými rysy (tab. 2).
 TLS se nejčastěji diagnostikuje u pacientů s agresivními a vysoce agresivními lymfomy (zejména u Burkittova lymfomu) a s akutní lymfoblastickou leukemií (ALL) po zahájení cytotoxické léčby, i když se může vyskytnout také spontánně u jiných typů nádorů s vysokým podílem dělících se nádorových buněk, s velkou nádorovou náloží nebo vysokou senzitivitou k cytotoxické terapii. Je třeba poznamenat, že nebezpečí rozpadu nádoru nesouvisí jen s rozpadem buněk tumoru po účinné chemoterapii, ale i cílená léčba užívaná samostatně nebo v kombinaci s běžnými cytotoxickými látkami může vést ke zvýšení frekvence a závažnosti TLS u hematologických nádorů, které dříve byly s touto komplikací spojeny zřídka (např. venetoclax [ABT‑199], obinutuzumab [anti‑CD20 monoklonální protilátka], dinaciclib [inhibitor cyklin‑dependentní kinázy], alvocidib [flavopiridol, inhibitor cyklin‑dependentní kinázy] atp.).2
TLS se nejčastěji diagnostikuje u pacientů s agresivními a vysoce agresivními lymfomy (zejména u Burkittova lymfomu) a s akutní lymfoblastickou leukemií (ALL) po zahájení cytotoxické léčby, i když se může vyskytnout také spontánně u jiných typů nádorů s vysokým podílem dělících se nádorových buněk, s velkou nádorovou náloží nebo vysokou senzitivitou k cytotoxické terapii. Je třeba poznamenat, že nebezpečí rozpadu nádoru nesouvisí jen s rozpadem buněk tumoru po účinné chemoterapii, ale i cílená léčba užívaná samostatně nebo v kombinaci s běžnými cytotoxickými látkami může vést ke zvýšení frekvence a závažnosti TLS u hematologických nádorů, které dříve byly s touto komplikací spojeny zřídka (např. venetoclax [ABT‑199], obinutuzumab [anti‑CD20 monoklonální protilátka], dinaciclib [inhibitor cyklin‑dependentní kinázy], alvocidib [flavopiridol, inhibitor cyklin‑dependentní kinázy] atp.).2
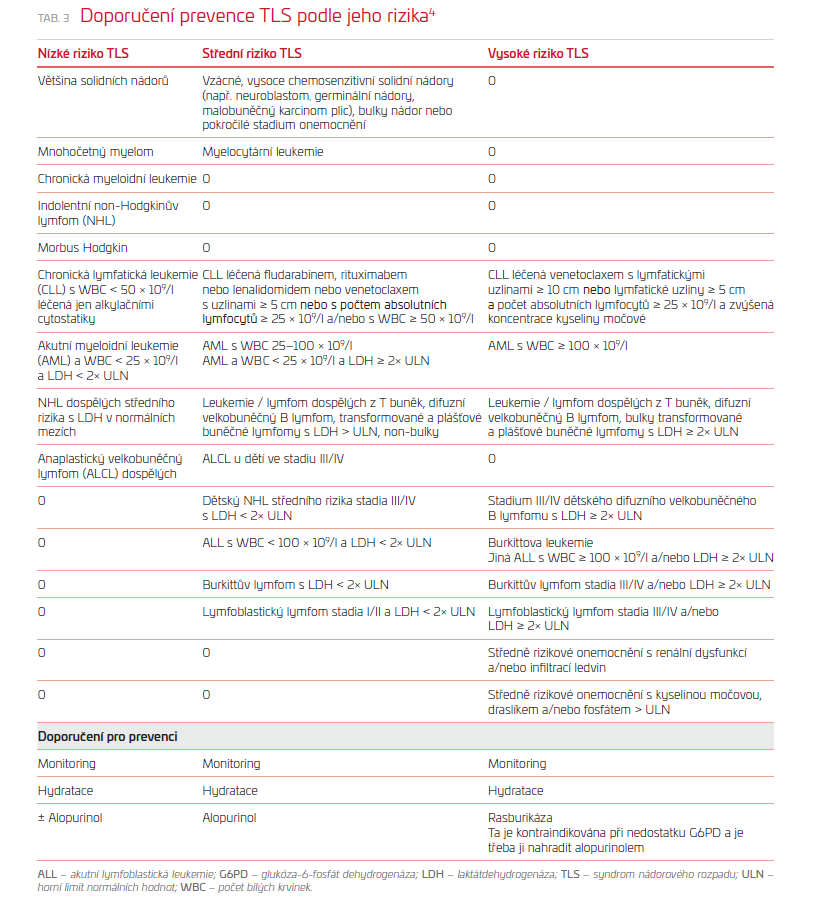
Panel odborníků v rámci mezinárodního konsenzu navrhl klasifikaci, která stratifikuje zhoubné nádory podle rizika vzniku TLS (tab. 3). Pro odhad rizika TLS u jednotlivých pacientů je nutné zvážit rizikové faktory související s nádorem anebo s pacientem (tab. 3).
Nejlepší léčbou je prevence. Doporučení pro prevenci a léčbu vycházejí z odhadovaného rizika TLS specifického pro dané onemocnění (tab. 3) a řídí se doporučeními odborné skupiny pro prevenci a léčbu TLS.3 Zjednodušený algoritmický přístup ke stratifikaci rizika a léčbě TLS je uveden v publikaci Howarda a spol. a Jonese v New Englad Journal of Medicine.4
Profylaxe
U všech pacientů s vysokým nebo středním rizikem TLS je doporučena agresivní hydratace tekutinami (2–3 l/m2 denně), aby bylo dosaženo vylučování moči nejméně 80–100 ml/m2 za hodinu. Pokud nemocný nemá akutní obstrukční uropatii nebo hypovolemii, lze v případě potřeby použít k udržení výdeje moči kličkové diuretikum. Neexistují ale žádné důkazy o tom, že alkalizace moči je přínosem, ale nepochybně existuje potenciální riziko poškození ledvin, zvláště pokud jsou zvýšeny hodnoty fosfátů. Alkalizace může podporovat ukládání depozit kalciumfosfátu do měkkých tkání, není doporučena současně s rasburikázou. Intravenózní podání hydrogenuhličitanu sodného by se nemělo indikovat, pokud nemocný nemá metabolickou acidózu. Je také možné využít léky snižující urikemii, jako je alopurinol, rasburikáza a febuxostat. Rasburikáza by se obecně neměla podávat osobám s nedostatkem glukóza‑6‑fosfát dehydrogenázy (G6PD) kvůli riziku těžké hemolýzy a všichni pacienti s možným nedostatkem G6PD by měli být vyšetřováni na aktivitu G6PD, týká se to zejména mužů z Afriky, Středomoří nebo s předky z jihovýchodní Asie a osob s anamnézou hemolytické reakce po lécích. Pokud je v naléhavých případech nutné podání rasburikázy a nejsou k dispozici výsledky testování G6PD, lze rasburikázu podat v jedné nízké dávce (např. 0,02–0,05 mg/kg, ne však více než 3 mg) a je třeba provést akutní hemodialýzu v případě významné hemolýzy. Druhá dávka by měla být podána, pouze pokud nebyla prokázána hemolýza nebo methemoglobinemie. Zřídka může být pacient s mírným nedostatkem G6PD (např. 50–60 % normální aktivity) léčen rasburikázou, pokud je riziko TLS vysoké, a alternativy rasburikázy nejsou k dispozici.3
Pro počáteční léčbu většiny pediatrických a dospělých pacientů s vysokým rizikem TLS (tab. 3), zejména u pacientů se sníženou funkcí ledvin nebo srdce, doporučujeme spíše rasburikázu než alopurinol. Místo vícedenní léčby se doporučuje jedna dávka rasburikázy (0,2 mg/kg). Pokud je však použita léčba jednou dávkou, musejí být hodnoty kyseliny močové pečlivě sledovány a musejí být podány další dávky rasburikázy, když hodnota kyseliny močové v séru zůstává vysoká nebo se opakuje hyperurikemie. Léčba alopurinolem může být také zahájena v případě, že je koncentrace kyseliny močové v séru snížena na adekvátně nízkou nebo normální hodnotu. Krevní vzorky pro kyselinu močovou by měly být odebírány do předchlazené zkumavky a měly by být okamžitě umístěny na led, a pokud je to možné, měl by být test dokončen do čtyř hodin.
Pro zahajovací léčbu dospělých a pediatrických pacientů se středním rizikem TLS (tab. 3) se doporučuje spíše alopurinol než rasburikáza, pokud nejsou zvýšeny koncentrace kyseliny močové před léčbou (tj. < 476 µmol/l). Podání jedné dávky rasburikázy (0,15 mg/kg) je v tomto případě rozumnou alternativou.5
Febuxostat lze použít u pacientů s hyperurikemií, kteří netolerují alopurinol nebo pokud rasburikáza není k dispozici nebo je kontraindikována. V případě, že jsou koncentrace kyseliny močové před léčbou ≥ 476 µmol/l, je doporučena spíše rasburikáza než alopurinol.
Pokud se používá rasburikáza, doporučuje se namísto vícedenní léčby jednorázová dávka (0,15 mg/kg, 3 nebo 6 mg v závislosti na tělesné hmotnosti). Pokud se však používá léčba jednou dávkou, je třeba pečlivě sledovat koncentraci kyseliny močové a při opakované hyperurikemii je doporučeno podat další dávku rasburikázy. U pacientů s nízkým rizikem TLS (tab. 3) se doporučuje spíše profylaktická hydratace a pečlivé sledování než alopurinol nebo rasburikáza profylakticky.6
Monitorování po onkologické léčbě
Pacienti s vysokým rizikem TLS by měli dostávat intenzivní podpůrnou péči s nepřetržitým monitorováním funkce srdce, pečlivým sledováním výdeje moči a rovnováhy tekutin a častým sériovým měřením hodnot elektrolytů, kreatininu a kyseliny močové.
U dětí a dospělých se středním nebo vysokým rizikem rozvoje TLS by mělo být měření sérových koncentrací kyseliny močové, fosfátů, draslíku, kreatininu, vápníku a laktátdehydrogenázy (LDH) hodnoceno čtyři až šest hodin po počátečním podání chemoterapie a každých šest až dvanáct hodin poté. Náznak rozvoje TLS nebo stoupající koncentrace kyseliny močové by měly podnítit okamžitý terapeutický zásah.
U dospělých pacientů se středním rizikem, kteří neužívají rasburikázu, by měly být hodnoty elektrolytů stanoveny osm hodin po chemoterapii a sledovány po dobu nejméně 24 hodin po dokončení prvního cyklu chemoterapie (24 hodin po podání konečné látky pro několikadenní režimy.7
Léčba prokázaného syndromu lýzy tumoru
Pacienti, u kterých se během léčby objeví TLS nebo se u nich rozvine, by měli mít intenzivní ošetřovatelskou péči s nepřetržitým monitorováním srdce a měřením hodnot elektrolytů, kreatininu a kyseliny močové každé čtyři až šest hodin. Efektivní terapie zahrnuje kombinaci léčby specifických odchylek elektrolytů nebo akutního selhání ledvin, použití rasburikázy (pokud nebyla původně podána) a pokusu odstranit krystaly kyseliny močové z ledvin pomocí kličkových diuretik a intravenózně podávaných tekutin, vhodné je i použití dialýzy.
Indikace pro léčbu náhrady funkce ledvin zahrnují těžkou oligurii nebo anurii, trvalou hyperkalemii, symptomatickou hypokalcemii vyvolanou hyperfosfatemií a vysokou hodnotu kalcium fosfátu.8
Závěr
Syndrom rozpadu nádorových buněk je velmi závažný akutní stav, který může nemocného připravit o ledviny, nebo dokonce o život. Z tohoto důvodu je nutné u pacientů s poruchou renálních funkcí nebo s rizikovým typem či rozsahem zhoubného nádoru či v případě užití intenzivní nebo vysokodávkované terapie této situaci předejít především dostatečnou hydratací v průběhu onkologické systémové léčby. Pečlivé monitorování ledvinných funkcí, koncentrací kyseliny močové a hodnot minerálů může včas odhalit vyvíjející se komplikaci rozpadu zhoubného nádoru a zdůvodnit zahájení léčby alopurinolem, rasburikázou nebo dialýzou. Pacient s rozvinutým tumor lysis syndromem vyžaduje intenzivní péči. Řadu zhoubných nádorů neumíme zcela vyléčit a na některé nemocní dříve nebo později zemřou, byla by ale škoda, kdyby nám umírali na komplikace jejich léčby. Tumor lysis syndrom je jednou z těch nejzávažnějších.
Literatura
- Gupta A, Moore JA. Tumor Lysis Syndrome. JAMA Oncol 2018;4:895.
- Larson R, Pui A. Tumor lysis syndrome: prevention and treatment. In: D. Savarese (Ed.), UpToDate, 2019. Retrieved from https://www.uptodate.com/contents/tumor‑lysis‑syndromeprevention‑and‑treatment
- Cairo MS, Coiffier B, Reiter A, Younes A, TLS Expert Panel. Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome (TLS) in adults and children with malignant diseases: an expert TLS panel consensus. Br J Haematol 2010;149:578–586.
- Howard SC, Jones DP, Pui CH. The tumor lysis syndrome. N Engl J Med 2011;364:1844–1854.
- Coiffier B, Altman A, Pui CH, et al. Guidelines for the management of pediatric and adult tumor lysis syndrome: an evidence‑based review. J Clin Oncol 2008;26:2767–2778.
- Cheuk DK, Chiang AK, Chan GC, Ha SY. Urate oxidase for the prevention and treatment of tumour lysis syndrome in children with cancer. Cochrane Database Syst Rev 2017;3:CD006945.
- Cortes J, Moore JO, Maziarz RT, et al. Control of plasma uric acid in adults at risk for tumor lysis syndrome: efficacy and safety of rasburicase alone and rasburicase followed by allopurinol compared with allopurinol alone – results of a multicenter phase III study. J Clin Oncol 2010;28:4207–4213.
- Alakel N, Middeke JM, Schetelig J, Bornhäuser M. Prevention and treatment of tumor lysis syndrome, and the efficacy and role of rasburicase. Onco Targets Ther 2017;10:597–605.
- Kategorie: Názor hosta
- Klíčová slova: akutní stavy v onkologii ; dialyzační léčba; hyperurikemie; chemoterapie; zhoubný nádor