Urea – starý biomarker v novém světle aneb Jaký může být přínos urey v době kardiorenální?
Souhrn
Kardiorenální medicína představuje dynamicky se rozvíjející oblast, kterou spojuje široké spektrum vzájemně se ovlivňujících interakcí mezi oběma systémy. Mezi hlavní patofyziologická rozhraní obousměrné interakce srdce–ledviny patří hemodynamické, neurohormonální a inflamatorní mechanismy. Posouzení jejich dílčí významnosti a možnosti jejich kvantifikace napříč širokým spektrem kardiorenálních fenotypů není v klinické praxi jednoduché, resp. je prakticky nemožné. Tento článek je velmi stručným a nedokonalým poodhalením jiného pohledu na sérovou koncentraci urey, a sice jako na nepřímý ukazatel maladaptivní aktivace neurohormonálních dějů zapojených do patogeneze kardiorenálních syndromů.
Klíčová slova: biomarker – kardiorenální syndrom – močovina – prognóza – srdeční selhání
Trocha historické perspektivy
Močovinu (ureu) prvně izoloval z moči holandský lékař Hermann Boerhaave již kolem roku 1727. Její přítomnost v krvi a současně shodnost s močovinou v moči byla prokázána v roce 1822. Od zavedení modernějších metod jejího stanovení na počátku 20. století byla urea po několik desítek let používána jako nejužívanější test renálních funkcí. I ve 21. století má stanovení hodnoty urey společně s koncentrací kreatininu stále své, byť z pohledu hodnocení funkce ledvin omezené klinické místo. Nedávné poznatky však dávají sledování sérových hodnot urey nový rozměr.
Fyziologie urey
Močovina je kvantitativně nejvýznamnějším degradačním produktem potravinových a tkáňových bílkovin. Vzniká v játrech z toxického amoniaku uvolněného deaminačními reakcemi („detoxifikace“ amoniaku v močovinovém cyklu). Dobře difunduje buněčnými membránami, takže její koncentrace je shodná jak v plazmě, tak v intracelulární tekutině. Změřená hodnota urey v séru/plazmě (norma 3–8 mmol/l) vždy odráží rovnováhu mezi její produkcí a eliminací. Koncentrace močoviny inverzně koreluje s poklesem glomerulární filtrace (GFR). Volně filtrovatelná močovina je z 30–70 % reabsorbována především v proximálních tubulech. Urea je ale významně ovlivněna řadou non‑renálních faktorů, které zahrnují množství bílkovin v přijaté potravě, míru endogenního proteinového katabolismu, příjem tekutin či jaterní syntézu urey. Zatímco jaterní cirhóza, těžká malnutrice, nízký příjem proteinů či agresivní tekutinová resuscitace snižují sérovou koncentraci močoviny, krvácení do zažívacího traktu, léčba kortikosteroidy, vysoký příjem bílkovin a hyperkatabolické stavy (sepse, polytrauma, popáleniny) její koncentrace zvyšují nezávisle na funkci ledvin. Hodnoty urey v séru také ovlivňují všechny stavy, které stimulují její renální reabsorpci. Tímto mechanismem může např. dojít k disproporci mezi relativně nižší koncentrací kreatininu v séru a nepřiměřeně zvýšenou hodnotou urey v séru u prerenální etiologie akutního poškození ledvin.
Urea jako užitečný ukazatel neurohormonální aktivace?
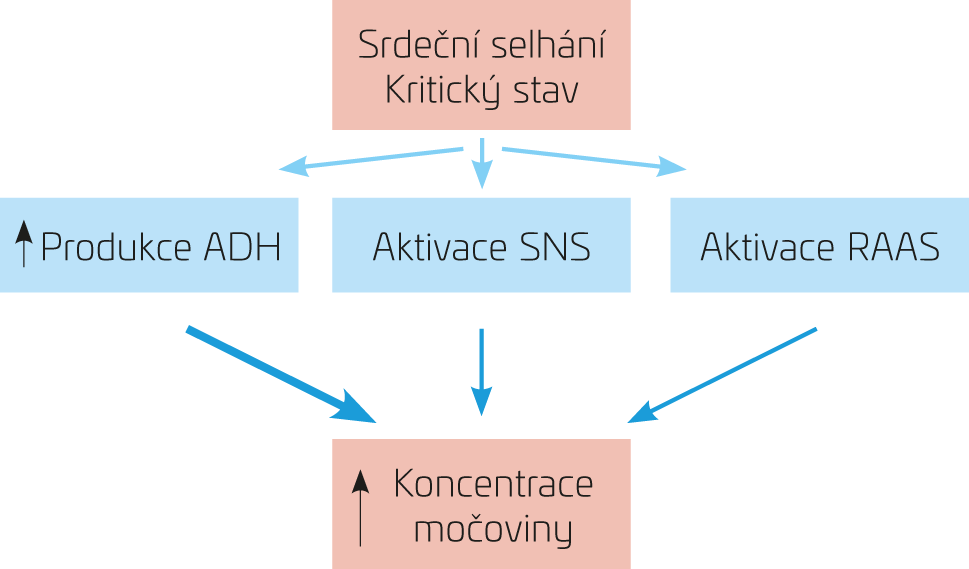
Řada významných patologických stavů (např. srdeční selhání, kritické stavy) je spojena s maladaptivní odpovědí tří klíčových patogenetických mechanismů – non‑osmotickou nadprodukcí vazopresinu (antidiuretického hormonu, ADH), aktivací sympatického nervového systému (SNS) a renin‑angiotenzin‑aldosteronového systému (RAAS). Významný podíl zvýšeného uvolňování ADH na progresi kongesce, rozvoji hyponatremie a periferní vazokonstrikci je dobře popsán například u srdečního selhání. A je to právě ADH (a v menší míře mineralokortikoidy), který je také odpovědný za extenzivní reabsorpci urey v distálním nefronu. ADH totiž upreguluje geny dvou transportérů močoviny (UT‑A a UT‑B). Mimochodem oba tyto geny byly nalezeny i v jiných tkáních (např. v srdci), ale jejich fyziologický význam není zcela objasněn. Nadměrná upregulace těchto transportérů močoviny je přinejmenším zčásti odpovědná za zvýšené hodnoty urey, jež nejsou v přiměřené míře výsledkem renální dysfunkce. Není to pouze ADH (byť má zřejmě dominantní roli), ale všechny výše uvedené komponenty neurohormonální aktivace, které zvyšují plazmatické koncentrace močoviny nezávisle na filtrační funkci ledvin (obr. 1). Protože plazmatické koncentrace ADH korelují se závažností výše zmíněných patologických stavů, je celkem přesvědčivé, že by koncentrace močoviny mohly být klinicky užitečným ukazatelem neurohormonální aktivace, např. u již zmíněného srdečního selhání či u kritických stavů.
Oporu v uvedeném tvrzení lze nalézt v řadě klinických studií, převážně z problematiky akutní dekompenzace chronického srdečního selhání a kardiorenálního syndromu (pro systematický přehledový článek viz 1). Například výsledky databáze ADHERE ukázaly, že mezi 39 testovanými proměnnými byla koncentrace urey ≥ 15,3 mol/l v době přijetí do nemocnice nejsilnějším ukazatelem prognózy.2 Nedávné studie také prokázaly, že nejhorší krátkodobou (90 dní) i dlouhodobou (36 měsíců) prognózu mají pacienti s perzistující elevací urey v době propuštění z nemocnice.3–5 Horší prognózu mají i nemocní, kteří mají zvýšenou koncentraci močoviny navzdory normální nebo jen mírně zvýšené hodnotě kreatininu.6,7 V jiné studii autoři demonstrovali, že prognostický význam urey je přinejmenším srovnatelný s informací získanou sledováním natriuretických peptidů.7 Výsledky kolektivně naznačují, že koncentrace močoviny je silnějším prognostickým ukazatelem než samotná hodnota glomerulární filtrace u nemocných se srdečním selháním. Rozdílný vliv močoviny a kreatininu (nebo na kreatininu založeném výpočtu GFR) na celkový výsledek také naznačuje, že tyto dva parametry odrážejí dva odlišné patologické procesy. Zatímco kreatinin je odrazem filtrační funkce ledvin, hodnota urey navíc reflektuje míru neurohormonální aktivace a renální odpověď na systémové patofyziologické procesy u pacientů s kardiorenální interakcí (viz obr. 1).
OBR. 1 Urea jako biomarker neurohormonální aktivace – mechanismy.
ADH – antidiuretický hormon; RAAS – systém renin‑angiotenzin‑aldosteron; SNS – sympatický nervový systém.
Klíčovou a zatím nezodpovězenou otázkou zůstává, jaké mohou být jiné než prognostické konsekvence výše diskutovaného konceptu. Nabízí se úvaha, zda by podskupina pacientů s kardiorenální problematikou a zvýšenou koncentrací močoviny v séru (která je v disproporci s filtrační funkcí ledvin) nemohla mít užitek z intervencí, jež ovlivňují/zmírňují míru neurohormonální aktivace (kombinovaná inhibice RAAS/neprilysin, selektivní antagonisté receptoru V2, antagonisté mineralokortikoidních receptorů, inhibitory sodíko‑glukózového kotransportéru 2 apod.). V každém případě dynamické změny sérových koncentrací močoviny u pacientů s kardiorenálními syndromy stojí za klinickou pozornost a měly by být impulsem k diskusi nad optimalizací léčby srdečního selhání s pečlivým sledováním nemocných v nemocnici i po jejich propuštění.
Literatura
- Kazory A. Emergence of blood urea nitrogen as a biomarker of neurohormonal activation in heart failure. Am J Cardiol 2010;106:694–700.
- Adams KF, Fonarow GC, Emerman CL, et al; ADHERE Scientific Advisory Committee and Investigators. Characteristics and outcomes of patients hospitalized for heart failure in the United States: rationale, design, and preliminary observations from the first 100,000 cases in the Acute Decompensated Heart Failure National Registry (ADHERE). Am Heart J 2005;149:209–216.
- Khoury J, Bahouth F, Stabholz Y, et al. Blood urea nitrogen variation upon admission and at discharge in patients with heart failure. ESC Heart Fail 2019;6:809–816.
- Miura M, Sakata Y, Nochioka K, et al. Prognostic impact of blood urea nitrogen changes during hospitalization in patients with acute heart failure syndrome. Circ J 2013;77:1221–1228.
- Kajimoto K, Sato N, Takano T; ATTEND investigators. eGFR and Outcomes in Patients with Acute Decompensated Heart Failure with or without Elevated BUN. Clin J Am Soc Nephrol 2016;11:405–412.
- Jujo K, Minami Y, Haruki S, et al. Persistent high blood urea nitrogen level is associated with increased risk of cardiovascular events in patients with acute heart failure. ESC Heart Fail 2017;4:545–553.
- Miura M, Sakata Y, Nochioka K, et al. Prognostic impact of blood urea nitrogen changes during hospitalization in patients with acute heart failure syndrome. Circ J 2013;77:1221–1228.
- Kategorie: Přehledové články
- Klíčová slova: biomarkery; kardiorenální syndrom; kyselina močová; srdeční selhání