Rekurentní fokálně segmentární glomeruloskleróza po transplantaci ledviny
Kazuistika popisuje příběh šestatřicetileté ženy s idiopatickým nefrotickým syndromem. Onemocnění jí bylo diagnostikováno v devíti letech, zpočátku ji léčili pediatři a první ataka byla zvládnuta glukokortikoidy. První relaps se rozvinul po dalších sedmi letech, poté ale relapsy recidivovaly a jevily známky kortikodependence. Toho času biopsie ledviny potvrdila nález minimálních změn. Další účinek kortikoidů byl však sporný, nepodařilo se již dosáhnout plné remise onemocnění.
Asi před patnácti lety byla pacientka předána do péče naší nefrologické ambulance, v té době měla plně rozvinutý nefrotický syndrom s odpadem bílkovin do moči asi 5 g/den, rovněž měla nežádoucí projevy chronické kortikoterapie (svalovou atrofii, facies lunata). Byla zahájena léčba cyklosporinem, následovalo postupné ukončení podávání kortikoidů a maximalizace symptomatické terapie proteinurie (inhibitory angiotenzin konvertujícího enzymu a blokátory receptoru AT1 pro angiotenzin II). Po osmi měsících léčby se podařilo navodit remisi. V dalším průběhu onemocnění se relapsy opakovaly a byly následovány pouze dočasnými či parciálními remisemi. Další komplikací byla plicní embolizace, kdy vzhledem k časové souvislosti nešlo vyloučit vliv přechodně podávané kortikoterapie. Ani kombinovaná imunosuprese (cyklosporin + mykofenolát mofetil) nebyla dostatečně účinná a měla pouze přechodný vliv, nadále přetrvávala nefrotická proteinurie (3–4 g/den). Její další progrese byla indikací k rebiopsii, která verifikovala fokálně segmentární glomerulosklerózu (FSGS). V té době bylo pacientce 29 let. Kombinovaná imunosuprese v podání takrolimu a mykofenolát mofetilu byla taktéž bez kýženého účinku.
Po 20 letech onemocnění se postupně začaly zhoršovat funkční parametry ledvin, nikdy však nebyly naměřeny toxické hodnoty takrolimu či cyklosporinu. Ve svých 33 letech pacientka dospěla do predialyzačních hodnot dusíkatých katabolitů a byla připravována k preemptivní transplantaci ledviny. V dalších měsících došlo k prudkému zhoršení funkce bez zjevné vyvolávající příčiny, což si vyžádalo zahájení dialyzační terapie cestou permanentního katétru.
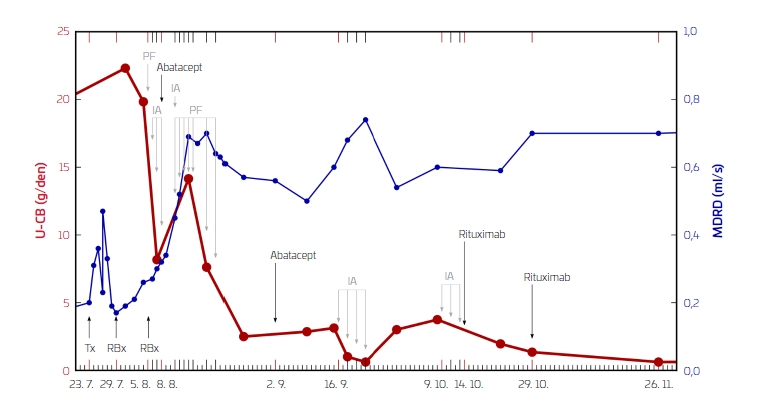
Měsíc po zahájení hemodialýzy jí byla nabídnuta ledvina od nejvhodnějšího zemřelého dárce (muž, ročník 1994, kraniotrauma; krevní skupina AB, PRA: 0 %, index kompatibility: 23). Samotná transplantace proběhla bez komplikací. Byl zvolen imunosupresivní protokol zahrnující takrolimus, mykofenolát mofetil a glukokortikoid. Již v prvních hodinách po transplantaci měla pacientka hojnou diurézu s poklesem koncentrace dusíkatých katabolitů. Následně došlo k poklesu diurézy prakticky do anurie. Hyperkalemie si vyžádala provedení dialýzy. Sonografický i scintigrafický nález byl příznivý. Biopsie (šestý den po transplantaci) verifikovala nález těžké akutní tubulární nekrózy (ATN), bez známek rejekce, toxicity či rekurence FSGS. Ani klinicky nebyly v této fázi jasné známky rekurence, proteinurie byla detekovatelná již před transplantací z vlastních ledvin. Od sedmého dne se rozvinula mohutná diuréza, regredovaly známky retence tekutin, zvolna klesala koncentrace kreatininu v séru, avšak proteinurie progredovala z původních 6 g/den na 20 g/den. Vzhledem k aktuální diuréze byl pravděpodobným zdrojem právě transplantovaný štěp. Rebiopsie (13. den po transplantaci) ozřejmila výrazně reparovanou ATN a potvrdila podezření na rekurující FSGS. S ohledem na předpokládanou vyšší účinnost jsme při volbě aferetické metody zpočátku dali přednost imunoadsorpci (Immunosorba – protein A), avšak pro její nejistý účinek jsme posléze pokračovali v plazmaferézách. Vzhledem k absenci rychlého zlepšení jsme přistoupili k záchranné terapii abataceptem (16. den po transplantaci, 10 mg/kg). Funkce štěpu se postupně upravila a byla také v dalším průběhu stabilní (koncentrace kreatininu v séru se pohybovala kolem 140–150 µmol/l), nadále přetrvávala proteinurie a klesala jen velmi pozvolna (2 g/den). S měsíčním odstupem byla podána druhá dávka abataceptu (42. den po transplantaci). I přesto došlo k relapsu s proteinurií 3 g/den. Opětovně jsme zahájili sérii imunoadsorpcí s následnou remisí (0,6 g/den). Při ambulantní kontrole týden po dimisi byla opět detekovatelná proteinurie s jasným relapsem necelý měsíc poté (3,5 g/den).
Další série imunoadsorpcí byla zakončena záchrannou léčbou rituximabem (83. a 97. den po transplantaci, à 1 000 mg). Průběh léčby po transplantaci u naší pacientky a její efekt na funkční parametry ledvin a proteinurii je znázorněn na obr. 1.
V dalším průběhu byla zaznamenána proteinurie se setrvalým poklesem, tři měsíce od transplantace byla menší než 1 g/den. Nadále je pacientka prakticky bez proteinurie (do 0,3 g/den) až doposud, tedy 2,5 roku po transplantaci. Pacientka je ve velmi dobrém klinickém stavu a má dlouhodobě stabilní funkci štěpu (koncentrace kreatininu v séru se pohybují kolem 100–120 µmol/l).
Lze spekulovat, který z léčebných postupů byl tím zásadním, či zda byla účinná právě jejich kombinace, tj. kombinace imunoadsorpcí, abataceptu a rituximabu.
Komentář
Literatura
- Choy BY, Chan TM, Lai KN. Recurrent glomerulonephritis after kidney transplantation. Am J Transplant 2006;6:2535–2542.
- Hickson LJ, Gera M, Amer H, et al. Kidney transplantation for primary focal segmental glomerulosclerosis: outcomes and response to therapy for recurrence. Transplantation 2009;87:1232–1239.
- Briganti EM, Russ GR, McNeil JJ, et al. Risk of renal allograft loss from recurrent glomerulonephritis. N Engl J Med 2002;347:103–109.
- Sharma M, Sharma R, McCarthy ET, Savin VJ. “The FSGS factor:” enrichment and in vivo effect of activity from focal segmental glomerulosclerosis plasma. J Am Soc Nephrol 1999;10:552–561.
- Sharma M, Sharma R, Reddy SR, et al. Proteinuria after injection of human focal segmental glomerulosclerosis factor. Transplantation 2002;73:366–372.
- Alachkar N, Weis C, Arend LJ, et al. Podocyte effacement closely links to suPAR levels at time of posttransplantation focal segmental glomerulosclerosis occurrence and improves with therapy. Transplantation 2013;96:649–656.
- Wei C, El Hindi S, Li J, et al. Circulating urokinase receptor as a cause of focal segmental glomerulosclerosis. Nat Med 2011;17:952–960.
- Audard V, Kamar N, Sahali D, et al. Rituximab therapy prevents focal and segmental glomerulosclerosis recurrence after a second renal transplantation. Transplant Int 2012;25:e62–e66.
- Gonzalez E, Ettenger R, Rianthavorn P, et al. Preemptive plasmapheresis and recurrence of focal segmental glomerulosclerosis in pediatric renal transplantation. Pediatr Transplant 2011;15:495–501.
- Meyer TN, Thaiss F, Stahl RA. Immunoadsorption and rituximab therapy in a second living – related kidney transplant patient with recurrent focal segmental glomerulosclerosis. Transplant Int 2007;20:1066–1071.
- Gohh RY, Yango AF, Morrissey PE, et al. Preemptive plasmapheresis and recurrence of FSGS in high‑risk transplant recipients. Am J Transplant 2005;5:2907–2912.
- Apeland T, Hartmann A. Rituximab therapy in early recurrent focal segmental sclerosis after renal transplantation. Nephrol Dial Transplant 2008.23:2091–2094.
- Dello Strologo L, Guzzo I, Laurenzi C, et al. Use of rituximab in focal glomerulosclerosis relapses after renal transplantation. Transplantation 2009;88:417–420.
- Yu CC, Fornoni A, Weins A, et al. Abatacept in B7‑1‑positive proteinuric kidney disease. N Engl J Med 2013;369:2416–2423.
- Alachkar N, Carter‑Monroe N, Reiser J. Abatacept in B7‑1‑positive proteinuric kidney disease. N Engl J Med 2014;370:1263–1264.
- Garin EH, Reiser J, Cara‑Fuentes G, et al. Case series: CTLA4‑IgG1 therapy in minimal change disease and focal segmental glomerulosclerosis. Pediatr Nephrology 2015;30:469–477.
- Delviller M, Baye E, Durrbach A, et al. B7‑1 blockade does not improve post‑transplant nephrotic syndrome caused by recurrent FSGS. J Am Soc Nephrol 2016;27:2520–2527.
- http://maxdorf.cz/caste‑chyby.
- Kategorie: Kazuistiky
- Klíčová slova: glomeruloskleróza; kazuistika; transplantace ledvin
Vždy zažíváme obavy o osud pacienta, jehož základní diagnózou je fokálně segmentární glomeruloskleróza a u něhož provádíme indikaci k transplantaci ledviny. Naše zkušenosti z minulosti nejsou příliš povzbudivé. I když je transplantovaná ledvina funkční, nemocní často prožívají mnoho útrap, které jsou spojeny jak s recidivou nefrotického syndromu, tak i s komplikacemi léčby, která je dosti složitá a také nebezpečná. Předložená kazuistika ukazuje na možnou lepší perspektivu těchto pacientů po transplantaci.
Epidemiologické studie, které se týkají frekvence rekurence, jsou zatíženy chybami. Podle různých zdrojů dochází k rekurenci fokálně segmentární glomerulosklerózy po transplantaci ve 30 % (20–50 %) případů. Předpokládá se však, že mezi pacienty zařazenými do studií je mnoho těch, kteří mají sekundární formu fokálně segmentární glomerulosklerózy (geneticky podmíněnou, dále způsobenou hyperfiltračním mechanismem při redukci počtu funkčních nefronů či s předpokládaným toxickým a virovým původem).
Sekundární formy obvykle nemají tendenci k rekurenci, výjimkou mohou být některé familiárně podmíněné formy (popsány u některých forem mutace podocinu, výjimečně u jiných geneticky podmíněných podocytopatií).
Lze vytipovat nemocné s vyšší pravděpodobností postižení štěpu. Jsou to ti, jejichž choroba byla aktivní ještě bezprostředně před transplantací, u nich riziko dosahuje až 80 %. Problém lze očekávat u pacientů, u nichž došlo k rychlé progresi renální dysfunkce (do stadia CKD 5 za dobu kratší než tři roky). Také vznik choroby v dětství představuje větší nebezpečí. Rozpoznán byl i morfologický faktor rizika rekurence, tím je přítomnost mezangiální proliferace. Bylo zjištěno, že rekurencí bývají méně často postiženi nemocní, kterým byl podán antithymocytární globulin jako součást indukční imunosuprese. Protektivní účinek však nebyl pozorován při použití alemtuzumabu či anti IL‑2R monoklonálních protilátek v indukci. To platí i v případě rekurencí jiných glomerulonefritid po transplantaci.
V případě primární fokálně segmentární glomerulosklerózy je pravděpodobnou vyvolávající příčinou cirkulující faktor způsobující zvýšenou permeabilitu. Tento faktor je tedy také asi zodpovědný za rekurenci. Nejvíce podezřelým je solubilní receptor pro urokinázu (suPAR). Je však možné, že jsou i jiné cirkulující faktory.
Byla vypracována pravidla (Kidney Disease: Improving Global Outcomes, KDIGO), jak postupovat v časném potransplantačním období, abychom včas rozpoznali rekurenci. Data ukazují, že čím dříve jsou léčebné postupy při rekurenci zahájeny, tím jsou účinnější. Proteinurie se vyšetřuje kvantitativně v prvním týdnu denně, další čtyři týdny vždy alespoň jednou týdně. Pak již v prvním roce každé tři měsíce. Obvykle se problém objeví velmi časně po transplantaci, skoro vždy do čtyř týdnů, rekurence, jež vznikla později než za rok po transplantaci, ukazuje nejspíše na sekundární fokálně segmentární glomerulosklerózu. Typická je výrazná proteinurie, avšak někdy je obtížné posoudit, zda jde o ztráty z vlastních ledvin (se zachovanou diurézou), či ze štěpu. Pro tyto případy by mohl být užitečný průkaz apolipoproteinu A1 v moči.
Obecně, jsou‑li použitelná preventivní opatření, představují ideální postup. Použití antithymocytárního globulinu v rámci indukční fáze imunosuprese by mohlo být považováno za vhodný postup. Nadějné je použití rituximabu v prevenci. Jeho podání snížilo procento rekurencí a vedlo k poklesu proteinurie a ke zvýšení glomerulární filtrace. Rituximab může zabránit rekurenci u nejrizikovější skupiny – u nemocných po předchozí ztrátě štěpu vlivem rekurence. Preventivní plazmaferéza má nejistý účinek.
Pro léčbu nemáme oporu v randomizované studii. V nekontrolovaných studiích plazmaferéza (podle možností pracoviště případně imunoadsorpce) vede ke snížení proteinurie a zlepšení glomerulární filtrace. Čím dříve se s plazmaferézou začne, tím lepší jsou výsledky. Po iniciálním zlepšení je však často nutné plazmaferézu v dalším potransplantačním období opakovat. Studie s menším počtem dětských pacientů ukazují na možný přínos cyklofosfamidu. Ten byl podáván místo mykofenolát mofetilu či azathioprinu. Tito dětští pacienti byli léčeni současně plazmaferézou. Ve starších studiích byly používány vyšší dávky cyklosporinu intravenózně či perorálně s částečným účinkem. Také vysoké dávky kortikoidů mohou vést k remisi nefrotického syndromu, ale po snižování dávky dochází velmi často k relapsům.
Rituximab byl účinný (v menších studiích) u nemocných rezistentních na léčbu plazmaferézou. Novou možností jsou takzvané záchranné postupy. Patří k nim použití abataceptu a belataceptu. Oba uvedené léky představují fúzní proteiny (Fc fragment Ig + CTLA4), blokují aktivaci T lymfocytů (neumožní kostimulační signál). Tyto látky se navazují na CD80 (nazývaný také B7‑1, který se nachází na povrchu antigen prezentující buňky). U některých nemocných s fokálně segmentární glomerulosklerózou je B7‑1 výrazně exprimován na podocytech a tam poškozuje funkci integrinu. Léčba těmito záchrannými léky byla úspěšná spíše tam, kde byl CD80 (resp. B7‑1) přítomen při imunohistochemickém vyšetření glomerulů. U úspěšně léčených nemocných šlo o ty, kteří nereagovali na předchozí terapii rituximabem.
Naše nemocná byla vysoce riziková z hlediska rekurence. Předmětem diskuse může být intenzita indukční imunosuprese. Většina pracovišť však rituximab či plazmaferézu v těchto případech profylakticky neužívá. Problémem je také nemožnost identifikovat, který z postupů (či kombinace) vedl k navození remise. Zajímavé by mohlo být (v kontextu posouzení vlivu abataceptu) vyšetření exprese CD80 na glomerulech, avšak imunohistochemické vyšetření tohoto znaku není běžně dostupné.
Nakonec terminologická poznámka. Používáme pojem segmentární, nikoliv segmentální, což je proti současnému trendu v naší nefrologické literatuře. Máme více důvodů takto postupovat. Termín segmentární používají i jiné lékařské obory. Mnozí naši významní autoři (Matoušovic, Rossmann) používají rovněž pojem segmentární. V neposlední řadě i webový slovník nakladatelství Maxdorf považuje námi zvolený postup za správný.