Transplantační tolerance 2011 – co je nového?
Transplantace orgánů, buněk nebo tkání se staly léčebnou metodou pro nemocné, kteří trpí konečnými stadii chronických, degenerativních a autoimunitních chorob postihujících ledviny, játra, srdce, plíce, střevo, ale jsou také možností léčby hematologických onemocnění a diabetu. Léčba konečného stadia chronických onemocnění je spojena s enormními ekonomickými náklady. Úspěch transplantací závisí na úspěšné prevenci a léčbě rejekce transplantovaného orgánu. Imunosuprese, která se úspěšně používá ke zvládnutí akutní rejekce, ale většinou selhává při kontrole chronické rejekce. Bohužel změny chování imunitního systému nutné ke kontrole akutní rejekce jsou spojeny se zvýšením rizika vzniku nádorů, oportunních infekcí i kardiovaskulárních komplikací.
Transplantační tolerance je definována jako trvalé přijetí štěpu bez dlouhodobé imunosuprese. Tento stav ale zatím v klinické praxi dosažen nebyl, nehledě na úsilí vědecko‑výzkumných konsorcií v EU RISET (Reprogramming of Immune System for Establishing Tolerance; www.risetfp6.org) a globální ITN (Immune Tolerance Network). Jako možné se ale jeví minimalizovat imunosupresi. K tomu, aby minimalizace byla bezpečná, je nutné mít k dispozici takové testy, které odhalí probíhající alloimunitní odpověď. K tomu je ale nutné poznat buněčnou a molekulární úroveň chování imunitního systému po transplantacích. Imunitní buňky jsou nezbytné nejenom pro zprostředkování rejekce, ale na druhou stranu jsou odpovědné i za zprostředkování tolerance. T a B lymfocyty, stejně tak jako dendritické buňky a makrofágy, mají tzv. regulační účinky (Dugast a Vanhove, 2009).
Přirozeně se vyskytující regulační T lymfocyty (Treg) jsou nepochybně spojeny s indukcí a udržením transplantační tolerance. Tyto buňky exprimují znaky CD4+ a CD25+ na membráně a také transkripční faktor FoxP3 v cytoplazmě, který je nezbytný pro diferenciaci těchto buněk (Veronese et al., 2007; Malloy et al., 2003). Přirozeně se vyskytující Treg jsou důležité pro udržení tolerance k autoantigenům v různých modelech autoimunit (Waldmann et al., 2006). V experimentech se ukazuje, že pro navození tolerance je důležitější posun poměru regulačních a efektorových buněk na stranu regulačních T lymfocytů než absolutní eliminace všech efektorových buněk (Louis et al., 2006; Waldmann et al., 2010) (obr. 1).
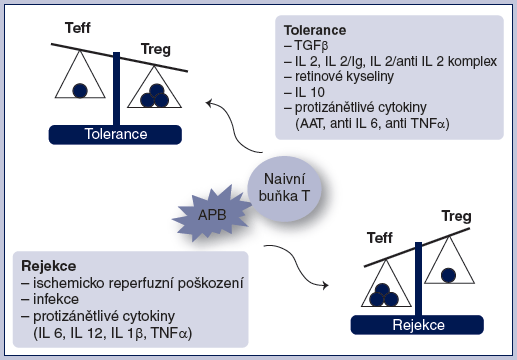
Obr. 1
Působením různých mediátorů a činitelů po kontaktu antigen
prezentujících buněk s naivními T lymfocyty se naivní T buňky
konvertují na Treg a Teff lymfocyty.
V důsledku posunu rovnováhy na stranu Treg nebo Teff lymfocytů
dochází buď k rejekci, nebo k imunitní neodpovídavosti.
AAT - α1-antitrypsin (proteázový inhibitor); APB -
antigen prezentující buňka
Regulační T lymfocyty mohou být indukovány také in vitro během stimulace T lymfocytů alloantigeny za přítomnosti transformujícího růstového faktoru β1 (TGFβ1). Po transferu do těla příjemce jsou pak schopny udržet transplantační toleranci. Zatím byly publikovány jenom částečné úspěchy s tímto přístupem. I když u tolerantních pacientů Treg přesvědčivě nevykazují zvýšenou schopnost regulace alloantigenní odpovědi (Sagoo et al., 2010; Braudeau et al., 2007), v současnosti začala probíhat v některých evropských centrech první studie (The One Study) s cílem ověřit u nemocných po transplantaci bezpečnost podaných vlastních Treg. V současnosti používaná depleční imunosuprese (antithymocytární globulin, anti-CD52) více indukuje novotvorbu Treg, ale na druhou stranu je zodpovědná za tzv. homeostatickou proliferaci, kdy paměťové lymfocyty rezistentní k účinku výše uvedených deplečních protilátek jsou odpovědné za častější vznik humorálních rejekcí (Morelon et al., 2010).
Zřejmě daleko větší imunosupresivní potenciál mají mesenchymální kmenové buňky. Tyto buňky mohou být získány v dostatečném množství z kostní dřeně a mají schopnost inhibovat buněčnou proliferaci indukovanou alloantigenem a inhibovat produkci cytokinů, a potlačovat tak autoimunitní a transplantační reakce in vivo. Protože mesenchymální kmenové buňky produkují velké množství TGFβ1 nezbytného k aktivaci regulačních T lymfocytů, je možné vysvětlení imunosupresivního účinku mesenchymálních kmenových buněk právě v indukci lymfocytů Treg (Aggarwal a Pittenger, 2005; Maccario et al., 2005; Augello et al., 2007). Tato pozorování předpokládají, že indukce Treg může být jedním z mechanismů, jak mesenchymální kmenové buňky fungují. Například bylo dokázáno, že transfer mesenchymálních kmenových buněk potlačuje autoimunitu (Augello et al., 2007), prodlužuje přežití kožních štěpů u potkanů (Aksu et al., 2008) nebo u opic (Bartholomew et al., 2002) a indukuje trvalé přijetí allogenních Langerhansových ostrůvků u myší (Ding et al., 2010).
Podobně vedla kombinovaná léčba mesenchymálními kmenovými buňkami a cyklosporinem A k významnému prodloužení přežití kožních alloštěpů u potkana a končetiny u prasete (Shano et al., 2008; Kuo et al., 2009). Infuze s mesenchymálními kmenovými buňkami a rapamycinem snížila alloimunitní odpověď a navodila trvalou toleranci vůči srdečnímu štěpu u myší (Ge et al., 2009).
Makrofágy představují heterogenní populaci buněk s odlišnými funkcemi, jako jsou fagocytóza a zabíjení mikroorganismů, cytotoxická protinádorová aktivita a uvolňování řady zánětlivých, protizánětlivých a regulačních cytokinů (Geissmann et al., 2010). Bylo prokázáno, že určité subpopulace makrofágů jsou fyziologicky obsaženy v potlačení imunitní odpovědi ve fetoplacentárním systému (Nagamatsu a Schust, 2010). Specifické subpopulace makrofágů (tumor associated macrophage, TAM) mají zvláštní funkci potlačovat přirozenou obranyschopnost proti nádorům (Mantovani Sica, 2010). Makrofágy se také mohou účastnit procesů v navození transplantační tolerance. Tyto makrofágy již byly izolovány a podány nemocným po transplantaci jater a ledviny. Autoři je pojmenovali jako TAIC (transplant acceptance inducing cells). Přesná funkce těchto makrofágů není dosud jasná, ale jde o velmi atraktivní pole budoucího klinického výzkumu (Riquelme et al., 2009).
Vedle dobře popsaných regulačních funkcí některých imunitních buněk není jejich role in vivo za běžných klinických situací popsána. V současnosti se zdá, že vyšší exprese mRNA pro FoxP3 v moči nemocných s rejekcí nebo v protokolární biopsii je spojena s dobrou odpovědí na léčbu. Výzkum ale zatím probíhá a některé názory jsou protichůdné (Bunnag et al., 2008; Bestard et al., 2008). Existují ale i další nové biomarkery spojené s tolerancí. Molekula TOAG (tolerance associated antigen) byla častěji popsána v experimentu v tkáni tolerantních štěpů, ale i v periferní krvi (Sawitzki et al., 2007).
Ideální skupinou nemocných pro studium transplantační tolerance jsou nemocní, kteří si z různých důvodů sami vysadí imunosupresi. Někdy jde o nemocné s nádory a toto rozhodnutí je učiněno ošetřujícími lékaři, ale častěji jde o nespolupracující nemocné s problematickou sociální situací. Pátý rámcový projekt EU IOT (Indices of Tolerance) měl za úkol identifikovat potenciální biomarkery tolerance právě u nemocných po transplantaci ledviny, kteří si imunosupresi sami svévolně vysadili.
Recentní studie publikované v prestižních časopisech se zabývají právě chováním imunitního systému u nemocných, kteří přestali sami užívat imunosupresiva (Sagoo et al., 2010; Newell et al., 2010). Obě citované práce ukazují na to, že nemocní neužívající dlouhodobě imunosupresi mají odlišný transkriptom a populace B lymfocytů a jejich produktů. Je třeba podtrhnout, že neodpovídavost imunitního systému k alloantigenu je jenom dočasná a že při jakémkoli systémovém zánětu může dojít ke změně a následné rejekci, většinou humorální povahy, což jsme u jednoho z našich „tolerantních“ nemocných potvrdili.
„Tolerantní“ pacienti disponují vyšším počtem periferních B buněk než pacienti s chronickou rejekcí (Louis et al., 2006). Pallier a spol. ve své studii porovnali zastoupení B lymfocytů u tolerantních příjemců bez imunosuprese, se stabilní funkcí štěpu s udržovací imunosupresí, s chronickou rejekcí a zdravou populací jako kontrolní skupinou. Zjistili, že pacienti bez imunosuprese mají vyšší počet cirkulujících B buněk příslušejících fenotypově aktivovaným paměťovým buňkám. B lymfocyty pacientů bez imunosuprese měly v porovnání s pacienty s chronickou rejekcí nižší poměr CD32a/CD32b v důsledku zvýšení exprese CD32b. Poměr CD32a/CD32b je ukazatelem B‑buněčné aktivace/inhibice. Přesto B lymfocyty těchto pacientů nevykazovaly zvýšenou expresi interleukinu 10 a výsledky naznačují, že nejsou méně vnímavé k polyklonální aktivaci a neliší se aktivačními mechanismy od B lymfocytů ostatních pacientů (Pallier et al., 2010). Mnohé studie dokazují, že IL‑10 sehrává důležitou úlohu v navození tolerance. Zdá se, že v experimentech tvorba IL‑10 B lymfocyty může inhibovat toleranci navozenou B buňkami (Zhao et al., 2010). Tolerantní pacienti vykazují také vyšší expresi CD20+ B lymfocytů (Newell et al., 2010). Tento povrchový antigen se nachází na povrchu naivních B buněk, ale rovněž na paměťových B buňkách. Není zřejmé, jestli jde o subpopulaci naivních buněk, které mohou dávat vznik paměťovým a plazmatickým buňkám, nebo zda převažuje subpopulace paměťových buněk, které mohou být konvertovány na plazmatické buňky produkující protilátky (Stegall et al., 2010). K této konverzi jsou potřebné aktivované T lymfocyty. Současná imunosuprese blokuje aktivaci T buněk, což by se přiklánělo k vysvětlení, že jde o vyšší zastoupení naivních B buněk.
Bližší identifikace nových biomarkerů tolerance stejně jako nových populací regulačních buněk může představovat naději pro budoucí transplantologický výzkum. Pokud bychom uměli nalézt nemocné, kteří vykazují tolerantní znaky ať už v krvi, moči nebo biopsii, bylo by možné bezpečně snižovat imunosupresi až k minimálním dávkám. Takovýto přístup by znamenal nejenom ekonomickou úsporu, ale i snížení rizik vzniku komplikací spojených s imunosupresivní léčbou. Podobně transfer regulačních lymfocytů, makrofágů nebo mesenchymálních kmenových buněk může představovat novou možnost buněčné terapie. Tyto postupy ale musejí být ověřeny v prospektivních randomizovaných studiích, které jedině mohou potvrdit naděje vkládané do těchto inovativních přístupů.
Literatura
- Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood 2005;105:1815–1822.
- Aksu AE, et al. Co‑infusion of donor bone marrow with host mesenchymal stem cells treats GVHR and promotes vascularized skin allograft survival in rats. Clin Immunol 2008;127:346–358.
- Augello A, et al. Cell therapy using allogeneic bone marrow mesenchymal stem cells prevents tissue damage in collagen‑induced arthritis. Arthritis Rheum 2007;56: s1175–1179.
- Bartholomew A, et al. Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo. Exp Hematol 2002;30:42–48.
- Bestard O, et al. Presence of FoxP3+ regulatory T cells predicts outcome of subclinical rejection of renal allografts. J Am Soc Nephrol 2008;19:2020–2026.
- Braudeau C, et al. Variation in numbers of CD4+CD25highFOXP3+ T cells with normal immuno‑regulatory properties in long‑term graft outcome. Transpl Int 2007; 20:845–855.
- Bunnag S, et al. FOXP3 expression in human kidney transplant biopsies is associated with rejection and time post transplant but not with favorable outcomes. Am J Transplant 2008;8:1423–1433.
- Ding Y, et al. Mesenchymal stem‑cell immunosuppressive capabilities: therapeutic implications in islet transplantation. Transplantation 2010;89:270–273.
- Dugast AS, Vanhove B. Immune regulation by non‑lymphoid cells in transplantation. Clin Exp Immunol 2009;156:25–34.
- Ge W, et al. Infusion of mesenchymal stem cells and rapamycin synergize to attenuate alloimmune responses and promote cardiac allograft tolerance. Am J Transplantation 2009;9:1760–1772.
- Geissmann F, et al. Development of monocytes, macrophages, and dendritic cells. Science 2010;327:656–661.
- Kuo Y‑R, et al. Mesenchymal stem cells prolong composite tissue allotransplant survival in a swine model. Transplantation 2009;87:1769–1777.
- Louis S, et al. Contrasting CD25hiCD4+T cells/FOXP3 patterns in chronic rejection and operational drug‑free tolerance. Transplantation 2006;81:398–407.
- Maccario R, et al. Interaction of human mesenchymal stem cells with cells involved in alloantigen‑specific immune response favors the differentiation of CD4+ T‑cell subsets expressing a regulatory/suppressive phenotype. Haematologie 2005;90:516–525.
- Malloy KJ, et al. CD4+CD25+ T(R) cells suppress innate immune pathology through cytokine‑dependent mechanisms. J Exp Med 2003;197:111–119.
- Mantovani A, Sica A. Macrophages, innate immunity and cancer: balance, tolerance, and diversity. Curr Opin Immunol PMID:20144856.
- Morelon E, et al. Preferential increase in memory and regulatory subsets during T‑lymphocyte immune reconstitution after thymoglobulin induction therapy with maintenance sirolimus vs cyclosporine. Transpl Immunol 2010;23:53–58.
- Nagamatsu T, Schust DJ. The immunomodulatory roles of macrophages at the maternal‑fetal interface. Reprod Sci 2010;17:209–218.
- Newell KA, et al. Identification of a B cell signature associated with renal transplant tolerance in humans. J Clin Invest 2010;120:1836–1847.
- Pallier A, et al. Patients with drug‑free long‑term graft function display increased numbers of peripheral B cells with a memory and inhibitory phenotype. Kidney Int 2010;78:503–513.
- Riquelme P, et al. Human transplant acceptance‑inducing cells suppress mitogen‑stimulated T cell proliferation. Transpl Immunol 2009;21:162–165.
- Sagoo P, et al. Development of a cross‑platform biomarker signature to detect renal transplant tolerance in humans. J Clin Invest 2010;120:1848–1861.
- Sawitzki B, et al. Identification of gene markers for the prediction of allograft rejection or permanent acceptance. Am J Transplant 2007;7:1091–1102.
- Shano P, et al. Use of bone marrow mesechymal stem cells for treatment of skin allograft rejection in a preclinical model. Arch Dermatol Res 2008;300:115–124.
- Stegall MD, et al. The (re)emergence of B cells in organ transplantation. Curr Opin Organ Transplant 2010;15:451–455.
- Veronese F, et al. Pathological and clinical correlates of FOXP3+ cells in renal allografts during acute rejection. Am J Transplant 2007;7:914–922.
- Waldmann H, et al. Regulatory T cells in transplantation. Semin Immunol 2006;18:111–119.
- Waldmann H. Tolerance: an overview and perspectives. Nat Rev Nephrol 2010; 6:569–576.
- Zhao G, et al. An unexpected counter‑regulatory role of IL‑10 in B‑lymphocyte‑mediated transplantation tolerance. Am J Transplant 2010;10:796–801.
- Kategorie: Novinky v nefrologii
- Klíčová slova: transplantace ledvin