Lékové interakce u pacientů s onemocněním ledvin
Souhrn
Přehledový článek o lékových interakcích je určen ambulantním specialistům a praktickým lékařům, kteří se ve své klinické praxi setkávají s pacienty s onemocněním ledvin. Článek se věnuje lékovým interakcím, na jejichž průběh a klinický výsledek mají vliv snížené renální funkce. Jedná se např. o interakce léčiv s duální (jaterní i renální) eliminací s inhibitory jaterních enzymů. Výsledek interakce bude u pacientů se sníženou renální eliminací výraznější, protože renální cesta nemůže kompenzovat zablokovanou jaterní eliminaci. Dále jsou popsány interakce s inhibitory jaterního metabolismu, které se vylučují renálně, především s flukonazolem. Vzhledem k vyšším plazmatickým koncentracím a pomalejší eliminaci flukonazolu se budou interakce s tímto azolovým antimykotikem u pacientů s renální insuficiencí projevovat silněji a bude déle trvat, než odeznějí. Třetí skupinou popsaných interakcí jsou interakce léčiv předepisovaných nefrologem, např. vazačů fosfátů, kalcineurinových inhibitorů, inhibitorů mTOR a azathioprinu.
Klíčová slova: azathioprin – flukonazol – kalcineurinové inhibitory – lékové interakce – NOAC – renální insuficience – sevelamer – vazače fosfátů
Přehledový článek o interakcích je určen ambulantním specialistům a praktickým lékařům, kteří se ve své klinické praxi setkávají s pacienty s onemocněním ledvin. Zmíněny jsou nejčastější interakce specifické pro tuto skupinu pacientů, se kterými se lékaři mohou setkat v ambulantní sféře. Nejsou uváděny inkompatibility infuzních roztoků (farmaceutické inkompatibility) a interakce s léčivy podávanými převážně v nemocničním prostředí. Cílem přehledu je ilustrovat možné přístupy k řešení lékových interakcí u této specifické skupiny pacientů. V konkrétních případech lze podle potřeby kontaktovat klinického farmaceuta nebo farmakologa. V klinické praxi se vyskytují kromě chemicko‑fyzikálních inkompatibilit dva typy lékových interakcí – farmakodynamické a farmakokinetické. Farmakodynamické interakce vycházejí ze synergického nebo antagonistického mechanismu účinku jednotlivých léčiv. Jsou predikovatelné na základě znalosti mechanismu účinku léčiv a v tomto textu se jim nevěnujeme. Farmakokinetické interakce, kterým se zde budeme věnovat podrobněji, spočívají v tom, že jedno léčivo ovlivňuje pohyb druhého léčiva v těle. Ve většině případů se týkají metabolizace léčiv jaterními enzymy. Na první pohled se tedy může zdát, že v tomto ohledu nebude u pacientů s renální insuficiencí velký rozdíl oproti pacientům s normálními renálními funkcemi. Některé interakce se však mohou právě u těchto pacientů projevit daleko výrazněji. Jsou to především interakce léčiv s duální eliminací (eliminací játry i ledvinami) a interakce s inhibitory/induktory jaterního metabolismu, které jsou vylučovány renálně, a mají tak u pacientů s renální insuficiencí delší poločas. Dále uvedeme přehled interakcí s léčivy často předepisovanými pacientům s onemocněním ledvin, jako jsou např. vazače fosfátů, kalcineurinové inhibitory, inhibitory mTOR a azathioprin.
Nová perorální antikoagulancia – příklad interakcí léčiv s duální eliminací
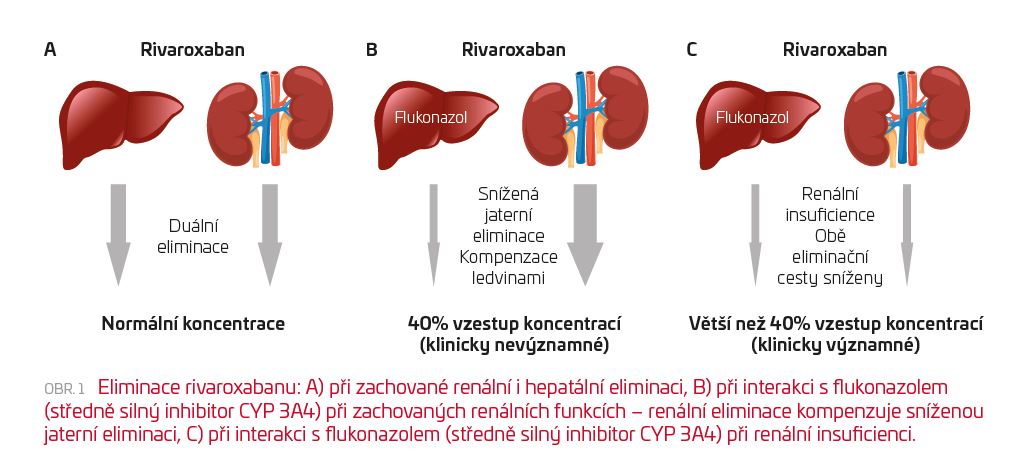
Pokud je léčivo eliminováno jak renálně, tak hepatálně, dochází při zablokování jedné eliminační cesty ke kompenzačnímu zvýšení eliminace cestou druhou. Například při zablokování jaterní eliminace rivaroxabanu (Xarelto®) enzymovým inhibitorem, jako je flukonazol (Mycomax®), dochází ke zvýšení renální eliminace a výsledný vzestup plazmatických koncentrací bude pouze malý (v tomto případě o 40 %). Proto souhrn údajů o přípravku (SPC) uvádí interakci rivaroxabanu s flukonazolem (400 mg/den) nebo klaritromycinem (500 mg 2× denně) jako klinicky nevýznamnou.1 Evropská léková agentura (EMA) však v roce 2018 doporučila změnu této formulace s uvedením, že tyto interakce mohou nabývat na významu u vysoce rizikových pacientů.2 Takovými pacienty jsou právě pacienti s renální insuficiencí. Studie, které ukazují, že při současném podávání flukonazolu/klaritromycinu a rivaroxabanu stoupají koncentrace pouze přibližně o polovinu, byly totiž provedeny u dobrovolníků s normálními funkcemi ledvin.3 Pokud má však pacient renální insuficienci, nemůže se v případě zablokování jaterní eliminace kompenzatorně zvýšit eliminace renální, a interakce tak nabývá na významu (viz obr. 1).
K tomu může v případě flukonazolu přispět ještě prodloužený poločas tohoto azolového antimykotika při renální insuficienci, který vede ke zvýšení jeho plazmatických koncentrací, takže flukonazol nakonec způsobí daleko silnější inhibici než u pacientů s normálními funkcemi ledvin (viz níže). Tabulka 1 uvádí seznam silných inhibitorů CYP3A4. Léčivy, kterých se tato problematika může týkat, jsou především nová perorální antikoagulancia (rivaroxaban, apixaban [Eliquis®], edoxaban [Lixiana®], dabigatran [Pradaxa®]), která mají nízký terapeutický index (tzn. je malý rozdíl mezi terapeutickou a toxickou dávkou). U bezpečnějších léků s duální eliminací (fosinopril, rosuvastatin,…) probíhají podobné farmakokinetické změny, nicméně s malým klinickým významem.
Záměrně se zde nezabýváme interakcemi s induktory metabolismu léčiv. Lze předpokládat, že tyto lékové interakce budou probíhat u pacientů s renální insuficiencí v zásadě podobně jako u celkové populace, případně bude indukce metabolismu vyrovnávat sníženou renální eliminaci.
Flukonazol – příklad inhibitoru CYP 3A4, který je eliminován renálně
Interakce mezi azolovými antimykotiky a imunosupresivy jsou v literatuře obsáhle popisovány.4 Flukonazol má v rámci skupiny azolových antimykotik nejmenší interakční potenciál (je slabším inhibitorem CYP 3A4 než itrakonazol a vorikonazol a neinhibuje P‑glykoprotein).4,5 Problém nastává opět při renální insuficienci. Flukonazol má při normálních renálních funkcích poločas 30 hodin a je z 80 % eliminován renálně v nezměněné podobě, což je mezi azolovými antimykotiky ojedinělá vlastnost.1 V případě renální insuficience se poločas výrazně prodlužuje: při poklesu clearance kreatininu (Clcr) na hodnoty kolem 40 ml/min na cca 80 hodin a při snížení Clcr na 15 ml/min až na 100 hodin.6 Pokud tedy při léčbě flukonazolem neupravíme dávky, koncentrace léčiva při pravidelném podávání postupně stoupají a až 16. den mohou dosáhnout ustáleného stavu. Důležité je si uvědomit, že stejně dlouho trvá, než se flukonazol vyloučí z těla po ukončení terapie. Výsledkem je silná inhibice CYP 3A4, která navíc trvá déle, než bychom očekávali (může to být i týdny po přerušení terapie).
Při terapii flukonazolem výrazně stoupají např. koncentrace cyklosporinu (Sandimmun®, Equoral®). Při podávání 200 mg flukonazolu denně je popsána téměř dvojnásobná expozice cyklosporinu.1,7 V případě dávkování flukonazolu 400 mg/den je třeba preemptivně snížit dávky tohoto imunosupresiva minimálně o 50 % a dále monitorovat koncentrace, protože snížení nemusí být dostatečné a koncentrace mohou postupně stoupat se stoupajícími koncentracemi flukonazolu. Po vysazení flukonazolu dochází u pacientů s renální insuficiencí k pomalému poklesu jeho koncentrací a interakce s cyklosporinem slábne a pozvolna odeznívá několik týdnů. V tomto období naopak hrozí, že pacient bude cyklosporinem poddávkován, a je třeba postupně navyšovat dávky na původní hodnoty. Tuto interakci je třeba mít na paměti při používání jakýchkoliv substrátů CYP 3A4 spolu s flukonazolem. U takrolimu (Prograf®, Advagraf®, Envarsus® atd.) lze očekávat ještě výraznější změny hodnot než u cyklosporinu.8 Dále při terapii flukonazolem stoupají koncentrace fentanylu (Durogesic®) a buprenofrinu (Transtec®). Riziko nastává především u pacientů, kteří užívají dlouhodobě vytitrované dávky opioidů, jsou na terapii dobře adaptováni a mohou vykonávat složité činnosti vyžadující soustředění (obsluhovat stroje, řídit motorová vozidla atd.). Po zahájení léčby flukonazolem koncentrace opioidu stoupnou a mohou se projevit sedativní nežádoucí účinky.9 Tyto interakce se v různé míře projevují i u inhibitorů mTOR (sirolimus [Rapamune®] a everolimus [Afinitor®]), které jsou vzácně využívány v transplantologii, případně v onkologii.10 Všechna uvedená léčiva interagují i s ostatními léčivy uvedeným v tabulce 1, zde však je možno aplikovat zkušenosti z celkové populace.
Interakce se specifickou nefrologickou terapií
Samostatnou kapitolou jsou interakce s vazači fosfátů. U všech těchto léčiv je třeba mít na paměti, že aby byla schopna vyvázat negativně nabité fosfátové anionty z potravy, musejí nést kladný náboj, a mohou tedy kromě fosfátů vázat i další anionty včetně molekul léčiv. Je v obecném povědomí, že doxycyklin, případně fluorochinolony nemají být podávány společně se substitucí vápníku. To samé však platí i pro léčbu sevelamerem (Renvela®, Renagel®) či vazači fosfátu na bázi vápenatých, železitých (Velphoro®) či lanthanitých (Fosrenol®) iontů. Například koncentrace ciprofloxacinu při terapii sevelamerem klesají zhruba o polovinu.11 Přes tento velký interakční potenciál jsou další interakce s vazači fosfátů relativně málo popsány. Kazuisticky bylo popsáno významné snížení koncentrací cyklosporinu12 a takrolimu13 při současné terapii sevelamerem. V takovém případě je třeba vždy kontrolovat plazmatické koncentrace imunosupresiv, aby nedošlo k poddávkování. Rovněž však může nastat nebezpečná situace při vysazování vazačů fosfátů, kdy bez úpravy dávkování může dojít k výraznému vzestupu koncentrací těchto léčiv. Dalším potenciálně ovlivněným léčivem je furosemid. Vzhledem k nízkému pKa (záporný dekadický logaritmus disociační konstanty kyseliny/zásady při teplotě 25 °C) furosemidu se jedná o kyselinu, která v gastrointestinálním traktu disociuje za vzniku aniontu, který může být vázán sevelamerem. Byla popsána kazuistika, kdy pacientka při zahájení terapie sevelamerem přišla o reziduální diurézu, která byla udržována furosemidem, a po přerušení léčby sevelamerem ji opět obnovila (potvrzeno opakovaným nasazením a vysazením sevelameru). Terapie byla následně nastavena tak, že pacientka užila celou dávku furosemidu ráno a sevelamer pouze v poledne a večer.14 To rovněž naznačuje, jak zvládnout interakci na úrovni vstřebávání: léčiva, která se mohou vzájemně vysrážet, je třeba podávat s odstupem alespoň dvou hodin od sebe. Naopak máme poměrně dobré důkazy o tom, že sevelamer neovlivňuje vstřebávání enalaprilu, metoprololu,15 digoxinu a warfarinu.16
Další skupinou léčiv, která jsou často používána při terapii nefrologických onemocnění nebo u pacientů po transplantaci ledvin, jsou imunosupresiva. Jedná se především o již zmiňované kalcineurinové inhibitory, tedy cyklosporin a takrolimus, a dále o azathioprin (Imuran®). Takrolimus je třeba vždy vnímat jako velice rizikové léčivo z hlediska lékových interakcí. Eliminace takrolimu je zcela závislá na metabolizaci cestou CYP 3A4/5 a v případě inhibice léčivy uvedenými v tabulce 1 dochází k výraznému zvýšení koncentrací.17 Velice riziková je např. současná komedikace inhibitory kalcineurinu s klaritromycinem (Klacid®). Této lékové interakce se snažíme vyvarovat a nahradit klaritromycin jiným makrolidem (azitromycinem [Sumamed®, Azitrox®]) nebo spiramycinem (Rovamycine®). Kromě dalších lékových interakcí s inhibitory jaterního metabolismu uvedenými v tabulce 1 bylo v případě takrolimu rovněž popsáno zvýšení koncentrace z 9 µg/l na 17,9 µg/l při současné terapii metronidazolem (Entizol®) podávané pro klostridiovou kolitidu.18
V některých případech jsou tyto lékové interakce využívány záměrně. Diltiazem je např. podáván za účelem zvýšení koncentrací kalcineurinových inhibitorů u pacientů, u kterých je po transplantaci ledvin obtížné při podávání obvyklých dávek dosáhnout dostatečně vysokých terapeutických koncentrací takrolimu. Původně se cílené zpomalení eliminace kalcineurinových inhibitorů diltiazemem či ketokonazolem stalo součástí odborných doporučení s cílem snížit dávky léčiv, a tím náklady na léčbu. Při podávání dávky 100 mg ketokonazolu je možné snížit dávky cyklosporinu a takrolimu o více než 50 %.10 Je třeba mít na paměti, že vysazení diltiazemu (Diacordin®), který může působit v terapii jako zbytné léčivo nahraditelné např. betablokátorem, by v tomto případě bylo chybou. Zároveň je však potřeba si uvědomit, že diltiazem snižuje nejen eliminaci kalcineurinových inhibitorů, ale i dalších léčiv (statiny, fentanyl, nová perorální antikoagulancia atd.) a že podle toho je třeba upravit jejich dávky.
Vzácně se můžeme u pacientů po transplantaci ledvin setkat s kombinací sirolimu a cyklosporinu. Podle SPC je sirolimus dohromady s cyklosporinem indikován po dobu prvních 2–3 měsíců k prevenci rejekce transplantované ledviny.1 Pokud je cyklosporin podáván ve stejnou dobu jako sirolimus, zvýší se biologická dostupnost sirolimu a celková expozice stoupne přibližně o 30 %. Tato interakce zcela vymizí, pokud je sirolimus podáván čtyři hodiny po ranní dávce cyklosporinu.19
Dále je v případě terapie 6‑merkaptopurinem (6‑MP [Puri‑nethol®]) a jeho proléčivem azathioprinem třeba se vyvarovat terapie inhibitory xantinoxidázy (allopurinol [Milurit®, Purinol®], febuxostat [Adenuric®]). Inhibitory xantinoxidázy významně snižují clearance 6‑MP, který následně způsobí dřeňový útlum. Azathioprin patří mezi léčiva, která jsou používána v terapii autoimunitních glomerulonefritid, a pacient může s předpisem na tento lék odejít mj. z nefrologické ambulance, proto je třeba dbát na správný odběr lékové anamnézy, aby nedošlo k předepsání allopurinolu pacientovi, u něhož byla léčba azathioprinem nedávno zahájena jiným specialistou. Případné snižování dávek azathioprinu na čtvrtinu podle doporučení v SPC se jeví jako rizikové a mělo by se provést s vědomím odborníka indikujícího azathioprin a vždy za pečlivé kontroly krevního obrazu. Někteří autoři doporučují tento postup u pacientů, kteří azathioprin metabolizují predominantně na hepatotoxický 6‑methylmerkaptopurin, a přitom u nich nacházíme nízké koncentrace účinných 6‑thioguaninových metabolitů. Krevní obraz by se měl v tomto případě kontrolovat minimálně týdně po první čtyři týdny a následně jednou za tři měsíce. Je rovněž doporučeno kontrolovat koncentrace metabolitů azathioprinu v krvi,20,21 v České republice však metoda ke stanovení koncentrace tohoto léčiva ani jeho metabolitů není běžně dostupná, a nelze tak ověřit, zda je snížení dávek dostatečné, nebo naopak není příliš velké.
Závěrem lze říci, že nejvíce rizikovým krokem z hlediska lékových interakcí je přidávání nových léčiv do chronické medikace pacienta, případně vysazování léčiv s interakčním potenciálem. U pacientů s renální insuficiencí k tomu ještě přistupuje změněná farmakokinetika léčiv vylučovaných ledvinami, která může ovlivnit výsledek interakce. Dále se u pacientů v péči nefrologa setkáváme s léčivy indikovanými z důvodu onemocnění ledvin (vazače fosfátů, imunosupresiva), která mají v některých případech nezanedbatelný interakční potenciál. U komplikovaných případů pacientů s polypragmazií a sníženou kapacitou eliminačních orgánů je možno kontaktovat klinického farmakologa či klinického farmaceuta.
Literatura
- Platná SPC uváděných přípravků.
- Committee for Medicinal Products for Human Use (CHMP). Xarelto: Scientific conclusions and grounds for the variation to the terms of the marketing authorisation(s): EMA/497511/2018.
- Mueck W, Kubitza D, Becka M. Co‑administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects. Br J Clin Pharmacol 2013;76:455–466.
- Lempers VJC, Martial LC, Schreuder MF, et al. Drug‑interactions of azole antifungals with selected immunosuppressants in transplant patients: strategies for optimal management in clinical practice. Curr Opin Pharmacol 2015;24:38–44.
- Krausová L, Grim J, Pávek P. Azolová antimykotika: mechanizmy lékových interakcí. Klin Farmakol Farm 2009;23:86–89.
- Berl T, Wilner KD, Gardner M, et al. Pharmacokinetics of fluconazole in renal failure. J Am Soc Nephrol 1995;6:242–247.
- IBM Corporation. Micromedex ® – platné znění databáze.
- Manez R, Martin M, Raman D, et al. Fluconazole therapy in transplant recipients receiving FK506. Transplantation 1994;57:1521–1523.
- Saari TI, Laine K, Neuvonen M, et al. Effect of voriconazole and fluconazole on the pharmacokinetics of intravenous fentanyl. Eur J Clin Pharmacol 2008;64:25–30.
- KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant 2009;9(Suppl 3):S1–155.
- Kays MB, Overholser BR, Mueller BA, et al. Effects of sevelamer hydrochloride and calcium acetate on the oral bioavailability of ciprofloxacin. Am J Kidney Dis 2003;42:1253–1259.
- Wauters JP, Uehlinger D, Marti HP. Drug interaction between sevelamer and cyclosporin. Nephrol Dial Transplant 2005;20:660–661.
- Merkle M, Wornle M, Rupprecht HD. The effect of sevelamer on tacrolimus target levels. Transplantation 2005;80:707.
- Fleuren HW, Kho Y, Schuurmans MM, Vollaard EJ. Drug interaction between sevelamer and furosemide. Nephrol Dial Transplant 2005;20:2288–2289.
- Burke SK, Amin NS, Incerti C, et al. Sevelamer hydrochloride (Renagel), a phosphate‑binding polymer, does not alter the pharmacokinetics of two commonly used antihypertensives in healthy volunteers. J Clin Pharmacol 2001;41:199–205.
- Burke S, Amin N, Incerti C, et al. Sevelamer hydrochloride (Renagel), a nonabsorbed phosphate‑binding polymer, does not interfere with digoxin or warfarin pharmacokinetics. J Clin Pharmacol 2001;41:193–198.
- Jones TE, Morris RG. Pharmacokinetic interaction between tacrolimus and diltiazem: dose‑response relationship in kidney and liver transplant recipients. Clin Pharmacokinet 2002;41:381–388.
- Herzig K, Johnson DW. Marked elevation of blood cyclosporin and tacrolimus levels due to concurrent metronidazole therapy. Nephrol Dial Transplant 1999;14:521–523.
- Kaplan B, Meier‑Kriesche HU, Napoli KL, et al. The effects of relative timing of sirolimus and cyclosporine microemulsion formulation coadministration on the pharmacokinetics of each agent. Clin Pharmacol Ther 1998;63:48–53.
- Gearry RB, Day AS, Barclay ML, et al. Azathioprine and allopurinol: A two‑edged interaction. J Gastroenterol Hepatol 2010:25:653–655.
- Kennedy DT, Hayney MS, Lake KD. Azathioprine and allopurinol: the price of an avoidable drug interaction. Ann Pharmacother 1996;30:951–954.
- Kategorie: Pacient s onemocněním ledvin v ordinaci ambulantního specialisty
- Klíčová slova: azathioprin; flukonazol; kalcineurinové inhibitory; kalciové vazače fosfátů; lékové interakce; nekalciové vazače fosfátů; NOAC; renální insuficience; sevelamer; vazač fosfátů