Tuberkulózní meningitida u dialyzovaného pacienta
Jednašedesátiletý pacient byl v květnu 2017 přivezen na interní oddělení záchrannou službou, kterou zavolala matka nemocného s tím, že pacient poslední čtyři dny nejí, nepije, neužívá léky, jen leží a je zmatený. Den před přijetím na interní oddělení absolvoval pravidelnou dialýzu, při které obtíže bagatelizoval. Pro celkovou slabost a nechutenství mu byla nabídnuta léčba za hospitalizace, kterou odmítl.
Z anamnézy uvádíme, že je po pravostranné orchiektomii pro seminom v roce 2004, levostranné nefrektomii v roce 2004 a pravostranné nefrektomii v roce 2015 pro konvenční renální karcinom. V pravidelném hemodialyzačním programu je zařazen od září 2015. V listopadu 2016 proběhla resekce a implantace totální endoprotézy pravého femuru pro solitární metastázu renálního karcinomu. Dále má degenerativní změny krční páteře s četnými výhřezy s cervikalgiemi a arteriální hypertenzi. Od dětství trpí těžkou poruchou sluchu, ale je schopen dobře odezírat a komunikuje jen s lehkou dyslálií a má amblyopii korigovanou brýlemi.
Při příjmu k hospitalizaci byla teplota 38,2 °C, TK 155/95 mm Hg, puls 101/min, pacient byl ameningeální. Výsledky základních laboratorních vyšetření byly bez pozoruhodností, hodnota C‑reaktivního proteinu (CRP) v normě, RTG plic bez infiltrátu či jiných ložiskových změn. Stav byl hodnocen jako celkové zhoršení při suspektním infektu nejasné etiologie. Druhý den hospitalizace došlo ke generalizovaným křečím se stočením bulbů doleva a se záškuby levého ústního koutku a známkami parézy pravé dolní končetiny. Vyšetření mozku pomocí CT s podáním kontrastní látky neprokázalo ložiskové změny. Při odpolední vizitě téhož dne u nemocného dominoval neklid, pacient vydával pouze nesrozumitelné zvuky. Byla provedena lumbální punkce, přičemž likvor byl čirý, laboratorně 166/3 µl leukocytů, z toho 152/3 mononukleárů, 14/3 polynukleárů, glykorachie 2 mmol/l, hodnota bílkoviny v likvoru byla 1,695 g/l. Na interním pracovišti byla ve spolupráci s neurologem stanovena diagnóza serózní meningoencefalitidy a po telefonické konzultaci s infekční klinikou Nemocnice Na Bulovce (NNB) byla zahájena terapie aciklovirem a ceftriaxonem, neboť bylo pomýšleno na herpetickou encefalitidu či na úvodní fázi bakteriální meningitidy. Nemocný byl předán na JIP a následující den transportován na infekční kliniku NNB.
Zde byla po přijetí provedena urgentní hemodialýza pro hyperkalemii a antibiotická terapie byla pro podezření na listeriovou meningoencefalitidu změněna na ampicilin. Pro další progresi poruchy vědomí byla od třetího dne hospitalizace zahájena umělá plicní ventilace. V kontrolní lumbální punkci s odstupem pěti dnů byla hodnota celkové bílkoviny 1,45 g/l, glykorachie 2,1 mmol/l, hodnota laktátu 5,3 mmol/l a koeficient energetické bilance (KEB) –7,2, v cytologickém vyšetření 25/3 segmentů a 6/3 mononukleárů. Bylo vysloveno podezření na tuberkulózní meningitidu, která byla prokázána nálezem DNA PCR z likvoru a od pátého dne pobytu byla zahájena terapie pětikombinací antituberkulotik ve složení pyrazinamid, ethambutol, izoniazid, streptomycin a rifampicin a byly podány kortikoidy dle protokolu. Vzhledem k poruše pasáže nebyly úvodní dávky antituberkulotik redukovány, kromě streptomycinu, který byl podáván vždy po dialýze, jež byla zpočátku pro hyperkalemii prováděna denně. Kromě rifampicinu nebyla ostatní antituberkulotika v parenterální formě dostupná. Kultivačně metodou MGIT (Mycobacteria Growth Indicator Tube) bylo v likvoru za tři týdny prokázáno Mycobacterium tuberculosis, dobře citlivý kmen. Pozitivní polymerázová řetězová reakce (PCR) na Mycobacterium tuberculosis byla rovněž z aspirátu z dýchacích cest, ale cílená kultivace byla opakovaně negativní. Na CT hrudníku bylo vstupně prokázáno ložisko velké 5 mm v S2 vpravo, další v S4 vlevo 4 mm, nespecificky zmnožené nezvětšené uzliny v mediastinu a drobné obtékané emboly v pravé dolní lalokové větvi a v jejích segmentálních arteriálních větvích při v. s. chronické pravostranné embolii.
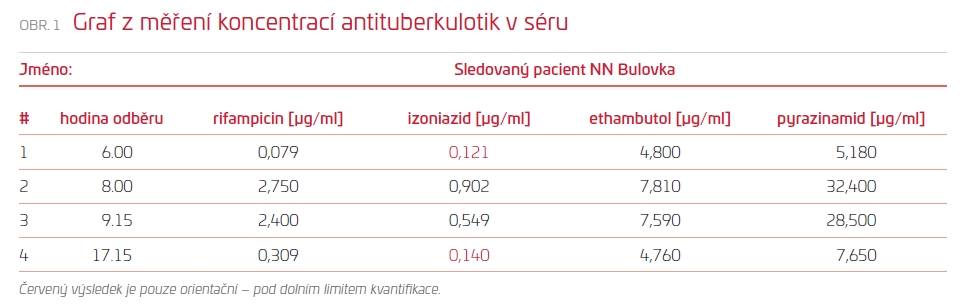
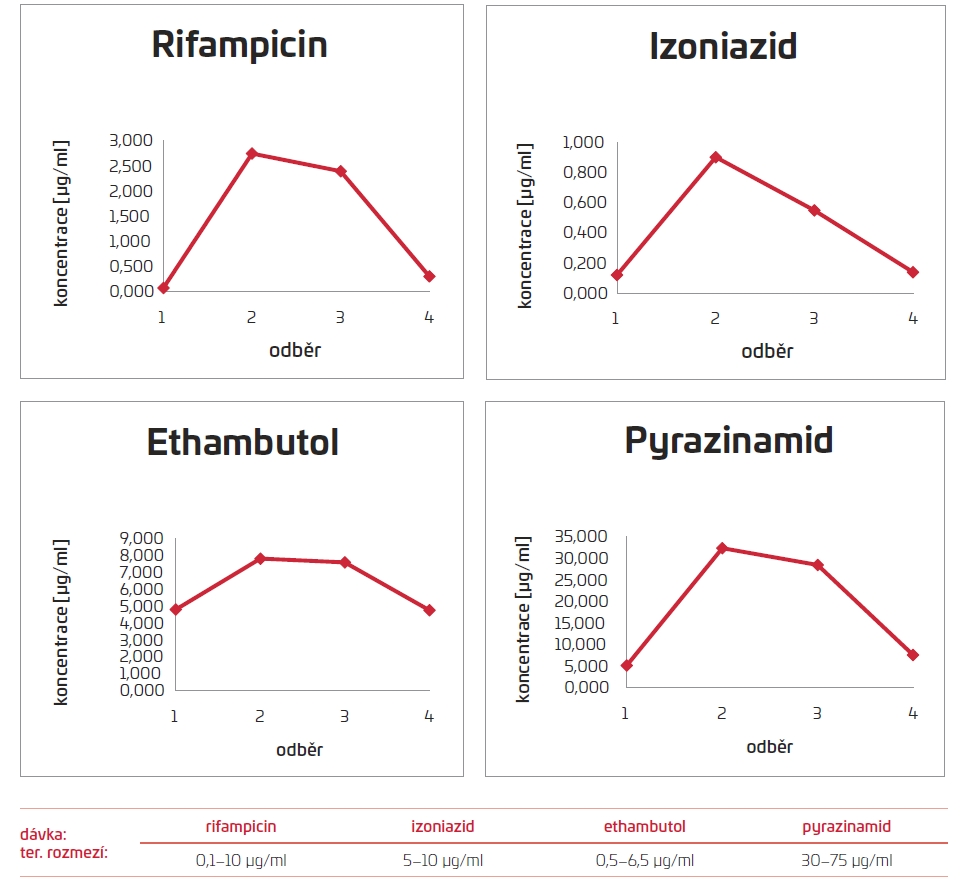
Jedenadvacátý den terapie došlo k rozvoji leukopenie s lymfocytopenií, která kolísala i během dalšího pobytu. Pro zvažované nežádoucí účinky podávaných antituberkulotik byly klinickým farmaceutem empiricky upraveny DD (denní definované) dávky pyrazinamidu z 2 000 mg na 1 500 mg, ethambutolu z 1 600 mg na 1 200 mg, dávka izoniazidu byla ponechána na 300 mg a dávka rifampicinu snížena ze 600 mg na 450 mg. Následně byla stanovena hodnota antituberkulotik. Ve výsledcích byla zjištěna nízká hodnota izoniazidu a rifampicinu, proto byla jejich dávka navýšena, a naopak dle koncentrací byla snížena dávka ethambutolu, viz obr. 1 (přiložený graf z měření koncentrací) (Ing. Věra Marešová, CSc., Ústav soudního lékařství a toxikologie VFN v Praze).
Vzhledem k trvajícímu sklonu k leukopenii a k rozvoji toxoalergického exantému, zřejmě po pyrazinamidu, byla stanovena citlivost i na rozšířenou řadu záložních antituberkulotik, pro případ nutnosti jejich použití. Nebylo ale možné vyloučit ani nežádoucí účinky podávaného levetiracetamu pro křeče v úvodu onemocnění.
Stav pacienta se pomalu zlepšoval, probíhal weaning a dekanylace 33. den pobytu; 40. den pobytu po dialýze došlo náhle k rozvoji desaturace a hypotenze. Byla obnovena tracheostomie a opět zahájena umělá plicní ventilace, podány oběhové podpory. Plicní embolizace byla CT angiografií vyloučena, ale došlo ke vzestupu koncentrace myokardiálních enzymů a echokardiografie prokázala hypokinezi levé komory se sníženou ejekční frakcí. Kardiologové zvolili konzervativní postup a po stabilizaci stavu byl opět zahájen weaning, který se zkomplikoval opakovanými nozokomiálními respiračními infekty. Pacient byl nadále somnolentní, centrálně kvadruparetický s pravostrannou převahou. Kontrolní lumbální punkce po šesti týdnech léčby vykazuje, dle očekávání, jen mírné zlepšení. Vzhledem k přetrvávajícím projevům toxoalergického exantému bylo 65. den terapie ukončeno podávání pyrazinamidu. V další kontrolní lumbální punkci po deseti týdnech terapie byla již zaznamenána tendence ke zlepšení stavu, hodnota celkové bílkoviny klesla, stoupl KEB a v cytologickém nálezu došlo k monocytárnímu přesmyku na 2/3 segmentů a 200/3 monocytů.
Pacient se postupně probíral do kontaktu, který byl limitován vrozenou hluchotou a těžkou amblyopií a jistě se na něm podílela i osobnostní charakteristika včetně negativismu a deprese. Na EEG s odstupem osmi týdnů od zahájení léčby byl zaznamenán výrazně abnormální záznam s difuzními hypofunkčními změnami, ale ve srovnání se záznamem ze třetího týdne léčby, který byl zcela plochý, bylo patrné mírné zlepšení. Rehabilitace probíhala pomalu, ale postupně došlo ke zlepšení hybnosti s reziduální parézou pravé dolní končetiny. Magnetická rezonance (MR) mozku v desátém týdnu terapie prokazuje jen drobné ložisko s restrikcí difuze vpravo okcipitálně subkortikálně, bez postkontrastního sycení podezřelého ze subakutní ischemie nebo projevu zánětu. Nález na MR na dolní hrudní a bederní páteři byl v normě.
Po více než deseti týdnech byl nemocný přeložen zpět do spádové nemocnice na plicní oddělení k pokračování antituberkulózní terapie. Pacient opět slovně komunikoval a odezíral, byl schopen krátké chůze ve vysokém chodítku, ale viděl hůře, zřejmě z centrální příčiny při výše uvedeném ložisku na MR.
Následně byl přeložen do léčebny dlouhodobě nemocných a po více než čtyřech měsících od začátku onemocnění byl propuštěn do domácího ošetřování. Porucha vidění se upravila, dle vlastního vyjádření pacienta „moucha“, kterou viděl před levým okem při pohledu do strany, zmizela. Nadále pokračuje terapie antituberkulotiky Nidrazid 100 mg tbl 5‑0‑0, Benemicin 300 mg cps 2‑0‑1 a dochází na ambulantní dialýzy.
Pacient zůstává ve sledování spádové pneumologie, nefrologie a onkologie, zatím bez známek relapsu základního onemocnění. Zdroj nákazy nebyl zjištěn, kromě pravidelných dialýz a návštěv zdravotnických zařízení od listopadu 2016 po operaci pravé kyčle téměř nevycházel z domu a známý kontakt s infekčním onemocněním neudával.
Komentář
- MUDr. Jana Kulichová, Klinika infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce, Praha
- MUDr. Jiří Wallenfels, Národní jednotka dohledu nad tuberkulózou, Nemocnice Na Bulovce, Praha
Literatura
Literatura MUDr. Jany Kulichové
- Abdelrahman M, Sinha AK, Karkar A. Tuberculosis in end‑stage renal disease patients on hemodialysis. Hemodial Int 2006;10:360–364.
- Belcon MC, Smith EK, Kahana LM, Shimizu AG. Tuberculosis in dialysis patients. Clin Nephrol 1982;17:14–18.
- Hussein MM, Mooij JM, Roujouleh H. Tuberculosis and Chronic Renal Disease. Semin Dial 2003;16:38–44.
- Mandell G, Bennett J, Dolin R. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases, Fifth Edition, Philadelphia: Churchill Livingstone, 2000, Second Volume, p. 2598–2599.
- Takahashi S, Takahashi T, Kuragano T, et al. A case of chronic renal failure complicated with tuberculous meningitis successfully diagnosed by nested polymerase chain reaction (PCR). Nihon Jinzo Gakkai Shi 2005;47:113–120.
- Guidelines for the prevention and management of Mycobacterium tuberculosis infection and disease in adult patients with chronic kidney disease, British Thoracic Society. Thorax 2010;65:559–570.
- Malhotra KK. Treatment of tuberculosis in chronic renal failure, maintenance dialysis and renal transplant. Indian J Nephrol 2003;13:69–71.
- Doporučený postup diagnostiky a léčby latentní tuberkulózní infekce. Česká pneumologická a ftizeologická společnost (ČPFS).
Literatura MUDr. Jiřího Wallenfelse
- Guidelines for the prevention and management of Mycobacterium tuberculosis infection and disease in adult patients with chronic kidney disease. British Thoracic Society. Thorax 2010;65:559–570.
- Registr tuberkulózy. ÚZIS ČR. http://www.uzis.cz/...gistr‑tuberkulozy, cit. 16. 4. 2018.
- Tuberkulóza 2016, základní přehled epidemiologické situace v ČR. ÚZIS ČR. http://www.uzis.cz/...respiracni‑nemoci, cit. 16. 4. 2018.
- Statistická ročenka dialyzační léčby v České republice v roce 2016. Česká nefrologická společnost. http://www.nefrol.c...yzacni‑statistika, cit. 16. 4. 2018.
- Abdelrahman M, Sinha AK, Karkar A. Tuberculosis in end‑stage renal disease patients on hemodialysis. Hemodial Int 2006;10:360–364.
- Belcon MC, Smith EK, Kahana LM., Shimizu AG. Tuberculosis in dialysis patients. Clin Nephrol 1982;17:14–18.
- Malhotra KK. Treatment of tuberculosis in chronic renal failure, maintenance dialysis and renal transplant. Indian J Nephrol 2003;13:69–71.
- Venkata RK, Kumar S, Krishna RP, et al. Tuberculosis in chronic kidney disease. Clin Nephrol 2007;67:217–220.
- Homolka J a členové Sekce pro TB při ČPFS. Doporučení Sekce pro tuberkulózu při ČPFS pro diagnostiku a léčbu latentní TB infekce u nemocných v chronickém dialyzačním léčení. Stud Pneumol Phthiseol 2018;78:10–11.
- Zatloukal P, Kos S, Vašáková M. Tuberkulóza dospělých (Standard léčebného plánu). Aktualizace 2016. http://www.pneumologie.cz/stranka/62/sekce‑pro‑tuberkulozu/, cit. 16. 4. 2018.
- Kategorie: Kazuistiky
- Klíčová slova: dialyzační léčba; chronické renální selhání; tuberkulózní meningitida
Komentář MUDr. Jany Kulichové
I když je tuberkulóza u dialyzovaných častější než v běžné populaci,1 setkává se s ní nefrolog v České republice zřídkakdy. Přitom má dialyzační lékař důležitou roli ve screeningu tuberkulózy při zahájení vyšetřování u podezřelého nemocného a v péči o chronicky dialyzovaného pacienta podstupujícího dlouhodobou antituberkulózní léčbu. Pacienti s tuberkulózou jsou v péči pneumologů, výjimku však činí léčba tuberkulózní meningitidy, která je stejně jako léčba ostatních neuroinfekcí prováděna infektologem.
Podkladem incidence tuberkulózy, která je u hemodialyzovaných pacientů1,2 vyšší než v obecné populaci, je narušená hostitelská odpověď proti intracelulárním patogenům včetně Mycobacterium tuberculosis; tato odpověď je založena na T1 helper lymfocytech se zapojením Il‑12, jež vede ke zvýšené produkci IFN‑gama. V uremii je snížená odpovídavost T lymfocytů, defekt kostimulačních antigen prezentujících buněk (APC) a perzistující inflamatorní stav monocytů. Dalšími faktory, které se podílejí na imunodeficitu, jsou malnutrice, nedostatek vitaminu D a hyperparatyreoidismus.3
Začáteční příznaky tuberkulózní (bazilární) meningitidy bývají nenápadné a vyvíjejí se postupně, během několika dnů až tří týdnů. Patří mezi ně poruchy nálady, spavost, poruchy koncentrace, subfebrilie, pocení a bolesti hlavy. Dialyzační lékař se může setkat s pacienty, kteří mají nevysvětlitelné teploty, nechutenství a úbytek hmotnosti. Tyto projevy se však mohou překrývat a zaměňovat s uremickými příznaky. S progresí stavu nastupuje noční zmatenost, parézy hlavových nervů, amentně‑delirantní stavy, dysartrie, epileptické záchvaty a meningeální příznaky včetně bolesti a ztuhnutí šíjových svalů. Neléčený stav vyústí v kóma a úmrtí, obvykle v horizontu dnů až týdnů.4
Klinické příznaky jsou dány vlastní infekcí, exsudací s obstrukcí bazálních cisteren a vaskulitidou, jež působí infarkty v mozku a v míše z perivaskulárního zánětu. Největší postižení mening je na bázi mozku v podobě arachnoiditidy. Vážnými následky bazilární meningitidy jsou srůsty, často bývá postižen zrakový nerv s následnou slepotou, obstrukcí likvorových cest a se vznikem hydrocefalu či paraplegie z endarteriitidy míšních cév.
Diagnostika bazilární meningitidy je obtížná. Krevní obraz včetně počtu leukocytů může být v normě, někdy bývá přítomna hyponatremie při SIADH (syndromu nepřiměřené sekrece antidiuretického hormonu) nebo CSWS (syndromu cerebrálně podmíněné ztráty soli), nicméně diagnostická je lumbální punkce. Pro likvorologický nález je charakteristické biochemické složení odpovídající purulentní meningitidě se středně zvýšenou koncentrací bílkoviny, laktátu a s hypoglykorachií, přičemž v literatuře tradovaná hypochloremie nemusí být přítomna. Koeficient energetické bilance je snížený a má záporné hodnoty. V cytologickém nálezu je typický nález zmnožených lymfocytů s nízkým podílem polymorfonukleárů a celkový počet elementů nepřekračuje 1 500/mm3. Mikroskopicky je průkaz Kochova bacilu (BK) z likvoru pozitivní ve 20 % v Ziehlově–Neelsenově barvení. Přímý průkaz je možný pomocí DNA PCR, ale ani ten není vždy dostatečně senzitivní a jeho negativita bazilární meningitidu nevylučuje. V literatuře je uváděna větší výtěžnost při použití nested PCR.5 Kultivace i přes zkrácené možnosti za použití MGIT trvá v řádu týdnů, přičemž terapii je nutno zahájit neprodleně již při důvodném podezření na základě charakteristického nálezu v likvoru. Rentgen plic může být pozitivní, ale jeho negativita v žádném případě onemocnění tuberkulózou nevylučuje. Dle literárních údajů žádný z dialyzovaných pacientů s extrapulmonální tuberkulózou neměl známky plicní tuberkulózy.1 Mantouxův test, vzhledem ke snížené citlivosti kožního testu u více než 50 % pacientů s chronickým renálním selháním, není vhodnou screeningovou ani podpůrnou diagnostickou metodou.4 V současnosti je nahrazován testem QuantiFERON‑TB Gold, který může být až v 90 % pozitivní, ale při léčbě steroidy nebo při čerstvé nákaze primární tbc může být negativní. Test T‑SPOT TB je v současnosti nejsenzitivnějším testem.6 Ze zobrazovacích metod na CT a MR můžeme pozorovat širší komory, postkontrastní nabarvení mening, případně i tuberkulomy, ale nepřítomnost výše uvedených nálezů bazilární meningitidu nevylučuje.4
Terapie sestává z pětikombinace antituberkulotik ve složení izoniazid (INH), rifampicin (RMP), pyrazinamid (PZA) a ethambutol (EMB) nebo streptomycin (STM) po dobu dvou měsíců, po nichž se pokračuje s RMP a INH po dobu minimálně 12 měsíců. Likvorový biochemický nález se upravuje rychleji, v řádu týdnů, ale cytologický nález a hodnota bílkoviny se vrací k normě až po třech až čtyřech měsících.4
Rifampicin se vylučuje především játry a žlučí a u pacientů s chronickým renálním selháním ho není potřeba redukovat. Pouze 10 % se vylučuje v nezměněné formě do moči. Obvykle se podává 450–600 mg v jedné denní dávce dle hmotnosti pacienta. V dialyzátu se neobjevuje ve významném množství. Koncentraci rifampicinu není nutné monitorovat.6 Nejčastějším nežádoucím účinkem je nauzea a hepatotoxicita.
Izoniazid je metabolizován v játrech na méně aktivní metabolity, které jsou následně vylučovány močí. Pacienty s chronickou renální insuficiencí je dobře tolerován. Obvykle je podáván místo denně pouze třikrát týdně po dialýze a dávka je zvýšena na 600–900 mg.6 Mezi nežádoucí účinky patří hepatitida, přičemž terapii není potřeba přerušovat, pokud aktivita jaterních enzymů nestoupne více než třikrát nad normu. Dalšími projevy může být centrální a periferní neurotoxicita, včetně ototoxicity a neuropsychiatrických účinků, jakými jsou depresivní psychózy, zmatenost a halucinace. Neurotoxicitě lze předcházet podáváním pyridoxinu v dávce 100 mg/den.3
Ethambutol se z 80 % vylučuje ledvinami a při clearance kreatininu (CCr) < 10 ml/min je doporučena redukce o 50 %.7 Obvykle se podává v dávce 15–25 mg/kg třikrát týdně po dialýze. Maximální denní dávka je 2,5 g. Hlavním nežádoucím účinkem je neuritida optického nervu, která má být monitorována měřením zrakové ostrosti a barvocitu. Pokud je monitorována plazmatická koncentrace, vrcholová hodnota se nabírá dvě hodiny po podání a průběžná za 24 hodin po podání v den bez dialýzy, přičemž tato hodnota má být nižší než 1,0 μg/ml.6
Pyrazinamid je metabolizován v játrech a ledvinami je vylučován v nezměněné formě pouze v 3–4 %. Ve významném množství, 45 %, je odstraňován dialýzou. Obvykle se podává v dávce 40 mg/kg třikrát týdně 24 hodin před dialýzou nebo v dávce 20–30 mg/kg po každé dialýze. U pacientů léčených kontinuální peritoneální dialýzou (CAPD) je doporučována dávka 1,5 g perorálně jedenkrát denně.3 Mezi nežádoucí účinky patří hepatotoxicita a hyperurikemie.
Streptomycin a aminoglykosidy jsou v 80 % vylučovány močí v nezměněné formě. Streptomycin má nižší nefrotoxicitu, ale vyšší vestibulární toxicitu ve srovnání s ostatními aminoglykosidy. Pokud je indikován, podává se v dávce 12–15 mg/kg/den dvakrát až třikrát týdně šest až osm hodin před dialýzou,3 přičemž je doporučováno monitorování koncentrací.
V případě MDR (multi drug resistance) se doporučují antituberkulotika druhé řady, mezi která patří ciprofloxacin, ofloxacin, kapreomycin, para‑aminoacetylsalicylová kyselina, ethionamid a cykloserin. Mají řadu nežádoucích účinků a dávkování musí být v případě renální insuficience sníženo.3
Nefrologa se dále může týkat i správné dávkování antituberkulotik ve vztahu k dialýze, neboť léčba probíhá dlouhodobě, v případě tuberkulózní meningitidy jeden rok. Ke správnému stanovení dávek podávaných antituberkulotik je vhodné monitorovat hodnoty, především ethambutolu a aminoglykosidů. U kriticky nemocných pacientů s kontinuální náhradou funkce ledvin (continuous renal replacement therapy, CRRT) je měření hodnot antituberkulotik silně doporučováno.6 Dále je nutné monitorování nežádoucích účinků léčby, hlavně neuropsychických problémů, optické neuropatie a hepatotoxicity, což u pacientů v resuscitační péči s tuberkulózní meningitidou, hlavně v případě prvních dvou uvedených komplikací, není možné. Vzhledem k intermitentně probíhajícím dialýzám je lepší podávat léky ve dnech dialýzy, a to až po dialýze, kdy je zaručena i nejlepší adherence k terapii, zvláště pak u ambulantních pacientů při nutnosti až roční léčby. Další možností, kvůli snížení potenciální ethambutolové, pyrazinamidové a streptomycinové toxicity mezi dialýzami, může být podání 4–6 hodin, či dokonce 24 hodin před dialýzou v případě pyrazinamidu,3 aby sérová koncentrace léků během dialýzy byla již za svou kulminací, ve fázi tkáňové distribuce, čímž se zároveň sníží riziko předčasného odstranění.
Prognóza tuberkulózní meningitidy závisí na věku, celkové zdravotní kondici a na zachyceném stadiu onemocnění, přičemž s rozvojem arachnoiditidy a cévních komplikací se zhoršuje. Mortalita se v případě časně zahájené léčby pohybuje okolo 10 %, pozdní až kolem 50 %. Asi ve 30 % případů zanechává tuberkulózní meningitida trvalé následky, např. hemiplegii, slepotu, hypothalamopituitární dysfunkci, demenci, epilepsii.4 U uremických pacientů mortalita dle různých zdrojů kolísá mezi 17–75 %, pokud je diagnóza a léčba zahájena časně, udávají někteří autoři nulovou mortalitu.3
V našem souboru 73 pacientů léčených s tuberkulózou v letech 2007–2017 jsme zaznamenali pouze dva pacienty s chronickou renální insuficiencí (ústní sdělení doc. MUDr. Olga Džupová, Ph.D.). U obou pacientů se jednalo o mimoplicní tuberkulózu, a to v jednom případě o osteomyelitidu a v jednom případě o tuberkulózní meningitidu. Osmašedesátiletý pacient s osteomyelitidou tibie a femuru v terénu diabetické nohy, jemuž byla navíc po ortotopické transplantaci srdce podávána chronická imunosupresivní terapie, nereagoval na antituberkulózní terapii ani na ortopedické zákroky a po dvou měsících zemřel.
U zde prezentovaného pacienta s tuberkulózní meningitidou jsme sami byli překvapeni, přes velmi závažný stav v úvodu onemocnění vyžadující resuscitační péči, relativně dobrým výsledkem po více než šesti měsících terapie s výslednou kvalitou života blížící se premorbidní úrovni. Jedinou zaznamenanou změnou je zhoršení zraku.
Chtěli bychom tímto článkem upozornit na úskalí diagnostiky a léčby tuberkulózy u dialyzovaných pacientů včetně možnosti laboratorní kontroly hodnot antituberkulotik.
Ohledně prevence a screeningu tuberkulózy u pacientů s chronickým renálním selháním odkazujeme na screeningová doporučení České pneumologické a ftizeologické společnosti8 a na následující komentář MUDr. Wallenfelse. V tomto případě byl proveden RTG plic s negativním nálezem, další diagnostika nebyla nefrology při negativní epidemiologické anamnéze indikována.
Komentář MUDr. Jiřího Wallenfelse
Chronické renální selhání je uváděno mezi rizikovými faktory přispívajícími k výskytu či k reaktivaci latentní tuberkulózy.1,2 V porovnání s celosvětovými údaji je výskyt tuberkulózy v České republice dle dat ÚZIS velice nízký. V roce 2016 se jednalo o 517 tuberkulózních onemocnění všech forem a lokalizací, přičemž incidence činí 4,9 případu na 100 000 obyvatel a z dlouhodobého hlediska má klesající trend.3 Z celkového počtu pacientů přibližně 30 % představují cizinci.3 Podle údajů z Registru tuberkulózy bylo v ČR v letech 2003–2016 vykázáno 56 nemocných tuberkulózou, u kterých byla prováděna dialýza.2
Ve výše uvedeném souboru se 39krát jednalo o plicní tuberkulózu (včetně 14 případů miliární tuberkulózy), 17krát o tuberkulózu pouze jiných orgánů. Tuberkulóza nervové soustavy (při miliárním rozsevu) byla hlášena pouze jedenkrát v roce 2005 u 60letého muže.2
Při počtu více než 6 000 dialyzovaných pacientů4 uváděném v současnosti odpovídají výše uvedená zjištění literárním údajům o 6–16krát vyšší incidenci tuberkulózy u hemodialyzovaných pacientů než v obecné populaci.5–7 Venkata uvádí 4% incidenci u pacientů s chronickým renálním selháním.8
Sekce pro tuberkulózu při České pneumologické a ftizeologické společnosti recentně vydala Doporučení pro diagnostiku a léčbu latentní tuberkulózní infekce u nemocných v chronickém dialyzačním léčení, podle kterého se u nemocných s chronickou renální insuficiencí v dialyzačním programu doporučuje provést jeden z testů IGRA (QuantiFERON‑TB Gold Plus nebo T‑SPOT.TB). Toto vyšetření může provést nefrolog nebo pneumoftizeolog. V případě pozitivního výsledku je nezbytné odeslat nemocného k vyšetření pneumoftizeologem. Je‑li indikována chemoprofylaxe nebo antituberkulotická léčba, je nemocný pravidelně kontrolován a léčen pneumoftizeologem.9
Chemoprofylaxe je zajištěna podáváním Nidrazidu‑INH v dávce 5 mg/kg (maximální denní dávka 300 mg) spolu s pyridoxinem po dobu 6 měsíců. Chemoprofylaxi má každý infikovaný nebo kontaktní osoba pouze jednou. Při chemoprofylaxi je nutné kontrolovat jaterní testy jedenkrát měsíčně. U nemocných s chronickou renální insuficiencí se INH podává třikrát týdně před dialýzou. Místo INH lze podávat rifampicin (RMP) 10 mg/kg (maximální denní dávka 600 mg ráno nalačno) po dobu čtyř měsíců (neurotoxicita INH, INH rezistentní kmen Mycobacterium tuberculosis), který není na rozdíl od INH vylučován ledvinami, ale prodělává enterohepatální cyklus.9 Celé doporučení je dostupné na: http://www.pneumolo...�pro‑tuberkulozu/.
Antituberkulotická léčba se při eventuální recidivě tuberkulózy na rozdíl od preventivní léčby latentní tuberkulózní infekce opakuje. Léčba tuberkulózy je uvedena na www.pneumologie.cz Tuberkulóza dospělých (Standard léčebného plánu).10