Infekce močového traktu (Klasifikace a současné možnosti terapie při rostoucí bakteriální rezistenci na antibiotika)
Souhrn
Infekce močového traktu (IMT) se z hlediska terapie a diagnostiky dělí na nekomplikované (vyskytují se u jedinců bez predispozičních faktorů pro IMT) a komplikované, které se vyskytují u pacientů s celou škálou rizikových faktorů pro rozvoj močové infekce. Nekomplikované IMT jsou způsobeny ve většině případů uropatogenními kmeny Escherichia coli, jejichž zdrojem je střevní bakteriální rezervoár. Prakticky vždy jde o infekce komunitní. Komplikované IMT se rozvíjejí nejčastěji u starších polymorbidních jedinců s poruchou urodynamiky, často způsobenou obstrukcí vývodných močových cest na kterékoli jejich etáži. Jde velmi často o infekce nozokomiální. Jsou způsobeny širší škálou bakteriálních species a také kvasinkami. Léčba obou typů IMT je v současnosti významně ovlivněna extrémně rostoucí rezistencí bakteriálních kmenů na běžně užívaná antibiotika. Oba typy IMT recidivují, častěji komplikované formy. V přehledu uvádíme diagnostickou a léčebnou strategii jednotlivých typů IMT.
Úvod
Infekce močového traktu (IMT) můžeme dělit na podkladě mnoha hledisek. Pro klinickou praxi je však nejužitečnější a obecně přijímané dělení na infekce nekomplikované, komunitní, které jsou takto klasifikovány při absenci jakýchkoli relevantních funkčních a anatomických anomálií močového traktu, funkčního poškození ledvin a konkomitantních chorob, jež mohou podporovat vznik IMT.1 Terapeutický a diagnostický přístup k nekomplikovaným IMT je pak odlišný u populace zdravých netěhotných premenopauzálních žen, u sexuálně aktivních zdravých mužů, u zdravých těhotných žen a u zdravých postmenopauzálních žen.2 U jedinců s nekomplikovanou IMT je vlastní systém obranyschopnosti proti bakteriální infekci neporušený a při vzniku infekce hraje důležitou roli virulence vyvolávajícího močového patogenu, která je rozhodujícím faktorem pro překonání imunitního systému hostitele. Významný faktor představuje u tohoto typu IMT porušení rovnováhy bakteriálního střevního a vaginálního ekosystému. Tato porucha (dysbióza) je charakterizována potlačením komenzálních a přerůstáním uropatogenních kmenů bakterií.3 Kromě užívání širokospektrých antibiotik, ať již indikovaně, nebo necíleně bez jednoznačné indikace, se mohou negativně uplatňovat další činitelé. U premenopauzálních sexuálně aktivních žen je rizikovým faktorem užívání spermicidních gelů, změna sexuálního partnera a zvýšený výskyt infekcí močového traktu u ženských pokrevních příbuzných v přímé linii (matky, sester, maternální babičky). U postmenopauzálních žen hraje rizikovou roli vyhasínající produkce estrogenů, u sexuálně aktivních mužů atypické sexuální praktiky. Bakteriální spektrum nekomplikovaných IMT je užší. Uplatňují se na prvním místě uropatogenní kmeny Escherichia coli, v menší míře Staphylococcus saprophyticus, Klebsiella pneumoniae a Proteus mirabilis. Ostatní močové patogeny se při vzniku nekomplikované IMT uplatňují jen velmi zřídka.4
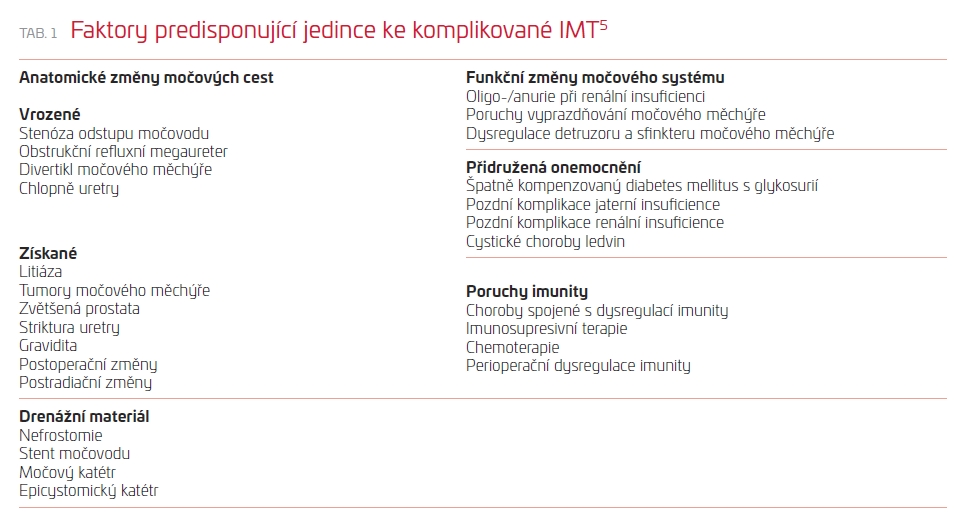
Komplikované IMT vznikají u jedinců se širokou škálou predispozičních rizikových faktorů pro vznik infekce (v přehledu jsou uvedeny v tab. 1). V této skupině nemocných zjišťujeme se zvyšující se prevalencí IMT způsobené nozokomiální infekcí bakteriemi rezistentními na dostupná antibiotika. Infekce vyvolané gramnegativními kmeny bakterií rezistentními na antibiotika představují jednu čtvrtinu až třetinu všech bakteriálních infekcí a velmi často jde o nozokomiální IMT.6 Gramnegativní patogeny vykazují vysokou míru adaptability. Širokospektré betalaktamázy (extended‑spectrum β‑lactamase enzymes, ESBL) produkující bakteriální gramnegativní kmeny jsou rezistentní také na nebetalaktamová antibiotika (fluorochinolony, aminoglykosidy, kotrimoxazol).7 Kromě bakteriálních kmenů produkujících ESBL (Escherichia coli, Klebsiella pneumoniae) se objevují kmeny gramnegativních bakterií prodující karbapenemázu a multirezistentní (multi‑drug‑resistant) kmeny Acinetobacter a Pseudomonas aeruginosa.6
Nekomplikované IMT premenopauzálních zdravých žen
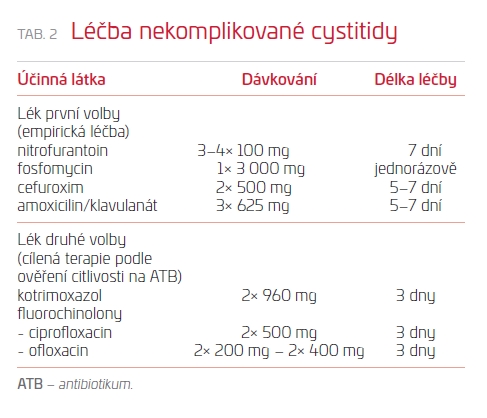
Nekomplikované IMT premenopauzálních žen se klinicky projevují jako cystitida. Klinické symptomy svědčící pro postižení dolních močových cest jsou pálení a řezání při močení – strangurie, bolest při močení a hlavně při domočování nad sponou stydkou – cystalgie, urgentní nucení na močení – urgence – a časté močení – polakisurie (frekvence). Cystitida může být provázena mikro‑ i makrohematurií. Zvýšení hodnoty C‑reaktivního proteinu (CRP) a jiné laboratorní známky zánětu nejsou přítomny, průběh je afebrilní. Cystitida vzniká vzestupem bakterií, které kolonizovaly okolí zevního ústí uretry, do močového měchýře. V případě, že zdrojem uropatogenních bakterií je porušený ekosystém vaginy, stěžují si ženy také na vaginální diskomfort (svědění, dyspareunie) často spojený s vaginálním výtokem. Pokud jde o první manifestaci cystitidy a dispenzarizující lékař je podrobně seznámen se zdravotním stavem pacientky, stačí k potvrzení diagnózy přítomnost typických klinických příznaků. Diagnózu IMT lze podpořit vyšetřením moči ponorným proužkem, který v případě IMT prokazuje přítomnost leukocytů a bakterií. Bakteriologické vyšetření moči není při první atace nekomplikované cystitidy nutné. Nejsou nutné ani další diagnostické procedury. Při empirické léčbě volíme v první linii antimikrobiální léky zaručující dostatečnou koncentraci v moči.2 Přehled antimikrobiálních léků, které jsou vhodné k perorálnímu použití při ambulantní léčbě nekomplikované cystitidy premenopauzálních zdravých žen, a doporučená délka léčby jsou uvedeny v tab. 2. V první volbě empirické antibakteriální léčby má přední místo nitrofurantoin a fosfomycin.8,9 U žen trpících vaginálním diskomfortem a/nebo s přítomností vaginálního fluoru je současně třeba léčit ve spolupráci s gynekologem bakteriální vaginitidu. Důležitou součástí léčby jsou analgetika/spasmolytika při významně vyjádřených dysurických obtížích.
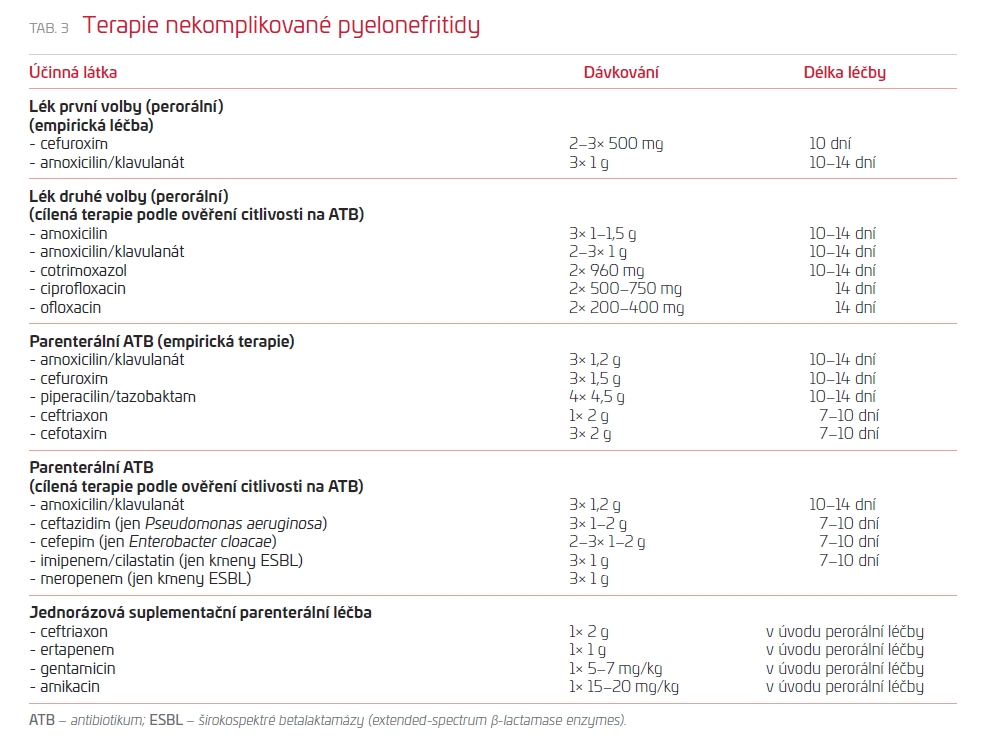
Závažnější formou nekomplikované IMT u premenopauzálních žen je akutní pyelonefritida. Vzniká podobně jako cystitida ascendentní cestou, tedy vzestupem bakterií z močového měchýře do ledvinového parenchymu. Akutní pyelonefritidě mohou předcházet příznaky cystitidy, ale není to pravidlem. Až 20 % pacientek nemá před vypuknutím symptomů pyelonefritidy příznaky infekce dolních močových cest.10 Nástup klinických příznaků je náhlý a vyznačuje se zimnicí, třesavkou a horečkou, provázenou často bolestí v jedné nebo v obou bederních krajinách. Přítomnost pyurie (patologické množství leukocytů v močovém sedimentu) je nález svědčící pro pyelonefritidu s vysokou senzitivitou v přítomnosti výše uvedených klinických symptomů. Absence pyurie by měla klinika vést k úvaze o jiné příčině obtíží (akutní cholecystitida, appendicitida, urolitiáza, trombóza renální žíly, záněty v malé pánvi, onemocnění paraspinálních svalů). Mikrobiologické vyšetření moči není u první ataky nezbytně nutné, ale pokud je vyšetření z hlediska transportu do mikrobiologické laboratoře logisticky schůdné, je vhodné je před empirickým zahájením antibiotické léčby provést. Nález slouží nejenom k potvrzení IMT, ale především pro snadnější cílenou volbu antibiotika v případě selhání empirické antimikrobiální léčby. Platí to zejména při volbě perorálního antibiotika, u kterého je lokálně zaznamenána významná rezistence mikrobů na daný antimikrobiální přípravek (> 20%). V nemocničním prostředí by nemělo chybět vyšetření hemokultury. Významná elevace hodnot laboratorních parametrů zánětu (leukocytóza a významný vzestup CRP) je pro akutní pyelonefritidu zcela typická. Klinická prezentace akutní pyelonefritidy má široký rozptyl od mírné bolesti v bederní krajině se středně zvýšenou teplotou bez alterace celkového stavu po sepsi u fulminantně probíhající infekce. Celková nevolnost provázející pyelonefritidu může vést k dehydrataci a k mírné poruše glomerulární filtrace prerenální etiologie. Tato symptomatologie je indikací pro hospitalizaci, při které je kromě antibiotické léčby důležitá parenterální hydratace. Ambulantní léčba je možná u žen s méně závažnou symptomatologií, které nemají příznaky dehydratace a s ní spojené prerenálně podmíněné poškození renální funkce.10 U dehydratovaných žen trpících nevolností, které nejsou schopny užívat perorální antibiotika ani přijímat dostatečné množství tekutin per os, je správnějším přístupem hospitalizace, při které můžeme snadno vstupně provést ultrasonografické vyšetření vylučující obstrukci močových cest nebo přítomnost doposud nediagnostikovaného ledvinového onemocnění (například polycystické choroby ledvin). V případě pyelonefritidy volíme především antibiotika, která mají dobrý průnik do ledvinové tkáně. Přehled antibiotik pro ambulantní perorální léčbu a nemocniční parenterální léčbu akutní nekomplikované pyelonefritidy u premenopauzálních zdravých žen a doporučenou dobu podávání antibiotik uvádíme v tab. 3. Pro narůstající rezistenci komunitních bakteriálních kmenů izolovaných z moči mikrobiologové nedoporučují dále používat jako empirickou terapii kotrimoxazol a fluorochinolony. Empirická volba antibiotika bez ohledu na nedávnou lokální situaci rezistence mikrobiálních původců IMT na antibiotika významně zvyšuje riziko selhání terapie. U pacientek, které byly odeslány ambulantním lékařem do nemocnice, jsou však z klinického hlediska únosné pro ambulantní léčbu empiricky voleným perorálním antibiotikem, ale lokální situace poukazuje na zvýšené riziko rezistence mikrobů na toto zvolené antibiotikum, lze použít taktiku jednorázové nebo krátce trvající suplementační terapie širokospektrým antibiotikem s dlouhým biologickým poločasem (ceftriaxon, gentamicin, amikacin, ertapenem).10 Empiricky dobře zacílená antibiotická léčba vede ke zlepšení klinického stavu v průběhu 24 až 48 hodin. Pokud se klinický stav v průběhu tohoto časového intervalu nezlepší, nebo se dokonce zhorší, je třeba pomýšlet na komplikace (obstrukce močových cest, intraparenchymový nebo para‑/perirenální absces). V takovém případě je jednoznačně indikována hospitalizace a podrobné urologické vyšetření, včetně CT.
Nekomplikované IMT u sexuálně aktivních mužů
Infekce močového traktu u sexuálně aktivních mužů je méně častá, protože jsou před ascendentní infekcí chráněni delší anatomickou uretrou a antibakteriálním působením prostatického sekretu. Proto je IMT mužů tradičně posuzována jako komplikovaná. Nekomplikovaná IMT se však u sexuálně aktivních mužů, především ve věkovém rozmezí 15–50 let, rovněž vyskytuje. Rizikovým faktorem je homosexualita, nezvyklé sexuální praktiky a promiskuita. Při vyhodnocení močového mikrobiologického nálezu je nutné brát v potaz fyziologický bakteriální ekosystém přední uretry, která je osídlena Staphylococcus epidermidis, enterokoky a difteroidy. Naproti tomu kmeny Escherichia coli, Proteus species, nepatogenní kmeny neisserií a viridující streptokoky se vyskytují zřídka.11 Bakterie, které jsou schopné adherovat k uroepitelu, mohou způsobit cystitidu a proniknout do parenchymových tkání močového traktu a způsobit nejenom akutní pyelonefritidu, ale také akutní prostatitidu. Asi u třetiny mužů s akutní prostatitidou současně probíhá pyelonefritida. Akutní bakteriální prostatitida je nejčastěji zapříčiněna vysoce virulentními uropatogenními kmeny Escherichia coli. Tyto kmeny mají tendenci vytvářet v prostatické tkáni biofilm, což je spojeno s obtížnou eliminací infekce antibiotiky. Trvá‑li perzistence bakterií v prostatické tkáni déle než tři měsíce, přechází onemocnění do chronického stadia. Bakterie kolonizující tkáň prostaty v biofilmu nemusejí být přítomny v prostatickém sekretu ani v moči, a proto je chronická prostatitida hůře diagnostikovatelná.11 Akutní infekce parenchymových orgánů je provázena klinicko‑laboratorním obrazem zánětu – horečkou, vysokou hodnotou CRP a pyurií. Při diferenciální diagnostice akutní prostatitidy je třeba pomýšlet i na jiný fokus infekce, zejména na pararektální absces. U mladých sexuálně aktivních mužů s rizikovým sexuálním chováním, kteří mají při negativním bakteriologickém močovém nálezu pyurii, je nutné pomýšlet na infekce způsobené Neisseria gonorrhoeae a Chlamydia trachomatis.11 I při první epizodě IMT je nutné zevrubné anamnestické vyšetření zacílené na rizikové faktory IMT. Není chybou požadovat urologické vyšetření v případě zjištění rizikových faktorů IMT a při podezření na prostatitidu nebo speciální kultivační vyšetření v případě podezření na sexuálně přenosné infekce. Z výše uvedených důvodů je vždy vhodné mikrobiologické vyšetření moči před zahájením antibiotické léčby. Výběr antibiotik pro léčbu akutní cystitidy a pyelonefritidy se řídí stejným doporučením jako u mladých sexuálně aktivních žen. V případě akutní infekce prostaty urogenitálními mykoplazmaty a Chlamydia trachomatis volíme přednostně makrolidová antibiotika (erytromycin, klaritromycin, azitromycin), která vykazují in vitro i in vivo lepší aktivitu proti bakteriálnímu biofilmu.12 Makrolidy lze proto také užít v kombinaci s cílenou antibiotickou léčbou k terapii akutní kolibacilární prostatitidy. Antibiotická léčba prostatitidy vyžaduje delší dobu, zpravidla několik týdnů.
Nekomplikované IMT u zdravých těhotných žen
Asymptomatická bakteriurie (ABU) a cystitida jsou u těhotných žen rizikovým faktorem pro vznik akutní pyelonefritidy (20–40 % žen s ABU má vyšší riziko vzniku pyelonefritidy ve třetím trimestru a v časném postpartálním období). Ženy, které prodělaly v třetím trimestru gravidity akutní pyelonefritidu, mají vysoké riziko předčasného porodu novorozence s nízkou porodní hmotností. Infekce močového traktu v graviditě zvyšují riziko úmrtnosti plodu. Hormonálními změnami podmíněná dilatace horních močových cest, snížená kapacita močového měchýře, snížená koncentrační schopnost ledvin vedoucí ke snížené močové koncentraci přirozených antimikrobiálních produktů a gestační diabetický syndrom vysvětlují ABU a IMT u těhotných. V našem zdravotním systému patří pátrání po asymptomatické bakteriurii v 16. týdnu gravidity k základnímu vyšetření. Asymptomatická bakteriurie u těhotných je vždy indikací k antibiotické léčbě. Antibiotickou léčbu je nutné vždy usměrňovat výsledkem antibiogramu. Kontrola účinnosti antibiotické léčby je indikována do konce těhotenství. Při výběru antibiotika je třeba vzít na vědomí, že fluorochinolony jsou v graviditě kontraindikovány, kotrimoxazol a nitrofurantoin jsou kontraindikovány v prvním trimestru gravidity a ve druhé polovině třetího trimestru. Bezpečný je po celou dobu gravidity fosfomycin.13 U gravidních žen s diagnózou akutní pyelonefritidy, zejména ve třetím trimestru gravidity, je vždy indikována léčba za hospitalizace parenterálně podávanými antibiotiky. Výběr antibiotik je ovlivněn zvažováním rizika antimikrobiální léčby pro plod na jedné straně a na druhé straně rizikem septikemie a jejími následky pro matku při fulminantní akutní pyelonefritidě. Za relativně bezpečná pro plod jsou považována antibiotika, u kterých nebylo prokázáno riziko pro plod v animálních studiích, ale nejsou dostatečná data ve studiích u lidí. K těmto antibiotikům patří amoxicilin/klavulanát, antibiotikum, které je účinné v léčbě IMT způsobené enterokoky a některými kmeny gramnegativních bakterií, piperacilin/tazobaktam je účinný na stejné spektrum bakterií jako amoxicilin/klavulanát. Do stejné kategorie patří cefalosporiny (ceftriaxon, cefepim), které jsou účinné při léčbě akutní pyelonefritidy způsobené gramnegativními bakteriemi a některými grampozitivními koky. Pro léčbu akutní pyelonefritidy, kterou vyvolaly multirezistentní gramnegativní bakterie, lze použít relativně bezpečně karbapenemy (imipenem, meropenem), při závažném průběhu provázeném urosepsí také ceftolozan/tazobaktam a ceftazidim/avibaktam. Naproti tomu jsou aminoglykosidy (gentamicin a amikacin), antibiotika, u kterých bylo prokázáno riziko pro plod v animálních studiích a která k léčbě pyelonefritidy těhotných žen nelze používat.10
Nekomplikované IMT u postmenopauzálních žen
Postmenopauzální ženy trpí infekcemi močových cest častěji než ženy ve fertilním věku. Hlavním faktorem přispívajícím k častějšímu výskytu IMT u této populace jsou hormonální změny. Estrogeny jsou důležité pro udržení acidity vaginálního prostředí. Nedostatek estrogenů podmiňuje zhoršení kvality poševní sliznice a změny pH vedou k vaginální dysbióze (acidita vaginálního prostředí je důležitá pro normální růst Lactobacillus species). Správná diagnóza IMT postmenopauzálních žen je mnohdy obtížná pro častý výskyt genitourinárního syndromu v menopauze (dříve označovaný jako vulvovaginální atrofie, atrofická vaginitida, urogenitální atrofie). Genitourinární syndrom v menopauze (GSM) představuje plejádu symptomů vzniklých na podkladě hypoestrogenismu. Genitourinární syndrom v menopauze může imitovat IMT svými urologickými symptomy (bolest nad sponou stydkou nebo v malé pánvi, časté a urgentní nucení na močení, postmikční odkapávání moči, nykturie, stresová inkontinence moči, dysurie, hematurie).14 Dalším faktorem ztěžujícím správnou diagnózu IMT je asymptomatická bakteriurie. Incidence ABU je v obecné populaci 3,5 % a stoupá na 16–18 % u žen starších 70 let a některé longitudinální studie dokumentují výskyt ABU dosahující až 50 % u velmi starých žen.15 Genitourinární syndrom v menopauze postihuje 40–50 % postmenopauzálních žen a spolu s asymptomatickou bakteriurií zvyšuje pravděpodobnost nesprávné diagnózy IMT, inadekvátní antibiotické léčby se všemi důsledky selekce multirezistentních bakteriálních kmenů a zvýšeného výskytu nežádoucích účinků antibiotické terapie.14
Diagnóza nekomplikované IMT postmenopauzálních žen předjímá absenci typických predispozičních faktorů IMT, signifikantní bakteriologický močový nález provázený pyurií a symptomatologii typickou pro cystitidu nebo pyelonefritidu. Avšak klinický obraz IMT závisí do značné míry na tom, zda jde o soběstačné ženy žijící v komunitě, nebo o pacientky zdravotnických zařízení či klientky ošetřovatelských ústavů. Od toho se také odvíjí spektrum příznaků. U mladých soběstačných postmenopauzálních seniorek se IMT projevuje typickými příznaky cystitidy nebo pyelonefritidy, podobně jako u premenopauzálních žen. Léčebná a diagnostická strategie je u soběstačných žen z komunity stejná jako u žen fertilních. To znamená, že empiricky lze volit tatáž antibiotika. Krátká antibiotická terapie v případě cystitidy je stejně účinná a je spojena s menším výskytem nežádoucích účinků.16 U nesoběstačných hospitalizovaných žen nebo klientek ošetřovatelských ústavů se může IMT projevovat zcela atypicky narůstající letargií, amentně‑delirantními stavy, anorexií a průběhem bez vysoké horečky při probíhající pyelonefritidě.17 Vzhledem k této často netypické symptomatologii je nutné na možnost IMT pomýšlet, pokud se symptomy vyvíjejí akutně. I když nezjistíme jednoznačnou přítomnost relevantních chorob zvyšujících riziko vzniku IMT, ať již interních, nebo urologických, je správnější posuzovat IMT u této skupiny žen spíše jako komplikovanou. Bakteriologické vyšetření před zahájením terapie je správným postupem, protože lze přesněji zacílit antibiotickou léčbu. Netypická symptomatologie a možnost jiné příčiny výše popsaných symptomů je indikací ke zdrženlivému přístupu k antibiotické léčbě. Vzhledem k často současné přítomnosti dehydratace a dalších poruch vnitřního prostředí je na prvním místě parenterální hydratace izotonickými roztoky s případnou suplementací koncentrátu KCl při hypokalemii, posouzení adekvátnosti chronicky podávané diuretické terapie a psychoaktivních látek, včetně hypnotik a opioidních analgetik. Pakliže je klinický stav po řádné rehydrataci a úpravě farmakoterapie neměnný a trvá podezření na IMT, je namístě antibiotická terapie zacílená podle výsledku mikrobiologického vyšetření moči a hemokultury podle antibiogramu. Volba antibiotik by měla respektovat přidružená onemocnění a lokální stav rezistence mikrobů na běžně užívaná antibiotika.15
Komplikované IMT
Komplikované IMT se projevují jako cystitida (u mužů také chronická prostatitida, cystoprostatitida) nebo pyelonefritida a prakticky vždy lze v anamnéze, včetně prostudování zdravotní dokumentace a zevrubného klinického vyšetření, najít relevantní interní a/nebo urologické rizikové faktory pro IMT. Čím je pacient starší a čím větším počtem onemocnění trpí, tím více se setkáváme s atypickou symptomatologií IMT. Klinicko‑laboratorní příznaky typické pro pyelonefritidu mladých žen a mužů nebývají přítomny. Až u 30 % nemocných se symptomatologií infekce dolních močových cest je přítomna infekce i v ledvinách. Nemocní si stěžují na nechutenství, nauzeu a plynatost. Zvýšení tělesné teploty i při probíhající pyelonefritidě může být pouze v pásmu subfebrilií a hodnota CRP je zvýšena mírně nebo středně. U polymorbidních pacientů, kteří jsou častěji hospitalizováni, se stále častěji setkáváme s nozokomiálními infekcemi vyvolanými rezistentními kmeny bakterií. U starších mužů se zvyšuje prevalence chorob prostaty, které mohou vyvolat subvezikální obstrukci. Častou příčinou komplikované IMT je u nich dlouhodobá katetrizace močového měchýře, která je považována za definitivní řešení subvezikální obstrukce zvětšenou prostatou. U těchto mužů je málo pomýšleno na možnost chronické prostatitidy nebo prostatocystitidy. Zvětšená prostata s kalcifikacemi v USG nebo CT nálezu je často jediným důkazem tohoto onemocnění. Močový bakteriologický nález a hemokultury mohou být negativní. Spektrum bakterií vyvolávajících IMT je mnohem širší v porovnání s mladšími jedinci s nekomplikovanou formou IMT. Na prvním místě se stále vyskytují kmeny Escherichia coli, ale častěji jde o kmeny s menší virulencí. Uplatňují se i další gramnegativní bakterie, grampozitivní bakterie, a především u diabetických pacientů mohou být v moči přítomny kvasinky. Závažnou formou cystitidy je emfyzematózní cystitida. Tato forma cystitidy je spojena s bakteriální infekcí podmíněnou tvorbou plynu ve stěně močového měchýře. Pokud není radikálně urologicky léčena, jde o život ohrožující komplikaci. Rizikoví jsou nemocní s diabetes mellitus, imunokompromitovaní pacienti a jedinci s abnormalitami močových cest, s močovou obstrukcí a s dlouhodobě zavedeným močovým katétrem.4 S chronickou obstrukcí horních močových cest podmíněnou pyelolitiázou může být spojena další vzácná forma IMT – xantogranulomatózní chronická pyelonefritida. Proces bývá jednostranný, je spojen se selháním ledvin a jediným řešením je nefrektomie postižené ledviny.18 Pacienti s komplikovanými IMT vyžadují hospitalizační péči. Bakteriologické vyšetření moči a hemokultur, včetně antibiogramu se stanovením minimální inhibiční koncentrace, je před zahájením antibiotické terapie nezbytné. Pokud není příčina IMT zjevná, je třeba provést podrobné vyšetření zobrazovacími metodami a zevrubné vyšetření urologické. Volba antibiotika u komplikovaných forem IMT musí být cílená, tedy respektovat výsledek močového bakteriologického vyšetření, antibiogramu a minimální inhibiční koncentrace. Antimikrobiální léčba komplikovaných IMT je často obtížná pro narůstající počet gramnegativních bakteriálních kmenů produkujících ESBL a karbapenemázu. Je proto vhodné pro iniciální terapii volit parenterální podávání antibiotik. V první volbě zůstávají piperacilin/tazobaktam a cefalosporiny 3. generace. Jsou většinou aktivní proti fluorochinolon‑rezistentním kmenům gramnegativních bakterií. Ceftriaxon a cefotaxim nejsou vhodné pro terapii IMT způsobených kmeny Pseudomonas aeruginosa. Ceftazidim je vyhrazen pro terapii IMT způsobené Pseudomonas aeruginosa. Karbapenemy jsou aktivní vůči gramnegativním bakteriálním kmenům rezistentním na ceftriaxon‑cefotaxim, piperacilin/tazobaktam a fluorochinolon‑rezistentním gramnegativním bakteriálním kmenům.10,19,20 Ceftozolam/tazobaktam je rezervou pro léčbu IMT, které jsou způsobeny multirezistentními gramnegativními bakteriemi. Ceftazidim/avibaktam je nadějí pro restituci protibakteriální aktivity ceftazidimu. Oba posledně jmenované přípravky jsou vyhrazeny pro nemocné s život ohrožující sepsí. Aminoglykosidy by neměly být používány v monoterapii. Účinnost antibakteriální léčby je nutné kontrolovat opakovaným mikrobiologickým vyšetřením.
Recidivující a perzistující IMT
Akutní IMT mohou recidivovat. Tento fenomén se nazývá rekurence. Rekurující IMT je definována jako dvě a více symptomatických epizod v časovém rozmezí šesti měsíců nebo tři a více symptomatických epizod v průběhu 12 měsíců. Rekurující nekomplikovaná IMT je většinou reinfekcí, při které je původce infekce odlišný od toho, který vyvolal infekci původní. Až u 25 % zdravých žen, které prodělaly akutní cystitidu, se později rozvine reinfekce. Pouze u malého procenta z nich dojde, většinou časně, k relapsu, který způsobí identický kmen bakterie jako u infekce původní. V případě reinfekcí je zdrojem patogenních bakterií porušený vaginální nebo střevní mikrobiom. Jde o poruchu mikrobiálního ekosystému vyznačující se potlačením růstu komenzálních bakterií (dysbióza). Zásluhu na tom má především opakovaná a necílená léčba širokospektrými antibiotiky, v jejímž důsledku dochází k selekci virulentních uropatogenních kmenů bakterií.3 Proto je třeba při terapii akutní nekomplikované IMT volit antibiotika, která dosahují vysokých močových koncentrací v močových cestách v případě cystitidy nebo s vynikajícím průnikem do tkáně ledvin v případě akutní pyelonefritidy. Současně je třeba mít na paměti lokální stav rezistence na antibiotika u bakterií izolovaných z moči nemocných s komunitními infekcemi. Součástí léčebné taktiky je také co nejkratší antimikrobiální terapie. V průběhu antibiotické terapie i po jejím ukončení je možné posilovat reparaci střevního a vaginálního bakteriálního ekosystému probiotiky. Novinkou v prevenci reinfekcí uropatogenními kmeny Escherichia coli je terapie manosidy. Jde o malé molekuly s antiadhezivní účinností, které napodobují přirozené receptory hostitele pro fimbrie uropatogenních kmenů Escherichia coli.21
U komplikovaných IMT jsou rekurence častěji relapsem, který předpokládá přežívání uropatogenních bakterií ve tkáních organismu hostitele. Bakterie mají tendenci tvořit polymikrobiální agregáty – biofilm. Bakteriální biofilm je mikrobiální komunita „zabudovaná“ do hostitelské tkáně, většinou do buněk povrchových vrstev epitelu. Mikroorganismy jsou schopny produkovat extracelulární polymerický matrix, který slouží jako rezervoár nutrientů a zároveň vytváří bariéru proti antibakteriálním vlivům prostředí hostitele a účinku antibiotik. V biofilmu mohou přežívat odlišné bakteriální species, mezi kterými dochází k interakcím, jež mění vlastnosti mikrobiálních buněk v porovnání s jejich planktonickými protějšky. Tvorba polymikrobiálních biofilmů je usnadněna přítomností cizorodých materiálů v močových cestách, jako jsou močové katétry a stenty. Tvorba bakteriálních biofilmů je významným faktorem rezistence a představuje perzistující fokus infekce. Diagnostika je obtížná, protože konvenční mikrobiologické metody nejsou schopny prokázat infekční agens, a tím je znemožněna optimální léčebná strategie. Bakterie se mohou aktivně od biofilmu odloučit a být příčinou relapsu IMT. Problematika bakteriálních biofilmů je ústředním bodem etiopatogeneze IMT asociovaných s močovými katétry a stenty a pro tento typ IMT je v současném odborném písemnictví vžitý název CAUTI (catheter associated urinary tract infection). Výzkum látek schopných narušit bakteriální biofilm a umožnit léčbu fokusu infekce antibiotiky je intenzivní, nedospěl však ještě k širšímu klinickému využití.21–24
Závěr
Z diagnostického a terapeutického hlediska je rozlišení na nekomplikované a komplikované formy IMT optimálním postupem. V terapii IMT je současně největším problémem narůstající rezistence mikrobiálních kmenů na antibiotika. Infekce močového traktu nejsou banálním „uroinfektem“. Je třeba je přesně klasifikovat a podle klasifikace léčit. Bez tohoto přístupu pouze přispíváme k šíření rezistence mikrobů na antimikrobiální léčbu. Volba antibiotické terapie přitom musí být přísně individuální, zohledňující věk, pohlaví, přidružená onemocnění a riziko nozokomiální infekce. Karbapenemy a nové kombinace cefalosporinů s inhibitory betalaktamáz by měly zůstat vyhrazeny pro závažné formy IMT spojené s bakteriemií a sepsí.
Za připomínky k volbě antibiotické léčby děkuji MUDr. Elišce Bébrové (Mikrobiologický ústav 2. LF UK a FN v Motole.)
Literatura
- Cai T, Verze P, Brugnolli A, et al. Adherence to European Association of Urology Guidelines on prophylactic antibiotics: an important step in antimicrobial stewardship. Eur Urol 2016;69:276–283.
- Kranz J, Schmidt S, Lebert C, et al. The 2017 Update of the German Clinical Guideline on epidemiology, diagnostics, therapy, prevention, and management of uncomplicated urinary tract infections in adult patients: Part 1. Urol Int 2018;100:263–270.
- Spaulding CN, Klein RD, Schreiber HL, et al. Precision antimicrobial therapeutics: the path of least resistance? NPJ Biofilms and Microbiomes 2018;4:4.
- Li R, Leslie SW. Cystitis; StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2018. 2018 Jan 26.
- Sester U. Harnwegsinfektionen. Der Nephrologe 2012;4:289–297.
- Sievert DM, Ricks P, Edwards JR, et al. Antimicrobial‑resistant pathogens associated with healthcare‑associated infections: summary of data reported to the National Healthcare Safety Network at the Centres for Disease Control and Prevention, 2009–2010. Infect Control Hosp Epidemiol 2013;34:1–14.
- Pitout JD, Laupland KB. Extended‑spectrum beta‑lactamase‑producing Enterobacteriaceae: an emerging public‑health concern. Lancet Infect Dis 2008;8:159–166.
- Hutter A, Verhaegh EM, Harbarth S, et al. Nitrofurantoin revisited: a systematic review and meta‑analysis of controlled trials. J Antimicrob Chemother 2015;70:3178–3183.
- Kranz J, Schmidt S, Lebert C, et al. 2017 Update of the German Clinical Guideline on epidemiology, diagnostics, therapy, prevention, and management of uncomplicated urinary tract infections in adult patients: Part 2. Urol Int 2018;100:271–278.
- Johnson JR, Russo TA. Acute pyelonephritis in adults. N Engl J Med 2018;378:48–59.
- Steenackers HP, Parijs I, Dubey A, et al. Experimental evolution in biofilm populations. FEMS Microbiol Rev 2016;40:373–397.
- Ichimiya T, Takeoka K, Hiramatsu K, et al. The influence of azithromycin on the biofilm formation of Pseudomonas aeruginosa in vitro. Chemotherapy 1996;42:186–191.
- Mannucci C, Dante G, Miroddi M, et al. Vigilance on use of drugs, herbal products, and food supplements during pregnancy: focus on fosfomycin. J Matern Fetal Neonatal Med 2017;17:1–4.
- Gandhi J, Chen A, Dagur G, et al. Genitourinary syndrome of menopause: an overview of clinical manifestations, pathophysiology, etiology, evaluation, and management. Am J Obstet Gynecol 2016;215:704–711.
- Mody L, Juthani‑Mehta M. Urinary tract infection in older women. JAMA 2014;311:844–854.
- Vogel T, Verreaut R, Gourdeau M, et al. Optimal duration of antibiotic therapy for uncomplicated urinary tract infection in older women: a double‑blind randomized controlled trial. CMAJ 2004;170:496–473.
- Matthews SJ, Lancaster JW. Urinary tract infection in elderly population. Am J Geriatr Pharmacother 2011;9:286–309.
- Marinacci LX, Rosales I. Xantogranulomatous pyelonephritis. N Engl J Med 2018;378:940.
- Bader MS, Loeb M, Brooks AA. An update on the management of urinary tract infection in the era of antimicrobial resistance. Postgrad Med 2017;129:242–258.
- Golan Y. Empiric therapy for hospital‑acquired, gram‑negative complicated intra‑abdominal and complicated urinary tract infection: a systematic literature review of current and emerging treatment option. BMC Infect Dis 2015;15:313–320.
- Spaulding CN, Klein R, Ruer S, et al. Selective depletion of uropathogenic E. coli from the gut by a FimH antagonist. Nature 2017;546:528–532.
- Römling U, Balsaroble C. Biofilm infection, their resilience to therapy and innovative treatment strategies. J Int Med 2012;272:541–561.
- Delcaru C, Alexandru I, Podgoreanu P, et al. Microbial biofilms in urinary tract infections and prostatitis: etiology, pathogenicity and combating strategies. Pathogens 2016;5:65.
- Delcaru C, Podgoreanu P, Alexandru I, et al. Antibiotic resistance and virulence phenotypes of recent bacterial strains isolated from urinary tract infections in elderly patients with prostatic disease. Pathogens 2017 May 31;6(2). pii: E22. doi: 10.3390/pathogens6020022.
- Kategorie: Názor hosta
- Klíčová slova: antimikrobiální terapie; infekce; klasifikace; rezistence bakterií na antibiotika