Metody náhrady funkce ledvin na JIP
Náhradu či podporu funkce ledvin (RRT – renal replacement therapy) vyžaduje přibližně 6 % všech nemocných hospitalizovaných na jednotkách intenzivní péče (JIP). V současnosti je k dispozici široká škála modalit RRT. Mezi základní patří intermitentní hemodialýza (IHD), kontinuální metody náhrady funkce ledvin (CRRT) a hybridní metody (SLED – sustained low‑efficiency dialysis). Navzdory nesporným technickým pokrokům a dostupnosti RRT zůstává mortalita nemocných vyžadujících některou z forem RRT nepřijatelně vysoká – až 60% (Hoste et al., 2010).
Historické perspektivy
Historie kontinuálních metod RRT sahá do roku 1977 v podobě arterio‑venózní hemofiltrace (CAVH). V průběhu času byla CAVH zcela nahrazena veno‑venózními přístupy. V současnosti jsou k dispozici tzv. třetí generace přístrojů určených k CRRT. Tyto přístroje umožňují dosažení vysokých krevních průtoků (cca do 450 ml/min), včetně průtoků dialyzačního/substitučního roztoku (8–10 l/h) při zachování vysoké přesnosti používaných pump (do 2 %). Současné přístroje jsou uživatelsky velmi jednoduché, bezpečné a schopné transportu, umožňující 24hodinovou monitoraci a grafické zobrazení trendů tlaků v mimotělním okruhu. Kromě technologických postupů se vyvíjely i různé modifikace CRRT v závislosti na principu očišťování krve. K dispozici jsou kontinuální venovenózní hemofiltrace (CVVH), hemodialýza (CVVHD) nebo hemodiafiltrace (CVVHDF). Jako hybridní metoda kombinující teoreticky výhody jak kontinuálních, tak intermitentních metod (viz níže) byla vyvinuta metoda SLED. Při této modifikaci se využívá standardní přístroj pro IHD s tím, že procedura trvá déle (cca 8–12 hodin) a jsou sníženy jak krevní průtok (100–200 ml/min), tak průtok dialyzačního roztoku (100 ml/min). Hemodynamická tolerance této metody kriticky nemocnými je srovnatelná s tolerancí CRRT, problematické je však dávkování některých léčiv, v první řadě však antibiotik. Nejméně často používanou modifikací kontinuálních přístupů je tzv. pomalá kontinuální ultrafiltrace (SCUF – slow continuous ultrafiltration). Slouží k odstraňování izotonické tekutiny při stavech provázených tekutinovým přetížením (např. srdeční selhání), bez potřeby eliminace solutů. Shrnutí fyzikálních principů očišťování krve při jednotlivých modifikacích CRRT je uvedeno v tab. 1.

Jakou metodu zvolit?
Ačkoli nejnápadnějším rozdílem mezi IHD a CRRT je doba trvání procedury, klinicky relevantnějšími jsou jiné technické aspekty. Zatímco IHD je vysoce účinná procedura, která je založena především na difuzi, CRRT je procedurou založenou na nižší účinnosti, která je dána jednak podstatně nižšími průtoky dialyzačního roztoku (v případě CVVHD), jednak méně účinnou konvekcí (v případě CVVHDF a CVVH). Na druhé straně jsou metody CRRT spojeny s významně menšími výkyvy metabolické a tekutinové rovnováhy mezi plazmou a jednotlivými tělními kompartmenty (elektrolyty, acidobaze, volémie, uremické toxiny). Při volbě metody RRT u kriticky nemocných je nutno se rozhodnout, zda zvolíme IHD, nebo CRRT/SLED, a v případě CRRT je nutno určit, o kterou modifikaci se bude jednat (CVVH, CVVHD, CVVHDF). Dle mezinárodní studie BEST patří některé z forem CRRT k nejčastěji používaným metodám k úvodní náhradě funkce ledvin u kriticky nemocných (Uchino et al., 2005). Intermitentní hemodialýza se iniciálně používá pouze ve 20 %, a to zejména v USA z logistických důvodů (otevřený formát JIP). Důvodem přednostního používání CRRT je bezesporu lepší hemodynamická tolerance a značná flexibilita managementu tekutinové resuscitace. Obecně lze říci, že pro výběr způsobu náhrady funkce ledvin u kriticky nemocných neexistují jednoznačná doporučení. Rovněž nejsou k dispozici přesvědčivá data, která by ukazovala, že CRRT jsou jednoznačně (ve smyslu mortality) lepší než procedury intermitentní (Prowle et al., 2010).

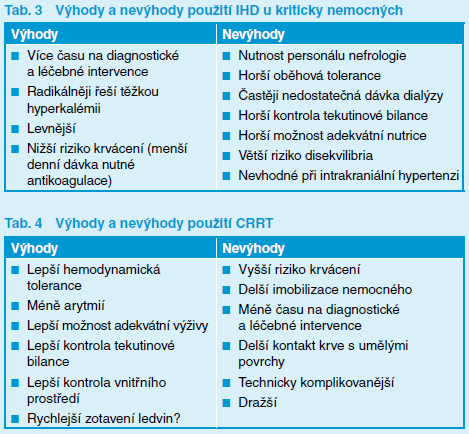
Existuje však několik vodítek, které rozhodnutí o volbě metody usnadňují. Mezi ně patří především charakter klinické situace, dostupnost metod a v neposlední řadě i zkušenosti pracoviště. CRRT nebo hybridní metody (SLED) jsou fyziologicky výhodnější zejména v případě hemodynamické nestability (stavy vyžadující podporu oběhu vazopresory/inotropními látkami), umožňují účinnou kontrolu tekutinové bilance, azotémie, acidobazické a elektrolytové rovnováhy a měly by být dále preferovány u pacientů s otokem mozku, těžkým dekompenzovaným srdečním selháním, u nemocných s fulminantním selháním jater a ARDS. Nezanedbatelnou výhodou kontinuálních metod je již zmíněná lepší kontrola tekutinové bilance. Používání IHD technik je obvykle provázeno významně větší kumulativní pozitivní bilancí tekutin ve srovnání s technikami CRRT (Bouchard et al., 2009). V této souvislosti přibývá důkazů o vztahu mezi trváním a mírou tekutinového přetížení a mortalitou kriticky nemocných pacientů, včetně horšího zotavení renálních funkcí (Bellomo et al., 2012). Intermitentní hemodialýza je indikována zejména u nemocných s těžkou symptomatickou hyperkalémií a u pacientů s život ohrožujícími intoxikacemi dialyzovatelným jedem, kde je nezbytné docílit co nejrychlejší eliminace toxinu. Intermitentní hemodialýza se též často používá jako náhrada funkce ledvin po ukončení CRRT po stabilizaci nemocného (tj. forma přemosťující léčby do doby dostatečného obnovení renálních funkcí). Výhody a nevýhody IHD a CRRT shrnují tabulky 3 a 4.
Volba jednotlivých modifikací CRRT (tj. CVVH, CVVHD, CVVHDF) je dalším často diskutovaným tématem. V teoretické rovině lze od konvektivních metod očekávat lepší odstranění středně velkých molekul (toxinů). Nicméně bylo prokázáno, že používáním vysoce propustných membrán lze v klinické praxi dosáhnout ekvivalentní clearance těchto látek i v případě CVVHD metod (Ricci et al., 2006). Podobně nebyly zjištěny žádné rozdíly v klinickém výsledku při srovnání kontinuální hemofiltrace s hemodiafiltrací (Palevsky et al., 2008; Bellomo et al., 2009). Tyto závěry potvrzuje i zcela recentní metaanalýza hodnotící 19 randomizovaných klinických studií, které porovnávaly CVVH s CVVHD (Friedrich et al., 2012). V současnosti lze tedy konstatovat, že modalita CRRT pravděpodobně neovlivňuje klinický výsledek, rozhodující je především správné načasování a adekvátnost jednotlivých forem RRT. Hybridní modifikace SLED může být s výhodou použita u oběhově nestabilních pacientů jako kompromis mezi IHD a CRRT, nicméně komparativní data stran přínosu, efektivity či rizik jsou velmi omezená.
Kam směřují RRT u kriticky nemocných?
Pacienti v kritickém stavu jsou oběťmi mnoha vážných, různorodých a často se kombinujících inzultů – sepse a septický šok, krvácení, polytrauma, náročné chirurgické výkony apod. Důsledkem jejich působení je poškození a dysfunkce řady orgánů – rozvíjí se akutní poškození ledvin (AKI), syndrom akutní respirační tísně (ARDS), koagulační poruchy a poruchy acidobazické rovnováhy, hemodynamické selhání aj. Výsledný klinický stav – multiorgánové selhání – je často letálním důsledkem kritického stavu, refrakterním k podpůrné léčbě. Je proto zřejmé, že v prostředí JIP není AKI izolovaným onemocněním, ale součástí složitého patofyziologického syndromu. To je důvodem, proč se současný technologický vývoj zaměřuje nikoli jen na podporu renálních funkcí (odstranění solutů, kontrola volémie a acidobazické rovnováhy), ale především na koncept multiorgánové podpůrné léčby (MOST – multiple organ support therapy) (Cruz et al., 2008). Kromě konvečních hemoeliminačních způsobů se proto objevují nové metody zaměřené na podstatně účinnější eliminaci látek, zejména o střední a vyšší molekulové hmotnosti, tj. předpokládaných klíčových mediátorů sepse a SIRS všeobecně. Patří mezi ně párová plazmafiltrace a adsorpce (CPFA – coupled plasmafiltration adsorption), která umožňuje separaci plazmy, jež následně prochází kolonou se syntetickou pryskyřicí s vysokou adsorpční kapacitou. Takto „detoxifikovaná“ plazma se vrací zpět do okruhu a plná krev je v druhé fázi očišťována standardním hemofiltrem. Metoda tedy umožňuje kombinaci adsorpce s následnou konvekcí. Dalším způsobem zvyšujícím účinnost eliminace středně velkých molekul jsou vysoce propustné hemofiltry (např. polysulfonové membrány s in vitro cut‑off100 kD).
Mezi nejvíce sofistikované systémy patří vývoj bioarteficiálních ledvin, které obsahují lidské buňky proximálních tubulů ve spojení s klasickým hemofiltrem. Tento systém umožňuje téměř kompletní náhradu funkce ledvin, včetně substituce metabolických, hormonálních a transportních procesů (metabolismus glutathionu, vitaminu D, amoniaku, transport elektrolytů a glukózy, regulace imunitní odpovědi). Klinicky nejdostupnější metodou agresivní hemoeliminace je v současnosti tzv. vysokobjemová hemofiltrace (HVHF), kdy objem efluentu dosahuje 50–100 ml/kg/h. Některé studie poukázaly na zlepšení hemodynamické stability, resp. snížení potřeby vazopresorů u pacientů v septickém šoku léčených HVHF. Nicméně prakticky všechny byly zatíženy řadou vážných nedostatků (Rimmelé et al., 2012). Sami jsme testovali přínos HVHF i CPFA v klinicky relevantním experimentálním modelu septického šoku, avšak bez jednoznačného průkazu přínosu těchto metod (Sykora et al., 2009 a,b). Tyto závěry jsou podpořeny předběžnými výsledky dosud jediné, zatím však nepublikované randomizované, multicentrické studie IVORY. Přestože koncept hemopurifikačních metod v léčbě sepse a MODS je stále atraktivní, nelze jejich rutinní klinické použití v současné době v rámci tzv. non‑renálních indikací doporučit.
Souhrn pro klinickou praxi: používání RRT u kriticky nemocných (dle KDIGO 2012, viz Matějovič, 2012):
- Kontinuální a intermitentní metody RRT používat jako komplementární léčbu AKI.
- U hemodynamicky nestabilních pacientů preferovat CRRT před IHD.
- U pacientů s AKI a akutním poraněním mozku nebo s jinými příčinami zvýšeného nitrolebního tlaku či generalizovaného otoku mozku preferovat CRRT před IHD.
- Používat bikarbonát spíše než laktát jako nárazník v dialyzačním či substitučním roztoku pro RTT u pacientů s AKI nebo cirkulačním selháním.
- Při rozhodování o zahájení RRT zvážit širší klinický kontext – přítomnost stavů, které mohou být prostřednictvím RRT modifikovány, a trend laboratorních výsledků – spíše než vycházet z izolovaných jednotlivých hodnot urey a kreatininu.
- RRT zahájit bezprostředně v případě život ohrožujících změn v tekutinové, elektrolytové a acidobazické rovnováze.
- RRT ukončit, pokud již není dále potřeba – buď z důvodů dostatečného stupně zotavení renálních funkcí, nebo protože pokračování RRT již není v souladu s cíli léčby.
- Dávka RRT by měla být předepsána před zahájením každé procedury RRT. Doporučuje se časté vyhodnocení skutečně realizované dávky, aby mohla být preskripce dávky adekvátně upravena.
- Při použití intermitentních a extendovaných RRT u AKI se doporučuje dosáhnout Kt/V 3,9/týden. QQ Při použití CRRT je doporučen objem efluentu 20–25 ml/kg/h. Ke skutečnému dosažení této dávky je obvykle nutná vyšší předepsaná dávka.
- Nepoužívat diuretika k urychlení zotavení renálních funkcí nebo ke zkrácení doby či snížení frekvence RRT.
- U pacientů bez zvýšeného rizika krvácení, bez poruchy koagulace a u nemocných nedostávajících účinnou systémovou antikoagulaci používat k zajištění antikoagulace intermitentních procedur: buď nefrakcionovaný, nebo nízkomolekulární heparin než jiné antikoagulanty.
- K zajištění antikoagulace kontinuálních procedur používat citrátovou regionální antikoagulaci spíše než heparin, nejsou‑li přítomny kontraindikace pro citrát.
- Pro pacienty se zvýšeným rizikem krvácení používat v průběhu CRRT citrátovou regionální antikoagulaci spíše než žádnou antikoagulaci, nejsou‑li kontraindikace k citrátu.
Literatura
- Bellomo R, Cass A, Cole L, et al., RENAL Replacement Therapy Study Investigators. An observational study fluid balance and patient outcomes in the Randomized Evaluation of Normal vs. Augmented Level of Replacement Therapy trial. Crit Care Med 2012;40:1753–1760.
- Bellomo R, Cass A, Cole L, et al., RENAL Replacement Therapy Study Investigators. Intensity of continuous renal‑replacement therapy in critically ill patients. N Engl J Med 2009;361:1627–1638.
- Bouchard J, Soroko SB, Chertow GM, et al. Program to Improve Care in Acute Renal Disease (PICARD) Study Group. Fluid accumulation, survival and recovery of kidney function in critically ill patients with acute kidney injury. Kidney Int 2009;76: 422–427.
- Cruz D, Bellomo R, Kellum JA, et al. The future of extracorporeal support. Crit Care Med 2008;36(4 Suppl):S243–252.
- Friedrich JO, Begshaw S. Hemofiltration compared to hemodialysis for acute kidney injury: systematic review and meta‑analysis. Critical Care 2012;16:R146; doi:10.1186/ cc11458.
- Hoste EA, Kellum JA, Katz NM, et al. Epidemiology of acute kidney injury. Contrib Nephrol 2010;165:1–8.
- Matějovič M. KDIGO Doporučení pro akutní poškození ledvin 2012 – komentovaný návod pro klinickou praxi. Aktual Nefrol 2012;(Suppl 1):55–66.
- Palevsky PM, Zhang JH, O’Connor TZ, et al., VA/NIH Acute Renal Failure Trial Network. Intensity of renal support in critically ill patients with acute kidney injury. N Engl J Med 2008;359:7–20.
- Prowle JR, Bellomo R. Continuous renal replacement therapy: recent advances and future research. Nat Rev Nephrol 2010;6:521–529.
- Ricci Z, Ronco C, Bachetoni A, et al. Solute removal during continuous renal replacement therapy in critically ill patients: convection versus diffusion. Crit Care 2006;10:R67.
- Rimmelé T, Kellum JA. High‑volume hemofiltration in the intensive care unit: a blood purification therapy. Anesthesiology 2012;116:1377–1387.
- Sykora R, Chvojka J, Krouzecky A, et al. High versus standard‑volume haemofiltration in hyperdynamic porcine peritonitis: effects beyond haemodynamics? Intensive Care Med 2009;35:371–380.
- Sykora R, Chvojka J, Krouzecky A, et al. Coupled plasma filtration adsorption in experimental peritonitis‑induced septic shock. Shock 2009;31:473–480.
- Uchino S, Kellum JA, Bellomo R, et al. Beginning and Ending Supportive Therapy for the Kidney (BEST Kidney) Investigators. Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA 2005;294:813–818.
- Kategorie: Novinky v nefrologii
- Klíčová slova: hemodialyzační léčba