Perspektivy: Transplantační tolerance
Experimentální práce v minulosti dokázaly, že je možné vyvinout takový stav, kdy po transplantaci nedochází trvale k imunitní reakci proti dárcovským antigenům a transplantát dlouhodobě přežívá bez potřeby imunosuprese. Navození této transplantační (imunitní) tolerance by vedlo v klinické medicíně vedle zjevných ekonomických úspor i ke snížení výskytu řady komorbidit, především kardiovaskulárních komplikací a nádorů.
Výzkum navození imunitní tolerance k transplantátu probíhá již déle než 50 let. V roce 1960 obdrželi Burnet a Medawar za příspěvek k objevu tolerance Nobelovu cenu za fyziologii a medicínu. Práce Bellinghama, Brenta a Medawara, publikovaná v roce 1953 v Nature, vycházela původně z překvapivých pozorování publikovaných Owenem v roce 1945 o častém výskytu hematologických chimér u dvojčat skotu. Při pokusech na skotu, myších a kuřatech bylo zjištěno, že tato zvířata nereagují v dospělosti na cizí antigeny v případech, kdy byly vystaveny přítomnosti těchto antigenů v průběhu vývoje plodu. Navíc bylo zjištěno, že nejen nereagují na buněčnou suspenzi geneticky cizího organismu, která byla injikována do cévního systému plodu, ale že v dospělosti nereagují na kožní štěp odebraný z organismu o stejném genetickém pozadí jako bylo použité inokulum. Významným zjištěním bylo, že takto popsaná získaná tolerance je aktivním, imunologicky specifickým procesem. Milan Hašek publikoval v Čs. biologii v roce 1953, tedy ve stejném roce jako Medawar, pozorování, že parabionti, spojená embrya dvou geneticky odlišných druhů kuřat, po vzájemné imunizaci svými séry nevytváří žádné protilátky. Milan Hašek Nobelovu cenu nezískal, ale pro českou transplantologii je důležité, že jeho práce byla připomenuta před třemi roky na stránkách Transplantation k padesátiletému výročí významných Medawarových objevů.
Po prvních úspěších v 50. až 60. letech, kdy se zdálo, že navození tolerance v klinice bude otázkou krátkého času, došlo k velkému vystřízlivění. Výzkum transplantační tolerance pokročil až v posledních deseti letech, kdy se objevily nové pokroky především v buněčné terapii. Protože je výzkum tolerance významný především pro plátce zdravotní péče, vznikly dvě velké výzkumné skupiny, jak v USA (Immune Tolerance Network), tak i v Evropské unii (Reprogramming of Immune System for Establishing Tolerance), které jsou financovány s cílem pokročit v zavedení nových postupů vedoucí k navození imunitní tolerance v klinické transplantologii.
Monoklonální protilátky a navození transplantační tolerance
Uplynulo dvacet let od objevu, že krátkodobá léčba monoklonální protilátkou proti CD4 antigenu na T lymfocytu vede u myší k imunitní toleranci k cizím antigenům podávaným ve stejné době (1). Ačkoli první protilátky proti znaku CD4 vedly k depleci (vy mizení) lymfocytů obsahující tento antigen, později se ukázalo, že pro navození tolerance není deplece nezbytná (2,3). Takto navozená tolerance závisela především na periferních imunitních mechanismech spíše než centrálních, protože odstranění thymu nemělo žádný vliv na výsledky (4). Tato forma periferní tolerance nebyla způsobena ani klonální eliminací dárcovsky specifických T lymfocytů (5). Nyní víme, že protilátky proti znakům CD2, LFA-1, CD45R, CD3, CD40L (CD154) a CTLA4-Ig, jsou všechny schopné u hlodavců indukovat transplantační toleranci (6). Všechny tyto experimentální studie popsaly asociaci mezi tolerancí a přítomností regulačních T lymfocytů.
Transplantační toleranci udržují regulační T lymfocyty
Výzkumy s neonatální tolerancí přinesly již v sedmdesátých letech důkazy o přítomnosti supresivních T lymfocytů, které jsou namířeny proti cizím proteinům nebo alloantigenům (7). Později bylo prokázáno, že jediným vysvětlením účinku výše uvedených monoklonálních protilátek byla právě tvorba supresorových nebo regulačních T lymfocytů (8). Následně se ukázalo, že lze uskutečnit i přenos tolerance dalším příjemcům bez dalších manipulací a že tento přenos tolerance závisí pouze na T lymfocytech CD4+ (9). Rovněž je známo, že se T lymfocyty u dalších příjemců mohou „edukovat“ za přítomnosti původní populace tolerantních T buněk. Tento proces se nazývá „infekční tolerance“ a vysvětluje, jak je možné, že jednou navozená tolerance může trvat po tak dlouhou dobu, po jakou jsou přítomny antigeny dárce (10).
Charakteristika regulačních T lymfocytů
Dosud nejvíce prozkoumanou populací regulačních T lymfocytů jsou přirozené CD4+ a CD25+ Treg (11), které jsou tvořeny v thymu (12). Je známo, že tyto buňky jsou namířeny proti vlastním antigenům (13) a že exprimují transkripční faktor foxp3, který je nezbytný pro jejich diferenciaci (14). Bylo prokázáno, že přirozené Treg udržují vlastní toleranci u různých modelů autoimunitních onemocnění (15). Přirozené Treg jsou podmínkou dlouhodobého přijetí transplantátu a jsou závislé na specifických dárcovských antigenech (16). Tyto buňky mohou potlačit nejenom antigen specifické T lymfocyty, ale i přirozenou obranyschopnost organismu proti běžným patogenům u myší, u nichž byly odstraněny T lymfocyty (17).
V současnosti je jasné, že existuje mnoho různých populací lymfocytů, které mají regulační vlastnosti (obr. 1) (18). Kromě přirozených Treg, které exprimují foxp3, existují další regulační buňky, které ale nejsou tak dobře prozkoumané. Mezi tyto regulační buňky patří CD8+ lymfocyty, které také exprimují foxp3 (19), NK T buňky (20), CD4-CD8- T lymfocyty (21), Th3 buňky secernující transformující růstový faktor β1 (TGF-β1), anergní CD4+ T lymfocyty (22) a regulační Tr1 T lymfocyty, které exprimují interleukin 10 (23).
Dendritické buňky a tolerance
V současnosti je jasné, že dentrické buňky nejsou jenom významné pro upozornění imunitního systému na přítomnou infekci (24), ale že jsou také schopné cirkulovat mezi tkáněmi a udržovat toleranci proti vlastním antigenům (25). Zatím není jasné, zda existují přirozené dendritické buňky zajišťující toleranci nebo zda nezralé dentritické buňky hrají roli v toleranci, kdežto zralé buňky se uplatní při zánětu. Ví se, že řada farmak (vitamin D3, TGF-β1, IL-10, kyselina acetylsalicylová a dexamethason (26,27,28) je schopna změnit reaktivitu dentritických buněk pocházejících z kostní dřeně tak, aby se mohly uplatnit v toleranci. Takto změněné buňky exprimují na svém povrchu méně MHC antigenů II. třídy a kostimulačních ligand, jakými jsou CD40, CD80 a CD86 a zároveň sekretují méně prozánětlivých cytokinů, jakými je interleukin 12.
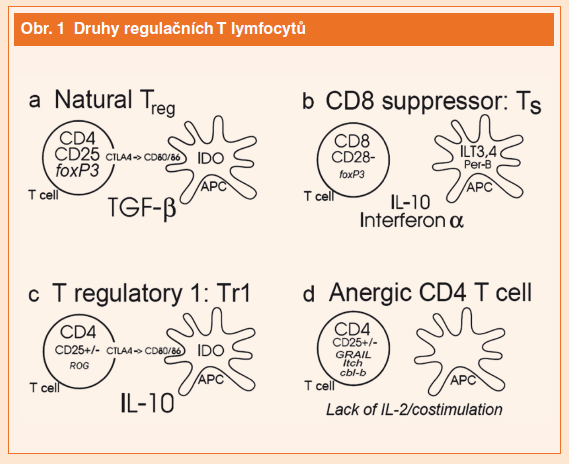
Existují minimálně čtyři druhy regulačních T lymfocytů, zobrazeny jsou rovněž jejich interakce s antigen prezentující buňkou (APC).
- “Přirozené” Treg jsou buňky CD4+CD25+foxp3+, které se tvoří v thymu nebo na periferii cestou aktivace T lymfocytů v prostředí, kde dominuje transformující růstový faktor β1 (TGF-β1). Tyto buňky exprimují molekulu CTLA4, která se váže na CD80/CD86 na dendritických buňkách a potlačuje aktivitu efektorových T.
- CD8 supresorové lymfocyty (Ts) jsou rovněž foxp3+ a neexprimují CD28. Tvoří se za přítomnosti interferonu a interleukinu 10 (IL-10) a ovlivňují APC k negativní kostimulaci.
- T regulační buňky typu 1 (Tr1) se tvoří při stimulaci specifickým antigenem za přítomnosti IL-10, ale neexprimují faktor foxp3, místo něhož tvoří jiné supresorové faktory, např. ROG. Produkují CTLA-4 stejně jako přirozené Treg.
- Anergní CD4+ T lymfocyty se tvoří aktivací T lymfocytů, pokud není přítomen interleukin 2 nebo kostimulační signál a chabě odpovídají na přítomnost antigenu.
Negativní kostimulační signál
Aktivace naivního T lymfocytu dendritickou buňkou je zprostředkována řadou kostimulačních signálů (tzv. signál 2), které vznikají interakcí rodiny receptorů CD28, CD86 a receptoru pro tumor nekrotizující faktor se svými ligandy na antigen prezentující buňce. Výsledná úroveň kostimulačního signálu závisí na bilanci pozitivních a negativních signálů, které zajišťují jednotlivé kostimulační molekuly. Pozitivní signál pro aktivaci T lymfocytu je dán například vazbou CD28 na své ligandy CD80 a CD86 na antigen prezentující buňce. Na druhé straně, pokud se molekula CTLA-4 váže na stejné ligandy, je poskytnut silný negativní signál, který zabrání aktivaci T lymfocytu. Protože je molekula CTLA-4 normálně exprimována pouze po aktivaci naivního nebo efektorového lymfocytu a CD28 je exprimován konstitutivně, je jasné, že po rozpoznání antigenu dominuje aktivace lymfocytů, zatímco později se CTLA-4 uplatní v potlačení neadekvátní aktivace a proliferace klonů T lymfocytů (29). Vazba CTLA-4 na CD80/CD86 má za následek funkční změnu antigen prezentující buňky směrem k toleranci. Další molekulou z rodiny CD28 je PD-1 (programmed cell death 1) a ta se rovněž uplatňuje v negativním kostimulačním signálu (30). Tato molekula má rovněž dva ligandy (PD-L1 a PD-L2), které jsou podobně jako CD80/CD86 z rodiny B7 a jsou schopny potlačit rejekci štěpu zprostředkovanou CD4+ lymfocyty (31). Ligand PD-L1 je zvýšeně exprimován v placentě (32) a hraje kritickou roli v navození tolerance vůči plodu.
Monoklonální protilátka proti CD154 blokuje kostimulační signál a vychyluje imunitní reaktivitu směrem k toleranci (33). Mechanismus zahrnuje potlačení vyzrávání dendritických buněk a jejich aktivaci, ale rovněž může zahrnovat aktivaci cytoprotektivní molekuly hemoxygenázy (HO-1) jak na antigen prezentující buňce příjemce, tak ve tkáních štěpu (34).
Hemoxygenáza a oxid uhelnatý v T lymfocytech, antigen prezentujících buňkách a ve tkáních
Hemoxygenáza (HO-1) je enzym, který se uplatňuje v degradaci hemu a v tvorbě železa, oxidu uhelnatého a biliverdinu. Myši deficientní pro HO-1 vyvíjejí chronické autoimunitní onemocnění se splenomegalií, zánětem jater a glomerulonefritidou (35). Deficit HO-1 u lidí vede k lymfadenopatii a ke zvýšené citlivosti vůči oxidačnímu stresu (36). Exprese HO-1 v tkáni, která je tolerována imunitním systémem, může chránit před poškozením aktivovanými neutrofi ly a makrofágy spojené s oddálenou hypersenzitivní reakcí, a proto se řada autorů domnívá, že vysvětluje účinky regulačních T lymfocytů CD4+CD25+ (37). Navíc generace oxidu uhelnatého sama o sobě má antiproliferační účinky na imunitní i neimunitní buňky. U naivních T lymfocytů oxid uhelnatý blokuje produkci interleukinu 2 (38), čímž se podílí na jejich budoucí anergii (imunitní neodpovídavosti). U myší podaný CO potlačuje zánět u autoimunitní kolitidy (39) a rovněž zabraňuje up-regulaci inducibilní syntetázy oxidu dusnatého (iNOS) a s ním spojených toxických molekul asociovaných s Th1 imunitní odpovědí (40).
Každopádně se zdá být nyní jasné, že se ve štěpu uplatňují všechny naznačené mechanismy v odpovědi na přítomnost regulačních T lymfocytů a že udržení tolerance závisí na aktivní účasti antigen prezentujích buněk (např. dendritických buněk) i samotné tkáně štěpu.
Závěry
Výzkum transplantační tolerance se v poslední době zaměřil na roli regulačních T lymfocytů v potlačování imunitní odpovědi. Zdá se, že i role samotného štěpu v ochraně před alloantigen specifickou imunitní odpovědí příjemce hraje značnou roli. Tyto poznatky nyní volají po urychleném zavedení takových laboratorních testů, které spolehlivě odhalí chování imunitního systému příjemce před snížením nebo dokonce vysazením imunosuprese. Některá imunosupresiva totiž působí proti imunitní toleranci tím, že blokují signály pro tvorbu regulačních T lymfocytů (41). V blízké budoucnosti se do klinické praxi mohou dostat nové testy, například měření přítomnosti regulačních T lymfocytů analýzou transkripčního faktoru foxp3 v moči. Významnější ale bude zavést takové metody, které spolehlivě umožní redukovat nebo dokonce vysazovat imunosupresi, aniž by došlo k ohrožení štěpu rejekcí. V budoucnu by mohly být vyvinuty i takové postupy, které do plní funkci regulačních T lymfocytů tím, že zajistí zvýšený přepis ochranných genů přímo ve štěpu samotném.
Literatura
- Benjamin RJ, Cobbold SP, Clark MR, Waldmann H. Tolerance to rat monoclonal antibodies. Implications for serotherapy.J Exp Med 1986;163:1539–1552.
- Benjamin RJ, Qin SX, Wise MP, et al. Mechanisms of monoclonal antibody-facilitated tolerance induction: a possible role for the CD4 (L3T4) and CD11a (LFA-1) molecules in self-non-self discrimination.Eur J Immunol 1988; 18:1079–1088.
- Gutstein NL, Wofsy D. Administration of F(ab‘)2 fragments of monoclonal antibody to L3T4 inhibits humoral immunity in mice without depleting L3T4+ cells.J Immunol 1986;137:3414–3419.
- Cobbold SP, Qin S, Leong LY, et al. Reprogramming the immune system for peripheral tolerance with CD4 and CD8 monoclonal antibodies.Immunol Rev 1992;129:165–201.
- Cobbold SP, Adams E, Marshall SE, et al. Mechanisms of peripheral tolerance and suppression induced by monoclonal antibodies to CD4 and CD8.Immunol Rev 1996;149:5–33.
- Waldmann H, Hale G, Cobbold S. Appropriate targets for monoclonal antibodies in the induction of transplantation tolerance.Philos Trans R Soc Lond B Biol Sci. 2001;356:659–663.
- Gershon RK, Kondo K. Infectious immunological tolerance.Immunology 1971; 21:903–914.
- Qin S, Cobbold SP, Pope H, et al. „Infectious“ transplantation tolerance.Science 1993;259:974–977.
- Chen ZK, Cobbold SP, Waldmann H, Metcalfe S. Amplification of natural regulatory immune mechanisms for transplantation tolerance.Transplantation 1996; 62:1200–1206.
- Scully R, Qin S, Cobbold S, Waldmann H. Mechanisms in CD4 antibody mediated transplantation tolerance: kinetics of induction, antigen dependency and role of regulatory T cells.Eur J Immunol 1994;24:2383–2392.
- Sakaguchi S, Toda M, Asano M, et al. T cellmediated maintenance of natural self-tolerance: its breakdown as a possible cause of various autoimmune diseases.J Autoimmun 1996;9:211–220.
- Jordan MS, Boesteanu A, Reed AJ, et al. Thymic selection of CD4+CD25+ regulatory T cells induced by an agonist self-peptide.Nat Immunol 2001; 2:301–306.
- Romagnoli P, Hudrisier D, van Meerwijk JP. Preferential recognition of self antigens despite normal thymic deletion of CD4(+) CD25(+) regulatory T cells.J Immunol 2002;168:1644–1648.
- Khattri R, Cox T, Yasayko SA, Ramsdell F. An essential role for Scurfin in CD4+CD25+ T regulatory cells.Nat Immunol 2003;4:337–342.
- Chatenoud L, Salomon B, Bluestone JA. Suppressor T cells – they‘re back and critical for regulation of autoimmunity!Immunol Rev 2001;182:149–163.
- Benghiat FS, Graca L, Braun MY, et al. Critical influence of natural regulatory CD25+ T cells on the fate of allografts in the absence of immunosuppression.Transplantation 2005;79:648–654.
- Maloy KJ, Salaun L, Cahill R, et al. CD4+CD25+ T(R) cells suppress innate immune pathology through cytokine dependent mechanisms.J Exp Med 2003; 197:111–119.
- Waldmann H, Chen TC, Graca L, et al. Regulatory T cells in transplantation.Semin Immunol 2006;18:111–119.
- Manavalan JS, Kim-Schulze S, Scotto L, et al. Alloantigen specific CD8+CD28- FOXP3+ T suppressor cells induce ILT3+ ILT4+ tolerogenic endothelial cells, inhibiting alloreactivity.Int Immunol 2004;16:1055–1068.
- Nakamura T, Sonoda KH, Faunce DE, et al. CD4(+) NKT cells, but not conventional CD4(+) T cells, are required to generate efferent CD8(+) T regulatory cells following antigen inoculation in an immune-privileged site.J Immunol 2003; 171:1266–1271.
- Zhang ZX, Young K, Zhang L. CD3+CD4-CD8- alphabeta-TCR+ T cell as immune regulatory cell.J Mol Med. 2001;79:419–427.
- Lechler R, Chai JG, Marelli-Berg F, Lombardi G. T-cell anergy and peripheral T-cell tolerance.Philos Trans R Soc Lond B Biol Sci 2001;356:625–637.
- Groux H, O’Garra A, Bigler M, et al. A CD4+ T-cell subset inhibits antigen -specifi c T-cell responses and prevents colitis.Nature 1997;389:737–742.
- Liu LM, MacPherson GG. Antigen acquisition by dendritic cells: intestinal dendritic cells acquire antigen administered orally and can prime naive T cells in vivo.J Exp Med 1993;177:1299–1307.
- Huang FP, MacPherson GG. Continuing education of the immune system – dendritic cells, immune regulation and tolerance.Curr Mol Med 2001;1: 457–468.
- Gregori S, Casorati M, Amuchastegui S, et al. Regulatory T cells induced by 1 alpha,25-dihydroxyvitamin D3 and mycophenolate mofetil treatment mediate transplantation tolerance.J Immunol 2001;167:1945–1953.
- Hackstein H, Morelli AE, Larregina AT, et al. Aspirin inhibits in vitro maturation and in vivo immunostimulatory function of murine myeloid dendritic cells.J Immunol 2001;166:7053–7062.
- Roelen DL, Schuurhuis DH, van den Boogaardt DE, et al. Prolongation of skin graft survival by modulation of the alloimmune response with alternatively activated dendritic cells.Transplantation 2003;76:1608–1615.
- Salomon B, Bluestone JA. Complexities of CD28/B7: CTLA-4 costimulatory pathways in autoimmunity and transplantation.Annu Rev Immunol 2001;19:225–252.
- Carter L, Fouser LA, Jussif J, et al. PD-1:PD-L inhibitory pathway affects both CD4(+) and CD8(+) T cells and is overcome by IL-2.Eur J Immunol 2002; 32:634–643.
- Ito T, Ueno T, Clarkson MR, et al. Analysis of the role of negative T cell costimulatory pathways in CD4 and CD8 T cell-mediated alloimmune responses in vivo.J Immunol 2005;174:6648–6656.
- Petroff MG, Chen L, Phillips TA, et al. B7 family molecules are favorably positioned at the human maternal-fetal interface.Biol Reprod 2003;68:1496–1504.
- Kirk AD, Harlan DM, Armstrong NN, et al. CTLA4-Ig and anti-CD40 ligand prevent renal allograft rejection in primates.Proc Natl Acad Sci USA 1997; 94:8789–8794.
- Shen XD, Ke B, Zhai Y, et al. CD154-CD40 T-cell costimulation pathway is required in the mechanism of hepatic ischemia/reperfusion injury, and its blockade facilitates and depends on heme oxygenase-1 mediated cytoprotection.Transplantation 2002;74:315–319.
- Kapturczak MH, Wasserfall C, Brusko T, et al. Heme oxygenase-1 modulates early inflammatory responses: evidence from the heme oxygenase-1-deficient mouse.Am J Pathol 2004;165:1045–1053.
- Nagy E, Jeney V, Yachie A, et al. Oxidation of hemoglobin by lipid hydroper oxide associated with low-density lipoprotein (LDL) and increased cytotoxic effect by LDL oxidation in heme oxygenase-1 (HO-1) deficiency.Cell Mol Biol (Noisy-le-grand) 2005;51:377–385.
- Brusko TM, Wasserfall CH, Agarwal A, et al. An integral role for heme oxygenase-1 and carbon monoxide in maintaining peripheral tolerance by CD4+CD25+ regulatory T cells.J Immunol 2005;174:5181–5186.
- Pae HO, Oh GS, Choi BM, et al. Carbon monoxide produced by heme oxygenase- 1 suppresses T cell proliferation via inhibition of IL-2 production.J Immunol 2004;172:4744–4751.
- Hegazi RA, Rao KN, Mayle A, et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway.J Exp Med 2005; 202:1703–1713.
- Datta PK, Koukouritaki SB, Hopp KA, Lianos EA. Heme oxygenase-1 induction attenuates inducible nitric oxide synthase expression and proteinuria in glomerulonephritis.J Am Soc Nephrol 1999;10:2540–2550.
- Kirk AD, Burkly LC, Batty DS, et al. Treatment with humanized monoclonal antibody against CD154 prevents acute renal allograft rejection in nonhuman primates. Nat Med 1999;5:686–693.
- Kategorie: Novinky v nefrologii
- Klíčová slova: perspektivy; transplantace ledvin