Trombóza renálních stentgraftů jako příčina akutního selhání ledvin
Kazuistika
Pětašedesátiletý muž byl vyšetřován na urgentním příjmu pro neobvyklé, náhle vzniklé bolesti břicha převážně v oblasti podžebří a bederní krajiny vpravo. Z důležitých anamnestických dat: léčil se doposud s arteriální hypertenzí, hyperlipidemií (prozatím nedosaženo cílové hodnoty cholesterolu v lipoproteinech o nízké hustotě [LDL cholesterolu], pozitivní rodinná anamnéza – dědeček zemřel na infarkt myokardu ve 41 letech) a diabetes mellitus 2. typu na perorálních antidiabetikách, dále byl zajištěn duální antiagregační terapií (kyselina acetylsalicylová [ASA], klopidogrel), neboť před pěti lety prodělal parciální resekci abdominálního aneurysmatu aorty s náhradou aorto‑aortální protézou, následně pro rozvoj paraanastomotické výdutě zavedeny aortobiilické stenty endovaskulárně do obou renálních tepen a do arteria mesenterica. K vyloučení náhlé příhody břišní byl v rámci nemocniční triáže směrován na chirurgickou ambulanci. Laboratorní vyšetření odhalilo známky akutního renálního poškození (urea 9 mmol/l, kreatinin 150 µmol/l), mírnou elevaci hodnot obstrukčních enzymů (gama‑glutamyltransferáza [GGT] 2,5 µkat/l), elevaci zánětlivých parametrů (C‑reaktivní protein 26 mg/l) a aktivní močový sediment (mikroskopickou hematurii a leukocyturii – erytrocyty 14, leukocyty 170). Z doplněných zobrazovacích metod nebyly prokázány známky náhlé příhody břišní na rentgenu (obr. 1), sonografie vyloučila obstrukci vývodných cest močových, doložila normální nález na játrech, slezině i pankreatu.
OBR. 1 RTG břicha. Bez známek náhlé příhody břišní, flebolity v malé pánvi. Zobrazen stentgraft aortobiilický a renálních tepen.
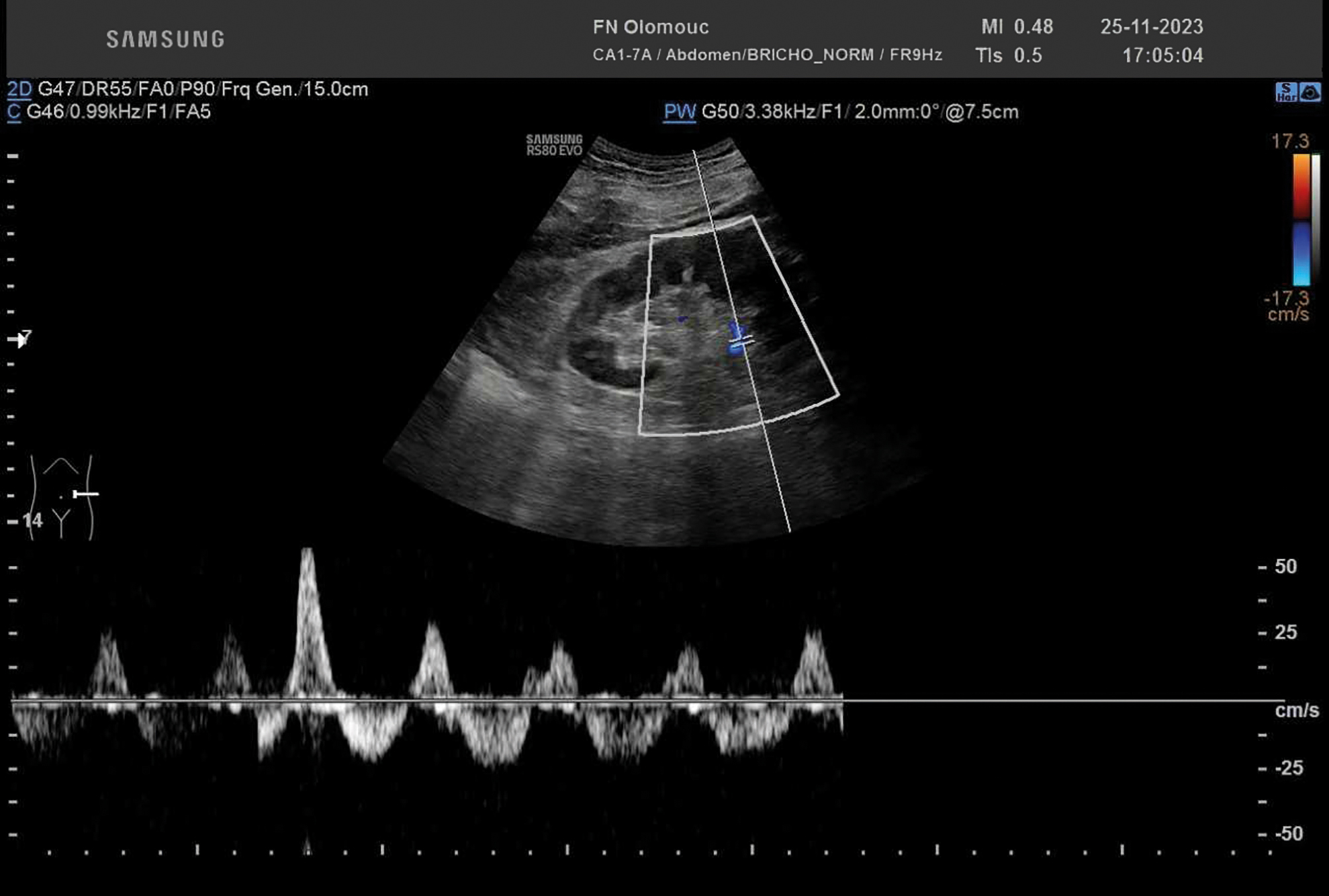
Dle elektrokardiografie a kardiospecifických enzymů byl vyloučen akutní koronární syndrom. Nemocný byl zaléčen spasmolytiky a propuštěn domů se zajištěním kontroly na ambulanci následující den. Za necelých 24 hodin laboratorní nález vykazoval rapidní progresi akutního renálního poškození s nárůstem kreatinemie ze 150 na 430 µmol/l s rozvojem anurie a zhoršením klinických potíží, bolesti se nyní začaly propagovat i do zad. Stav byl hodnocen jako suspektní počínající akutní pyelonefritida vpravo. V rámci diferenciální diagnostiky byla zopakována sonografie ledvin včetně dopplerovského měření s překvapivým záchytem snížené perfuze – tedy se známkami bilaterální akutní renální ischemie (obr. 2).
OBR. 2 Ultrazvuk ledvin včetně dopplerovského měření se zobrazením velmi chudého prokrvení v periferii včetně obstrukčního toku v segmentální tepně.
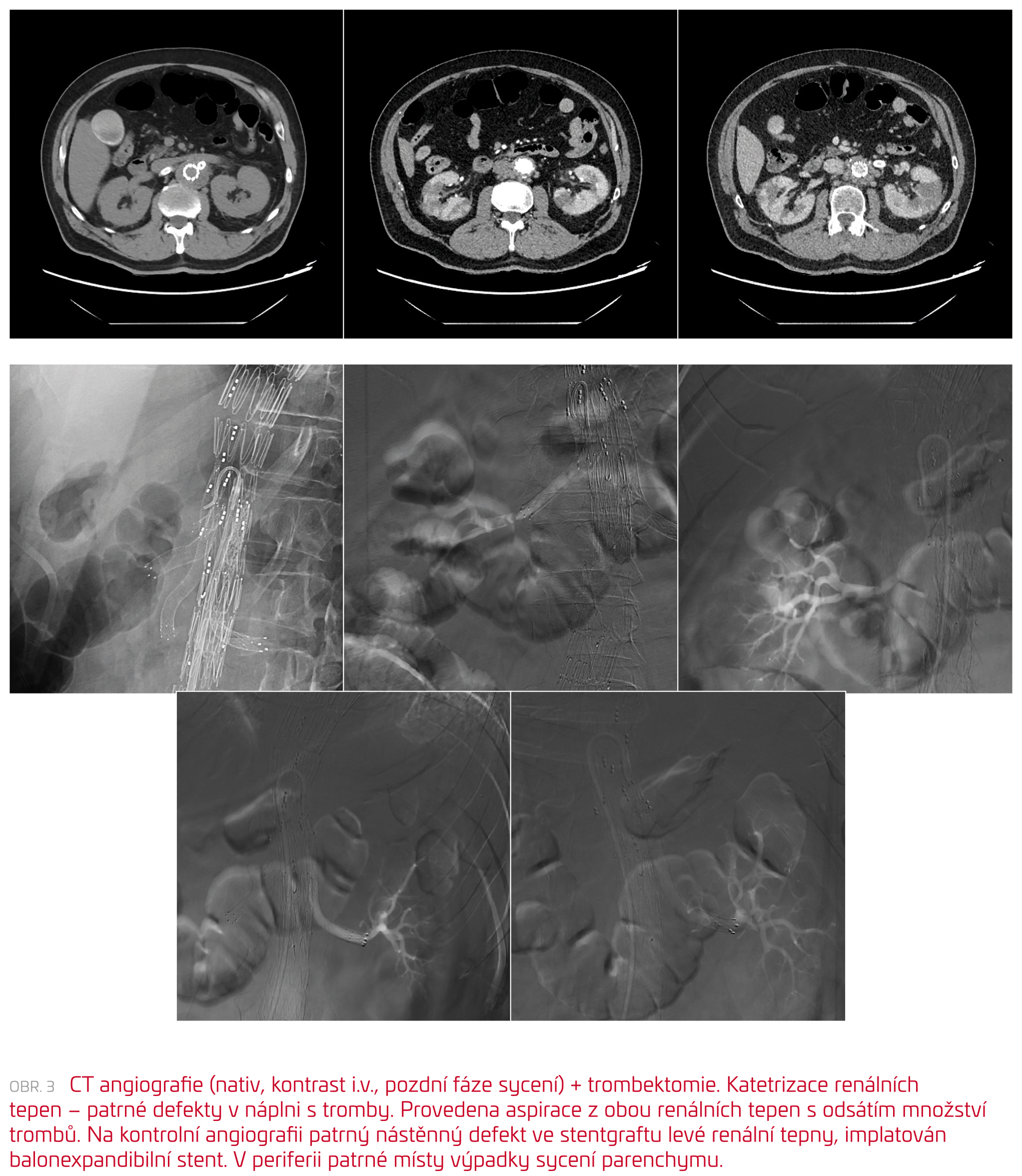
Angiografie potvrdila uzávěr renálních stentgraftů větvené aortální náhrady. Stav byl urgentně řešen aspirační trombektomií bilaterálně, v levé renální tepně se zavedením stentu pro patrný nástěnný defekt (obr. 3).
Vzhledem k trvající anurii, dalšímu vzestupu hodnot kreatininu a rozvoji hyperkalemie byl pacient přechodně intermitentně dialyzován s následným rozvojem diurézy. Dialyzační podpůrná terapie byla ukončena po měsíci při parciální reparaci renální funkce. Vyšetření trombofilií neprokázalo hereditární trombofilní stav (negativní leidenská mutace i protrombin, zjištěna pouze zvýšená hodnota faktoru VIII a fibrinogenu, aktivovaný protein C negativní). Za vznikem arteriální trombózy stentgraftů stála neúčinnost antiagregační terapie při rezistenci. Adekvátní odpověď na léčbu v inhibici agregace indukované kyselinou arachidonovou byla stanovena pod 25 % a při léčbě thienopyridiny v inhibici agregace indukované adenosindifosfátem (ADP) s prostaglandinem E1 (PGE1) pod 45 %. Po rozpoznání diagnózy byl pacient pooperačně zajištěn triple terapií (klopidogrel, ASA, nízkomolekulární heparin), otázkou zůstávalo, jak takového pacienta léčit dále. Zvažovala se možnost zvýšení dávky ASA (pro překonání rezistence) nebo její nahrazení či kombinace s jiným antiagregačním lékem. Nicméně podle recentních doporučení prospěšnost aditivní antiagregační terapie u těchto pacientů nebyla prokázána.1 Postupovali jsme tedy jako u nemocných v rámci sekundární prevence s ischemickou chorobou srdeční či onemocněním periferních tepen ve studii COMPASS, která prokázala účinnost užití monoagregancia a antikoagulancia.2 V tomto raritním případě jsme podali klopidogrel (75 mg/den) a antikoagulaci dle glomerulární filtrace, zprvu nízkomolekulární heparin subkutánně dvakrát denně s následným převodem na rivaroxaban 2,5 mg dvakrát denně po reparaci renálních funkcí. V dalším období se stav komplikoval ortostatickým kolapsem s hypotenzí při posílené terapii akcelerované hypertenze s následnou retrombózou renální arterie vlevo. Opět bylo přistoupeno k trombektomii stentgraftu a přechodné intermitentní náhradě funkce ledvin dialýzou. Renální funkce jsou nyní stacionární na úrovni koncentrace kreatininu 213 µmol/l. Od poslední rehospitalizace zůstává pacient bez dalších komplikací nebo recidivy uzávěru na zavedené terapii a důsledné kontrole hypertenze. Nadále pravidelně dochází na kontroly v nefrologické ambulanci.
Komentář
Literatura
- Krasopoulos G, Brister SJ, Beattie WS, Buchanan MR. Aspirin “resistance” and risk of cardiovascular morbidity: systematic review and meta‑analysis. BMJ 2008;336:195–198.
- Šustr F, Souček M. Rivaroxaban in Compass trial. Vnitř Lék 2020:66:197–198.
- Táborský M, Linhart A, Karetová D, et al. Antitrombotická léčba u onemocnění aorty a periferních tepen v roce 2021. Cor Vasa 2021;63:748–759.
- Černá M, Köcher M, Utíkal P, et al. Late complications after stent‑graft implantation for abdominal aortic aneurysm in patients followed for ten or more years. Čes Radiol 2023;77:7–11.
- Kazimi AU, Weber CF, Keese M, Miesbach W. The Pre‑ and Postoperative Prevalence and Risk Factors of ASA Nonresponse in Vascular Surgery. Clin Appl Thromb Hemost 2021;27:10760296211044723.
- Mayer O. Klinický význam rezistence na protidestičkovou léčbu a možnosti jejího řešení. Interní Med 2012;14:209–212.
- Ševčíková H, Vojáček J, Pudil R, et al. Rezistence na protidestičkovou terapii v kardiologické praxi. Interv Akut Kardiol 2006;5:256–258.
- Zehnder JL, Tantry US, Gurbel PA. Nonresponse and resistance to aspirin. Online. In: UpToDate, October 2024. Dostupné z: https://medilib.ir/uptodate/show/16946. [citováno 2024‑09‑15].
- Tantry US, Hennekens CHH, Zehnder JL, Gurbel PA. Clopidogrel resistance and clopidogrel treatment failure. Online. In: UpToDate, October 2024. Dostupné z: https://medilib.ir/uptodate/show/6684. [citováno 2024‑09‑15].
- Krejčí K, Zadražil J, Al‑Jabry S, et al. Akutní selhání ledvin. Interní Med 2007;2:84–87.
- Kategorie: Kazuistiky
- Klíčová slova: akutní poškození ledvin; klinické studie; renální stentgraft ; rezistence na kyselinu acetylsalicylovou; studie COMPASS
Bolesti břicha se vyskytují u celé řady onemocnění. Pro stanovení správné diagnózy v širokém spektru diferenciální diagnostiky je zásadní pečlivě odebraná anamnéza spolu s klinickými příznaky a laboratorními výsledky. Endograftová trombóza je přítomna u více než 20 % případů po endovaskulární léčbě, zásadní je proto dlouhodobé sledování pacientů. Ve dvou třetinách případů zůstávají tromby stabilní nebo mizejí.3,4 V sekundární prevenci kardiovaskulárních příhod se předepisuje antiagregační léčba. Rezistence na protidestičkovou terapii představuje závažnou limitaci, ačkoli dosud není znám postup, který by byl podložen důkazy pro snížení tohoto rizika. Až 24 % pacientů vykazuje rezistenci na ASA, prevalence rezistence na klopidogrel se pohybuje mezi 5–10 % a vykazuje vysokou interindividuální variabilitu. Etiologie je komplexní (tab. 1 a 2).5–7
Mechanismus vzniku rezistence je ovlivněn mnoha faktory, přičemž nejčastější příčinou v praxi je nedodržování léčby pacientem a interakce s jinými léky (nesteroidními antiflogistiky). Své místo zde má i nedostatečně léčená hypercholesterolemie, která prokazatelně vede ke zvýšení počtu destičkových agregátů a k tvorbě trombinu, čímž snižuje antitrombotický efekt ASA. Laboratorní testování rezistence není plošně doporučováno, ale může být užitečné pro posouzení adherence k léčbě ASA nebo pro identifikaci vzácných genetických abnormalit, a to zejména u pacientů s familiární hypercholesterolemií, neboť snížení koncentrace cholesterolu je jedním z faktorů vedoucích ke snížení rezistence na ASA.8,9 Vyšší dávky antitrombotik k překonání rezistence nejsou doporučeny, recentní studie prokázaly vyšší riziko krvácení.6 Incidence akutního renálního selhání v předhospitalizační fázi dosahuje přibližně 100 případů na milion, přičemž při vstupním vyšetření je diagnostikováno pouze u 1 % pacientů. Prerenální selhání tvoří asi 20 % všech akutních selhání ledvin a zahrnuje i postižení renální arterie, jako je stenóza nebo uzávěr renální tepny. Závažnou komplikací může být rozvoj sekundární arteriální hypertenze, která je často rezistentní na léčbu. I přes pokroky v léčebných opatřeních zůstávají morbidita a mortalita spojené s akutním selháním ledvin stále velmi vysoké.10
Podpořeno MZ ČR RVO FNOL‑0098892
a IGA_LF_2024_004.