Léčba nemocných s mnohočetným myelomem a renálním selháním
Souhrn
Poškození funkce ledvin monoklonálním imunoglobulinem, resp. klonálními lehkými řetězci patří mezi nejčastější klinické projevy mnohočetného myelomu, prevalence v celém průběhu onemocnění se pohybuje mezi 25–50 % případů. V následujícím sdělení se autor věnuje jak etiologii poškození ledvin u monoklonálních gamapatií, tak i možné léčbě, a kromě toho i novým poznatkům zjištěným v oblasti epidemiologie mnohočetného myelomu.
Základní podmínkou pro úspěšnou záchranu funkcí ledvin zůstává nadále časná diagnostika základního onemocnění. Na její zlepšení u mnohočetného myelomu do budoucna je zaměřen projekt CRAB II České myelomové skupiny.
Etiologie poškození funkce ledvin u mnohočetného myelomu
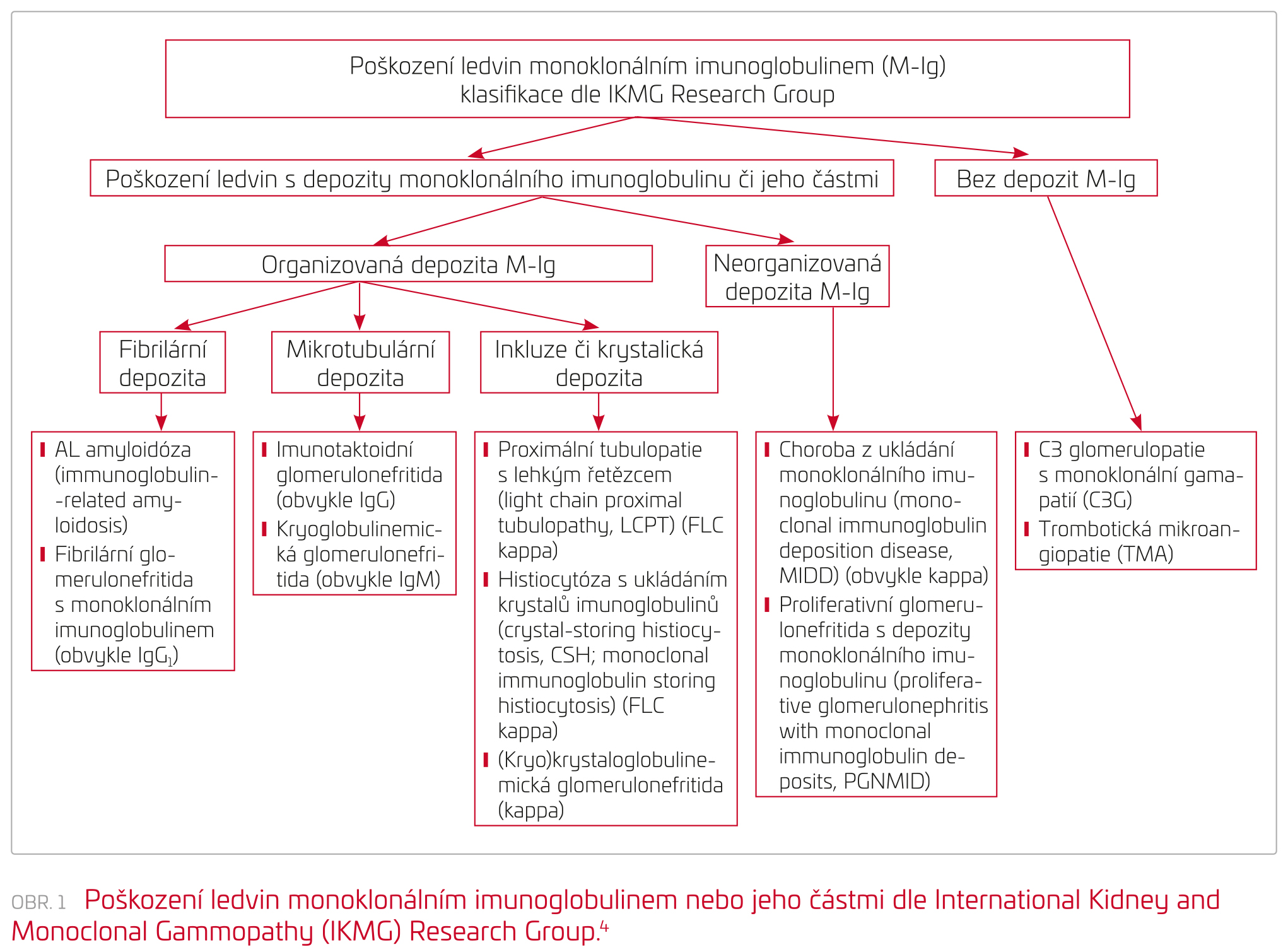
Základní laboratorní charakteristikou monoklonálních gamapatií (MG) je přítomnost monoklonálního imunoglobulinu (M‑Ig), eventuálně pouze jeho částí v séru a/nebo v moči. V rámci aktuálně platných diagnostických kritérií mnohočetného myelomu (MM) je pak základním diagnostickým kritériem průkaz minimálně desetiprocentní infiltrace kostní dřeně klonálními plazmatickými (myelomovými) buňkami.1 Monoklonální imunoglobulin, resp. klonální volné lehké řetězce mohou poškozovat ledviny, což se může projevit kombinací nefrotického a nefritického syndromu: proteinurií, hematurií, renální insuficiencí, hypertenzí, sníženou hodnotou komplementu a tubulárními poruchami. Prevalence poškození ledvin v celém průběhu mnohočetného myelomu se pohybuje mezi 25–50 %. Dialyzační léčba je pak během onemocnění nutná přibližně u 12 % pacientů s MM.2 Forma poškození ledvin úzce souvisí s koncentrací M‑Ig a volných lehkých řetězců (free light chain, FLC). Odlitková nefropatie (cast nephropathy) vzniká, když množství profiltrovaných FLC převýší resorpční kapacitu proximálního tubulu, takže se FLC dostávají do Henleovy kličky, v níž probíhá koncentrace moči, a proto zde dochází k tvorbě odlitkových válců.3 K poškození ledvin však může dojít i při nízkých koncentracích M‑Ig a FLC, kdy počet plazmocytů nenaplní kritéria myelomu (monoclonal gammopathy of renal significance). K nejčastějšímu poškození ledvin nízkými koncentracemi FLC dochází u AL amyloidózy a „light chain deposition disease“. Existují však četné další formy nefropatií pří nízkých koncentracích M‑Ig či FLC. Diagnostika a klasifikace těchto poruch by měly být prováděny dle doporučení International Kidney and Monoclonal Gammopathy Research Group na pokladě imunohistochemického, případně elektronmikroskopického hodnocení biopsie ledvin,4 jejíž provedení je tak k odlišení jednotlivých forem postižení nutné (viz obr. 1). Poškození ledvin M‑Ig anebo FLC může dále akcelerovat dehydratace s oligurií, případně hyperkalcemie a hyperurikemie, možné je i poškození ledvinných funkcí zánětem ledvin nebo močových cest, eventuálně spojené s podáním nefrotoxických léků.
Nové poznatky v epidemiologii MM v České republice
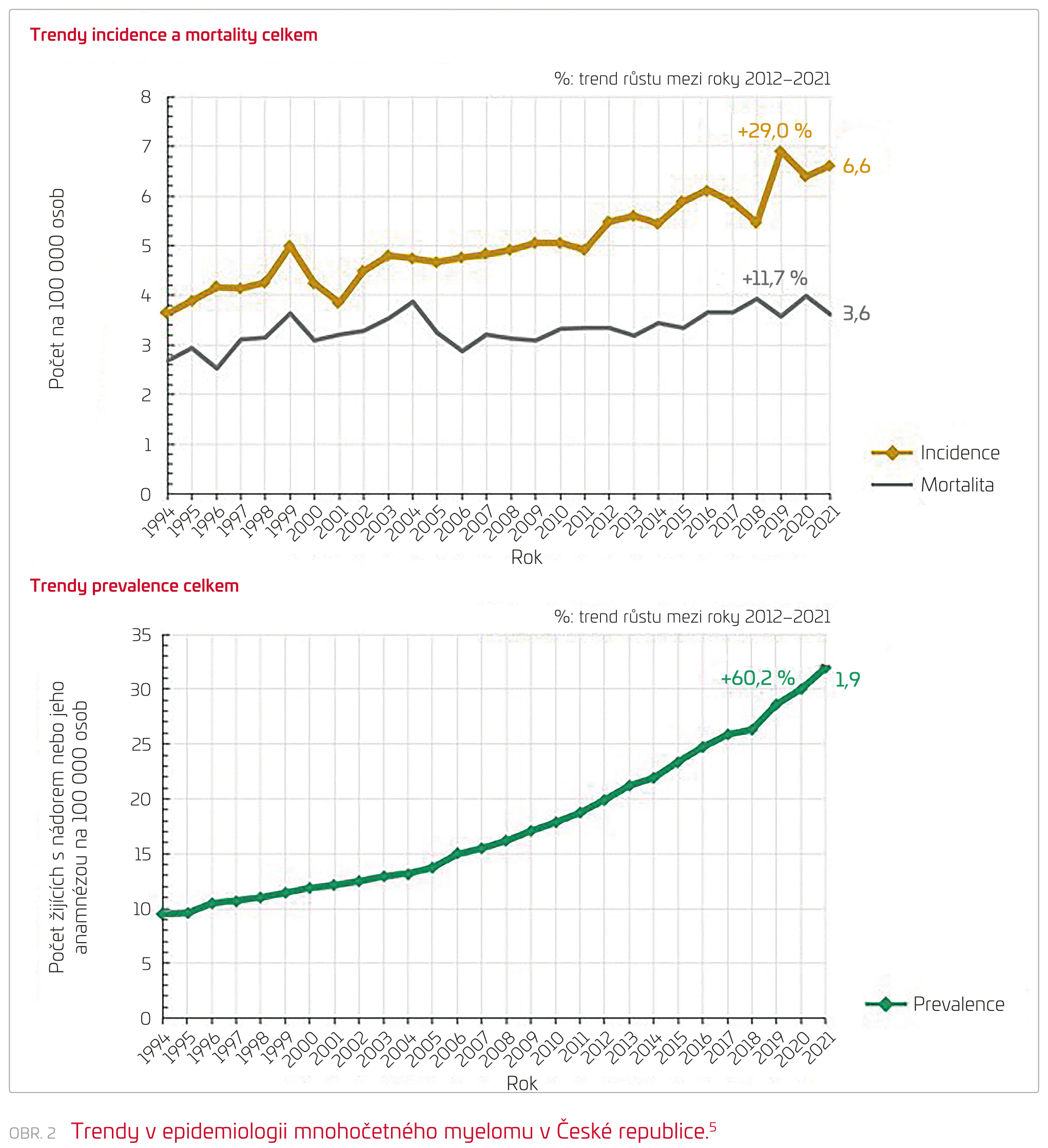
V posledních dvou desetiletích došlo v léčbě MM k neuvěřitelnému pokroku. Kombinované léčebné režimy jsou dnes schopny dosáhnout kompletní remise u většiny nemocných. Přesto je MM stále považován za dlouhodobě nevyléčitelné onemocnění, a to vzhledem k vysokému riziku pozdních relapsů, ke kterým může dojít i po více než deseti letech od ukončení léčby. Dalším nepříznivým faktem pro nemocné je skutečnost, že nadále téměř u poloviny nemocných je onemocnění diagnostikováno pozdě, což potvrdila v letošním roce i proběhlá dotazníková akce v rámci projektu CRAB II České myelomové skupiny. Od prvních známek onemocnění, které jsou velmi různorodé, do stanovení diagnózy uplynou ve většině případů více než tři měsíce. Proto se bohužel nedá předpokládat, že bychom se do budoucna měli s renálním postižením setkávat méně často. Bude to pravděpodobně naopak, a to vzhledem ke zvyšující se incidenci této hematologické malignity. Pro čtenáře bude jistě zajímavý fakt, že podle poslední analýzy dat z Národního onkologického registru provedené pro účely nových Doporučení pro diagnostiku a léčbu MM České myelomové skupiny vzrostla incidence MM v České republice ze 2,3 v roce 1980 přes 4,8 v roce 2014 na 6,6 na 100 000 obyvatel ročně v roce 2021, což znamená přibližně 29% nárůst za posledních deset let. Tak jak byl pro nás takový vývoj incidence MM v České republice v minulém roce překvapením, v letošním roce jsme se dočkali potvrzení obdobných trendů i v rámci mezinárodních analýz. Prevalence MM v České republice narostla mezi lety 2012 až 2021 dokonce o 60,2 %. I v prevalenci lze pozorovat od roku 1990 podobný trend jako u incidence se vzestupem počtu žijících nemocných s MM na 100 000 obyvatel, a to z 6,3 na 18,8 v roce 2014 a následně na 31,9 v roce 2021 (viz obr. 2).5 Důvodem výrazného nárůstu prevalence pacientů s MM je kromě jeho narůstající incidence zejména významné zlepšení výsledků léčby, ke kterému od přelomu tisíciletí u mnohočetného myelomu došlo.
Léčba nemocných s MM a renální insuficiencí
V léčbě mnohočetného myelomu hrají dnes prim kombinované léčebné režimy, kdy aktuálně jsou ještě používány převážně trojkombinace, nicméně v blízké budoucnosti dojde zřejmě k rychlému rozšíření využívání ještě účinnějších čtyřkombinací, které obsahují kromě bazální dávky kortikoidu dále kombinaci léků ze tří základních lékových skupin, tj. zástupce protilátek proti buňkám MM, proteazomových inhibitorů a imunomodulačních léčiv. Přehled léků z jednotlivých skupin včetně nutné redukce jejich dávek v případě renální insuficience uvádí následující tabulka 1.
V tabulce zatím chybějí nejmodernější léky ze skupiny bi‑, respektive trispecifických protilátek a léčiv CAR‑T (chimeric antigen receptor T cells, T lymfocyty geneticky modifikované pomocí chimérických antigenních receptorů), u nichž lze ale předpokládat, že stejně jako u ostatních dosud používaných protilátek nebude při podávání nemocným se sníženou funkcí ledvin nutná žádná redukce používaných dávek. Zatím jsou však tyto léky používány zejména v rámci klinických studií, kterých se ve většině případů nemocní s renální insuficiencí účastnit nemohou z důvodu nesplnění vstupních „inclusion“, respektive „exclusion“ kritérií, takže jasné doporučení pro použití v této indikaci zatím chybí. Z trojkombinačních režimů byly dosud u nemocných s renální insuficiencí používány režimy BDD (bortezomib‑doxorubicin‑dexamethason) a VTD (bortezomib‑thalidomid‑dexamethason), v poslední době se nejčastěji využívá dvou režimů – VRD (bortezomib‑lenalidomid‑dexamethason), u něhož je ale nutná příslušná redukce dávky lenalidomidu, a PVD (pomalidomid‑bortezomib‑dexamethason) bez nutnosti úpravy dávkování. Ve všech případech je však před zahájením cílené protimyelomové léčby nutná dostatečná hydratace nemocného. Opatrnosti je třeba u anurických nemocných, kde by velká nálož tekutin mohla způsobit převodnění se vznikem plicního edému.7 V případě současné hyperkalcemie je možné při mírné renální insuficienci využití léků ze skupiny bisfosfonátů (zoledronátu, ev. pamidronátu), v případě výraznější ledvinové nedostatečnosti je nutné použití denosumabu.8 V jiných případech může být nutné léčebné ovlivnění hyperurikemie a hyperfosfatemie (např. v rámci „tumor necrosis“ syndromu), eventuálně cílené zaléčení infekční komplikace.
Dialyzační léčba a transplantace ledvin u nemocných s MM
Při závažném renálním selhání je nutné využití dialyzační léčby. Její použití je nutné i v případě hyperkalcemie nad 4,0 mmol/l anebo v případě symptomatické hyperkalcemie vzhledem ke skutečnosti, že se její efekt projeví ihned,7 na rozdíl od léčby bisfosfonáty či denosumabem, kdy k poklesu kalcemie dochází obvykle až po 48 hodinách. Dialyzační léčba může být u nemocných s MM využita i k úpravě hyperurikemie a hyperfosfatemie v rámci „tumor necrosis“ syndromu. V roce 2005 byla uvedena na trh nová forma dialyzační membrány s cílem umožnit clearance látek s vyšší molekulovou hmotností. Tyto „high cut‑off hemodialyzátory“ (HCO‑HD) umožňují odstranění molekul s hmotností 50–60 kDa, mimo jiné tedy i volných lehkých řetězců. Dosud provedené dvě velké randomizované studie však neprokázaly signifikantní dlouhodobé zlepšení funkce ledvin a signifikantní rozdíl v následné nezávislosti na dialýze. První z těchto studií měla příznivější výsledky ve skupině s HCO‑HD, které však nebyly statisticky významné.9,10 S „medium cut‑off“ membránami (MCO), které mají snižovat sérové koncentrace FLC a neovlivňovat koncentrace albuminu, zatím nejsou u pacientů s mnohočetným myelomem zkušenosti.11
V posledních letech se významně změnily i názory na transplantaci ledvin u pacientů s MM. Dnes existuje již řada publikací na toto téma, v nichž se uvádí, že v případech víceleté kompletní remise či stabilní parciální remise mnohočetného myelomu již není transplantace ledviny považována za absolutně kontraindikovanou. Autoři jedné z nich doporučují v rámci posuzování indikace provedení transplantace vycházet z míry agresivity MM a na základě toho zařadit pacienta do jedné ze tří prognostických kategorií a zohlednit, zda probíhá léčba, nebo zda je pacient po ukončené léčbě ve stabilní kompletní či parciální remisi:
- u osob s aktivním MM a selháním ledvin je namístě léčba myelomu, a ne transplantace;
- osoby s nízce rizikovým MM by měly být sledovány nejméně šest měsíců po ukončené léčbě myelomu, a pokud trvá remise, pak je možné zvažovat případné zařazení do transplantačního programu;
- osoby se středně rizikovým myelomem by po ukončené léčbě měly být sledovány nejméně 12 měsíců, než se začne v případě trvání remise zvažovat transplantace ledviny;
- u osob s vysoce agresivním myelomem převáží rizika transplantace ledviny a s ní spojené imunosupresivní léčby její potenciální přínos, a transplantace se proto neindikuje.12
Riziko recidivy myelomu po transplantaci ledviny nadále trvá, dokonce je potencováno potransplantační udržovací imunosupresivní léčbou, ale toto riziko je nutné akceptovat a pak se nepovažuje za kontraindikaci transplantace. V několika případech byla popsána akutní, poměrně rychlá rejekce transplantátu v souvislosti s podáváním imunomodulačního léku lenalidomidu. A proto by léky ze skupiny imunomodulačních (IMiD) měly být po transplantaci ledviny použity s opatrností. V případě recidivy MM po transplantaci ledviny je nutné léčit relaps myelomu standardními postupy a zpravidla se redukují, ale nevysazují zavedená imunosupresiva po orgánové transplantaci, což samozřejmě zvyšuje riziko vzniku infekce s fulminantním průběhem.13
Závěr
Základní podmínkou pro úspěšnou záchranu funkcí ledvin je hlavně časná diagnostika a použití známých standardních opatření, jako jsou dostatečná hydratace a řešení minerální dysbalance, zvláště pak rychlé dosažení normokalcemie. Pro iniciální léčbu mnohočetného myelomu u pacientů s poškozenou funkcí ledvin se doporučuje režim s rychlým nástupem účinku, s dobrou tolerancí, a především s vysokou šancí na léčebnou odpověď s využitím plné dávky léku. Důležité je však především zahájit léčbu rychle, ať už je použit jakýkoliv léčebný režim. Nezbytná je důsledná monitorace nežádoucích účinků, vstupní redukce dávek dle doporučení a včasné snížení dávky či následně vysazení léků při zvýšené toxicitě. Nutná je opatrnost při používání nesteroidních antiflogistik a úprava dávek řady léků, např. derivátů morfinu a bisfosfonátů. Při rozvaze o vysokodávkované chemoterapii je nutné zvážit její potenciální přínos při současně podstatně vyšším riziku komplikací, než je obvyklé u pacientů s normální funkcí ledvin.
Literatura
- Hájek R, Maisnar V, Minařík J, et al. Diagnostika a léčba mnohočetného myelomu. Transfuze Hematol Dnes 2023;29(Suppl. 2):1–142.
- Dimopoulos MA, Sonneveld P, Leung N, et al. International Myeloma Working Group Recommendations for the Diagnosis and Management of Myeloma‑Related Renal Impairment. J Clin Oncol 2016;34:1544–1557.
- Menè P, Stoppacciaro A, Lai S, et al. Light Chain Cast Nephropathy in Multiple Myeloma: Prevalence, Impact and Management Challenges. Int J Nephrol Renovasc Dis 2022;15:173–183.
- Leung N, Bridoux F, Batuman V, et al. The evaluation of monoclonal gammopathy of renal significance: a consensus report of the International Kidney and Monoclonal Gammopathy Research Group. Nat Rev Nephrol 2019;15:45–59.
- Národní onkologický registr, aktuální analýza z roku 2023. Online. In: Ústav zdravotnických informací a statistiky.
- Bozic B, Rutner J, Zheng CH, et al. Advances in the treatment of relapsed refractory multiple myleoma in patients with renal insufficiency: Novel agents, immunotherapies and beyond. Cancers (Basel) 2021;13:5036.
- Bridoux F, Leung N, Belmouaz M, et al. International Kidney and Monoclonal Gammopathy Research Group. Management of acute kidney injury in symptomatic multiple myeloma. Kidney Int 2021;99:570–580.
- Terpos E, Raje N, Croucher P, et al. Denosumab compared with zoledronic acid on PFS in multiple myeloma: exploratory results of an international phase 3 study. Blood Adv 2021;5:725–736.
- Bridoux F, Carron PL, Pegourie B, et al. Effect of high‑cutoff hemodialysis vs conventional hemodialysis on hemodialysis independence among patients with myeloma cast nephropathy. JAMA 2017;318:2099–2110.
- Hutchison CA, Cockwell P, Moroz V, et al. High cutoff versus high‑flux haemodialysis for myeloma cast nephropathy in patients receiving bortezomib‑based chemotherapy (EuLITE): a Phase 2 randomised controlled trial. Lancet Haematol 2019;6:e217–e228.
- Kandi M, Brignardello‑Petersen R, Couban R, et al. Effects of Medium Cut‑Off Versus High‑Flux Hemodialysis Membranes on Biomarkers: A Systematic Review and Meta‑Analysis. Can J Kidney Health Dis 2022;9:20543581211067090.
- Chitty DW, Hartley‑Brown MA, Abate M, et al. Kidney transplantation in patients with multiple myeloma: narrative analysis and review of the last two decades. Nephrol Dial Transplant 2022;37:1616–1626.
- Lum EL, Bunnapradist S. Current opinions in nephrology and hypertension: kidney transplantation in patients with plasma cell dyscrasias. Curr Opin Nephrol Hypertens 2019;28:573–580.
- Kategorie: Názor hosta
- Klíčová slova: etiologie; léčba; mnohočetný myelom; monoklonální gamapatie ; poškození ledvin