Renální toxicita cílené léčby v onkologii
Souhrn
Renální toxicita onkologické farmakoterapie je relativně častým fenoménem, a to nejen u cytostatik, ale rovněž u novějších cílených onkologických léků. Toxické účinky mohou postihnout jak glomerulární cévy a podocyty, tak i tubulární buňky a intersticium a mohou způsobit jak zhoršení glomerulární filtrace, tak i poškození tubulárních funkcí. V článku jsou popsány nejčastější renální nežádoucí projevy léků ze skupin inhibitorů angiogeneze, blokátorů epidermálního růstového faktoru, inhibitorů BCR‑ABL, inhibitorů BRAF a dalších tyrozinkinázových inhibitorů. Jsou zmíněny rovněž inhibitory proteazomu a imunomodulátory používané v terapii mnohočetného myelomu a inhibitory cyklin‑dependentních kináz. Závěrem jsou uvedeny specifické nežádoucí účinky inhibitorů imunitních kontrolních bodů. Kromě stručné patogeneze zmiňujeme i preventivní postupy a doporučení pro léčbu některých forem nefrotoxicity cílené onkologické léčby.
Klíčová slova: blokátory epidermálního růstového faktoru – inhibitory angiogeneze – inhibitory cyklin‑dependentních kináz – inhibitory imunitních kontrolních bodů – monoklonální protilátky – nefrotoxicita – tyrozinkinázové inhibitory
Úvod
Výskyt akutního poškození ledvin (AKI) je u onkologických pacientů přibližně třikrát častější než u celkové populace.1 K obvyklým příčinám rozvoje AKI zde přistupují i specificky onkologické příčiny, jako je syndrom nádorového rozpadu, paraneoplastická nefropatie rozvíjející se nejčastěji u plicních a gastrointestinálních nádorů, myelomová ledvina, lymfomová infiltrace a další.1–3 V neposlední řadě se pak na zvýšené frekvenci výskytu AKI podílí i protinádorová léčba s nefrotoxickým potenciálem.1 V některých případech tak není jednoduché rozlišit mezi paraneoplastickou a polékovou příčinou AKI bez přistoupení k renální biopsii.4 V následujícím textu se budeme věnovat nefrotoxicitě „novějších“ cílených léčiv používaných v onkologické terapii, především monoklonálních protilátek a tyrozinkinázových inhibitorů (TKI). Stranou ponecháme „klasickou“ cytotoxickou chemoterapii, o které bylo v této souvislosti publikováno velké množství literatury.3
Mezi rizikové faktory pro rozvoj nefrotoxicity patří především vyšší věk, ženské pohlaví, hypertenze, diabetes mellitus, hypoalbuminemie, volumová deplece (připomeňme často úporné průjmy jako skupinový nežádoucí účinek většiny TKI),5 případně srdeční selhávání a preexistující chronické onemocnění ledvin (CKD).6 Při úvahách o nefrotoxicitě onkologických léků je vždy třeba myslet i na další potenciálně nefrotoxickou farmakoterapii, jako jsou nesteroidní protizánětlivé léky (NSA), inhibitory protonových pump (PPI), kontrastní látky, bisfosfonáty, nefrotoxická antibiotika a další.3,7 Je vhodné rovněž zjistit, zda pacient neužívá potenciálně nefrotoxické bylinné přípravky či jiné volně prodejné léčivé přípravky (OTC).8
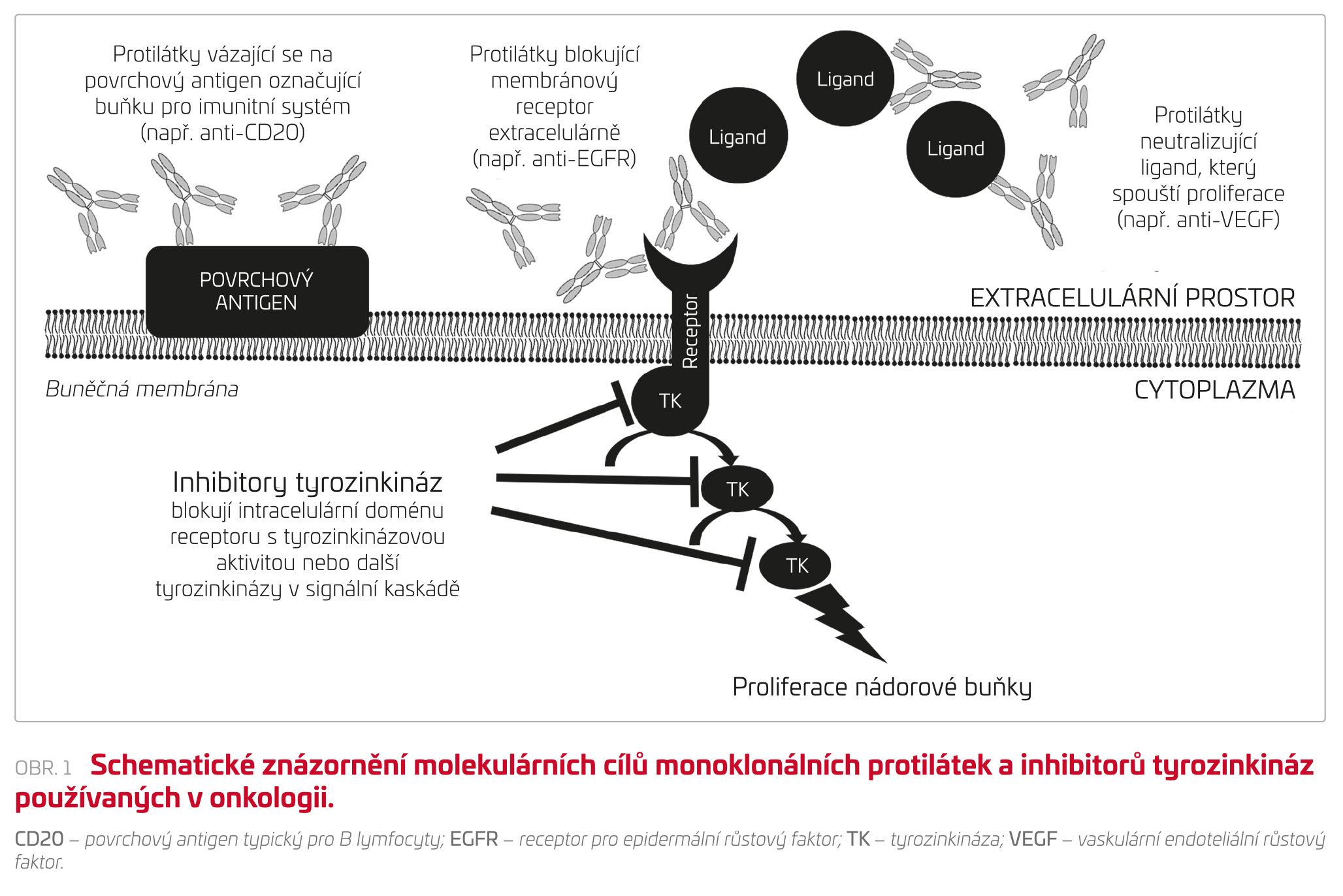
Jako cílenou léčbu v onkologii označujeme především léky, které selektivě inhibují proteiny v patologicky aktivovaných signálních kaskádách spouštějících proliferaci nádorových buněk, případně takto označujeme léky, které se váží na konkrétní antigen na povrchu nádorové buňky a aktivují proti ní imunitní odpověď. V současné době je dostupná celá řada monoklonálních protilátek a malých molekul TKI, které cílí na stejné signální kaskády, ale na jiném místě (extracelulárně nebo intracelulárně). Hovoříme tak o terapii zaměřené na vaskulární endoteliální růstový faktor (VEGF), receptor pro epidermální růstový faktor (EGFR) a podobně. Zatímco farmakokinetické vlastnosti těchto léčiv jsou dány charakterem molekuly a TKI jsou v tomto ohledu dramaticky odlišné od protilátek,5 farmakodynamické vlastnosti, včetně nežádoucích účinků, lze často spíše odvodit od jejich molekulárních cílů. Proto budeme v některých případech dále v textu léky dělit spíše podle cílových signálních kaskád, které inhibují, než podle chemické struktury. Schematické znázornění možných intra‑ a extracelulárních molekulárních cílů monoklonálních protilátek a TKI je znázorněno na obrázku 1. Dále se budeme věnovat i nové skupině protinádorové imunoterapie a některým dalším lékům, jako jsou inhibitory cyklin‑dependentních kináz, inhibitory proteazomu atd.
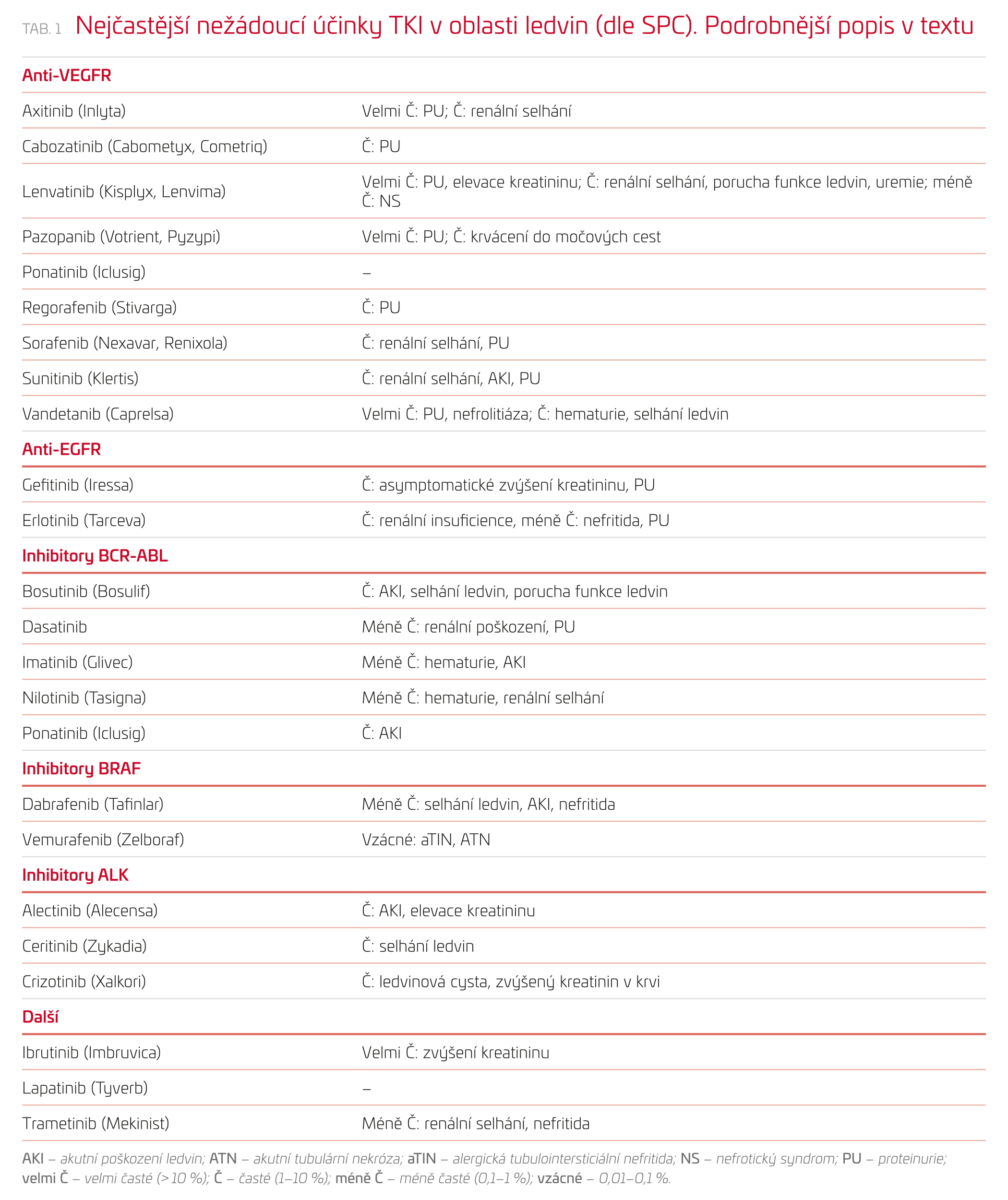
Stran etiologie renálního poškození lze mezi cílenými onkologickými léky najít skupiny potenciálně poškozující glomerulární endotel a podocyty (např. anti‑VEGF), léky způsobující tubulární toxicitu (anti‑EGFR), léky s nefrotoxicitou primárně postihující intersticium (inhibitory BRAF) a léky spouštějící autoimunitní reakce namířené proti ledvinám (inhibitory imunitních kontrolních bodů).9 Pro rychlejší přehled a porovnání četnosti uvádíme v tabulce 1 seznam nejvýznamnějších TKI podle molekulárních cílů a výskyt renálních nežádoucích účinků dle Souhrnu údajů o přípravku (SPC). Dalším možným projevem je prerenální selhání a rozvoj minerálové dysbalance a hypovolemie při vyvolání průjmů, které jsou popsány jako typický skupinový efekt TKI.5 Obecně v tomto článku nemůžeme podat vyčerpávající přehled všech popsaných nefrotoxických projevů nové onkologické léčby, a zaměřujeme se tedy na nejčastější a typické projevy jednotlivých skupin.
Jednotlivé skupiny léčiv
Skupinou relativně nových léčiv, která mohou způsobit renální toxicitu, jsou inhibitory angiogeneze. Patří sem léky interferující s účinkem VEGF, ať už extracelulárně neutralizací tohoto působku v plazmě (bevacizumab, aflibercept), nebo inhibicí tyrozinkináz v intracelulární kaskádě spouštěné aktivací receptoru pro VEGF (sunitinib, sorafenib, pazopanib, ponatinib, axitinib, kabozantinib, regorafenib, vandetanib, lenvatinib). Podávání těchto léků je spojeno s rozvojem arteriální hypertenze, proteinurie (PU) a AKI.1,3,9 Z hlediska patogeneze je zajímavé, že VEGF má receptory i v ledvinách a jejich inhibicí dochází mj. k downregulaci exprese nefrinu. Může tedy dojít k poškození proteinové filtrační membrány mezi pedicelami (slit diaphragm). V biopsii pacientů s PU vyvolanou anti‑VEGF léky byla popsána povětšinou trombotická mikroangiopatie (TMA) podobná nálezům v biopsii pacientek s preeklampsií, čemuž odpovídá i skutečnost, že placenta při preeklampsii produkuje solubilní receptor VEGF, který antagonizuje účinek VEGF. Výskyt PU výrazně kolísá v klinických studiích a závisí mj. na typu léčeného nádoru a souběžné medikaci. Vyšší výskyt PU pozorujeme při léčbě nádoru z renálních buněk (RCC) než u jiných nádorů, což může být zčásti způsobeno reaktivní hyperfiltrací reziduálních nefronů po nefrektomii. V případě bevacizumabu byl popsán častější výskyt PU v kombinaci s pamidronátem, což podtrhuje potřebu revize farmakoterapie a pokud možno eliminace dalších nefrotoxinů (v tomto případě je vhodnější použití méně nefrotoxického ibandronátu).10 PU vyvolaná anti‑VEGF terapií je většinou alespoň zčásti reverzibilní.2 Riziko rozvoje závažné PU stoupá při kombinaci více léků z této skupiny, naopak v případě rozvoje závažné PU při terapii jedním lékem může být úspěšný převod na jinou medikaci.1 Před zahájením terapie anti‑VEGF léky by měl být pacient vyšetřen na možnou přítomnost renálního onemocnění a následně by měla být prováděna opakovaná kontrola v průběhu léčby (v případě monoklonálních protilátek před každým cyklem). Při rozvoji nefrotického syndromu (NS) nebo TMA je doporučeno zvážit vysazení anti‑VEGF terapie při zhodnocení poměru benefit/riziko. Prognostický efekt nespecifické antiproteinurické léčby nebyl v této indikaci zkoumán, nicméně v případě rozvoje hypertenze s PU je doporučeno zvážit nasazení inhibitorů angiotenzin konvertujícího enzymu či blokátorů receptoru AT1 pro angiotenzin II.2,9 Sorafenib a regorafenib kromě výše uvedených nežádoucích účinků vyvolávají rovněž hypofosfatemii a hypokalcemii pravděpodobně související s poškozením pankreatu, které vede k malabsorpci vitaminu D a sekundární hyperparatyreóze. Proto je vhodné při terapii těmito léky kontrolovat hodnotu vitaminu D a kalcemii.9
Blokátory receptoru pro epidermální růstový faktor (EGFR) rovněž mohou vyvolat nefrotoxicitu, v tomto případě s predominancí poškození tubulárního aparátu. EGFR jsou exprimovány v ledvinách především v distálním tubulu a sběrném kanálku, kde funguje epidermální růstový faktor jako parakrinní hormon regulující reabsorpci hořčíku. Kromě toho aktivace EGFR urychluje regeneraci buněk po akutní tubulární nekróze (ATN). Podávání monoklonálních protilátek blokujících EGFR vede až u 10 % pacientů k rozvoji významné hypomagnezemie, mírný pokles magnezemie je téměř pravidlem. Výskyt závažné hypomagnezemie stoupá s délkou léčby, rychlost jejího rozvoje a závažnost jsou však individuální. Bylo popsáno, že cetuximab blokuje transport iontových kanálů pro hořčík na apikální stranu buněk vzestupné části Henleovy kličky a distálního kanálku.9,11 Je zajímavé, že tento nežádoucí účinek se vyskytuje u monoklonálních protilátek (cetuximab, panitumumab), a nikoliv po podání TKI blokujících intracelulární kaskádu navazující na EGFR (erlotinib, gefitinib).11 Před nasazením anti‑EGFR léčby monoklonálními protilátkami je vhodné provést revizi ostatní farmakoterapie s rizikem navození hypomagnezemie, kromě thiazidových diuretik to mohou být např. PPI.7
Podobným mechanismem jako anti‑EGFR terapie působí i inhibitory lidského epidermálního růstového faktoru 2 (HER‑2) používané v léčbě karcinomu prsu a dalších nádorů. Pertuzumab a lapatinib patřící do této skupiny nejsou spojeny s rizikem nefrotoxicity. Rovněž trastuzumab není nefrotoxickým lékem, nicméně vzhledem ke kardiotoxickému potenciálu může sekundárně vyvolat kardiorenální syndrom.9
V terapii chronické myeloidní leukemie a akutní lymfoblastické leukemie nacházejí uplatnění inhibitory BCR‑ABL kinázy vedoucí k potlačení proliferace buněk obsahujících mutovaný, tzv. filadelfský chromozom. Ten kóduje kinázu nereagující na regulační signály a trvale aktivující proliferaci buněk. Selektivita imatinibu, dasatinibu, nilotinibu, bosutinibu a ponatinibu ovšem není úplná, a tyto přípravky tak blokují celou řadu dalších tyrozinkináz, včetně různých enzymů vyskytujících se v tubulech a glomerulárních cévách. Farmakovigilanční studie popisuje 1 409 renálních nežádoucích účinků inhibitorů BCR‑ABL kinázy nahlášených celosvětově za přibližně 18 let. Více než polovina se týkala imatinibu, nicméně bylo zjištěno, že všech pět inhibitorů BCR‑ABL kinázy může způsobit retenci tekutin, případně renální selhání.12 Etiologicky se může jednat o syndrom nádorového rozpadu, který je spojen s rychlým rozvojem renální insuficience, a po odeznění AKI je možno pokračovat v započaté léčbě. V některých případech však renální insuficience nastupuje pozvolněji a je spojena s rozvojem přímé tubulární toxicity (ATN, vakuolizace tubulárních buněk, Fanconiho syndrom).9,13 I u těchto pacientů je v některých případech možné pokračovat v léčbě, nicméně s jiným inhibitorem BCR‑ABL kinázy.13 Dalšími zachycenými projevy nefrotoxicity jsou vzácné případy NS (dasatinib, nilotinib) a poškození endotelií, včetně TMA (ponatinib, nilotinib, dasatinib, který je mj. též inhibitorem VEGFR). Ponatinib a nilotinib mohou akcelerací aterosklerózy způsobit stenózu renálních tepen.12
Z léků používaných především v terapii melanomu jmenujme inhibitory BRAF, zejména vemurafenib.4,14 U tohoto léčiva byly popsány dva typy poškození – AKI vyskytující se v prvních dvou týdnech léčby, pravděpodobně na podkladě alergické tubulointersticiální nefritidy (aTIN), a dále postižení spíše charakteru ATN rozvíjející se zpravidla první až druhý měsíc léčby, což bylo potvrzeno i v několika biopsiích. Může dojít rovněž k rozvoji hypokalemie, hyponatremie a hypofosfatemie s PU, které však nedosahují nefrotické úrovně. Zdá se, že predispozicí pro rozvoj AKI po vemurafenibu je, oproti většině dalších léků, mužské pohlaví. Výskyt nefrotoxicity po léčbě novějším zástupcem této skupiny – dabrafenibem – je ve srovnání s vemurafenibem vzácnější, a to i v kombinaci s inhibitorem mitogenem aktivované proteinové kinázy (MEK) trametinibem,14 který sám pravděpodobně výrazné riziko rozvoje nefrotoxicity nepředstavuje.9 Při terapii dabrafenibem byla relativně často (7 %) popisována hypofosfatemie. Je doporučeno časté monitorování mineralogramu, renálních funkcí a PU v průběhu prvních dvou měsíců terapie inhibitory BRAF. V případě, že nedojde k rozvoji renální toxicity do konce druhého měsíce léčby, je možné snížit frekvenci kontrol na čtvrtletní.14
Inhibitory kinázy anaplastického lymfomu (ceritinib, alectinib, ale především crizotinib) mohou sice způsobit reálný pokles glomerulární filtrace (GFR), nicméně zpravidla způsobují na počátku terapie pouze reverzibilní vzestup hodnoty kreatininu, která po vysazení léčby opět klesne; tento vzestup je pravděpodobně způsoben interferencí s jeho tubulární sekrecí. Crizotinib rovněž může navíc indukovat reverzibilní tvorbu cyst v ledvinách nebo vést k progresi velikosti cyst již přítomných.9,15
Mezi další TKI, jež se neřadí do žádné z výše zmíněných skupin, patří např. ibrutinib, inhibitor Brutonovy kinázy pro léčbu chronické lymfocytární leukemie a dalších hematologických malignit. Zvýšení hodnoty kreatininu je u tohoto léku popsáno jako velmi častý nežádoucí účinek s možným rozvojem AKI, případně syndromu nádorového rozpadu. Je doporučeno po dobu terapie pravidelně kontrolovat hodnotu kreatininu v krvi a hydrataci pacienta.9
Mezi relativně nové léky v léčbě mnohočetného myelomu (MM) patří inhibitory proteazomu. Zatímco po léčbě bortezomibem bylo doloženo pouze několik málo případů TMA, carfilzomib způsobuje poškození ledvin významně častěji. Ve studii fáze 2 bylo popsáno AKI až u 25 % pacientů, s progresivním průběhem u 3,8 % pacientů. Kromě TMA se etiologicky jedná většinou o syndrom nádorového rozpadu. Predisponováni jsou především pacienti s renální manifestací MM a s clearance kreatininu (ClCr) < 30 ml/min.4 Dle SPC carfilzomibu (Kyprolis) je doporučeno kontrolovat v průběhu terapie renální funkce minimálně jednou měsíčně.16 Další léky v terapii MM představují tzv. imunomodulátory. V této skupině jsou rizikovější stran nefrotoxicity nové léky – lenalidomid a pomalidomid, zatímco thalidomid pravděpodobně spojen s významným rizikem rozvoje renálního poškození není.4
Inhibitory cyklin‑dependentních kináz (CDK, palbociclib, ribociclib, abemaciclib) brání proliferaci nádorových buněk tím, že zablokují patologicky aktivovaný buněčný cyklus. Blokádou CDK 4 a CDK 6 dochází k zástavě buněčného cyklu ve fázi G1 a inhibitory CDK nacházejí v současné době využití především v terapii karcinomu prsu.17 Ribociclib a abemaciclib zvyšují koncentraci kreatininu v krvi blokádou jeho aktivní sekrece v proximálních tubulech. Jedná se o reverzibilní jev bez reálného poklesu GFR. Při vyšetření GFR je v případě terapie těmito léky vhodné zvolit např. metodu využívající cystatin C.16 Skutečné AKI není typickým nežádoucím účinkem inhibitorů CDK, i když nedávno byla popsána série šesti pacientů s AKI doprovázeným PU, z nichž pět mělo v biopsii ATN a jeden aTIN.18 Naopak velice zajímavé jsou preklinické studie, které popisují možnost prevence nefrotoxicity cisplatiny pomocí podání inhibitorů CDK.19
Nefrotoxicita inhibitorů m‑TOR kinázy (sirolimus, temsirolimus, everolimus) je relativně málo popsána,20 nicméně v SPC everolimu je uvedena PU jako častý nežádoucí účinek, u everolimu a temsirolimu je zmíněno jako častý nežádoucí účinek i selhání ledvin.16 Nedávno byla publikována série čtyř případů ATN, které autoři připisují inhibitorům mTOR, většinou u pacientů předléčených další nefrotoxickou terapií. Aktivita mTOR je ve zdravých ledvinách minimální, nicméně především při reparaci renálního poškození dochází k jejímu vzestupu. Vlastní příčinou nefrotoxicity inhibitorů mTOR tedy může být zablokování reparačního procesu zprostředkovaného mTOR a progrese iniciálního poškození jinými nefrotoxiny do manifestního AKI.21
Anti‑CD20 terapie používaná v onkologii pro terapii chronické lymfocytární leukemie a non‑Hodgkinova lymfomu nepředstavuje riziko stran přímé nefrotoxicity, nicméně je spojena s rizikem rozvoje syndromu nádorového rozpadu. Prevencí je dostatečná hydratace a podávání inhibitorů xanthinoxidázy.16,22
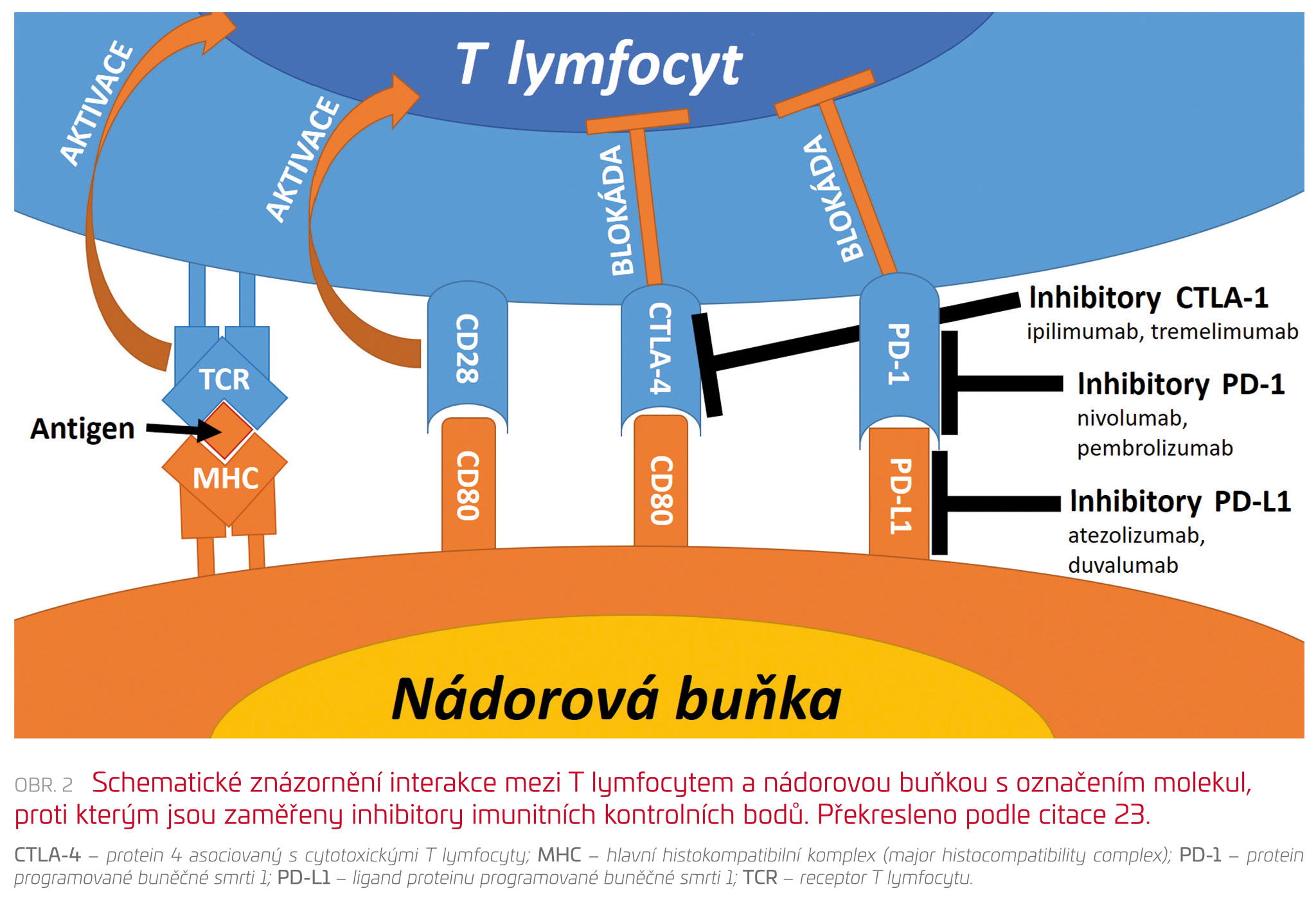
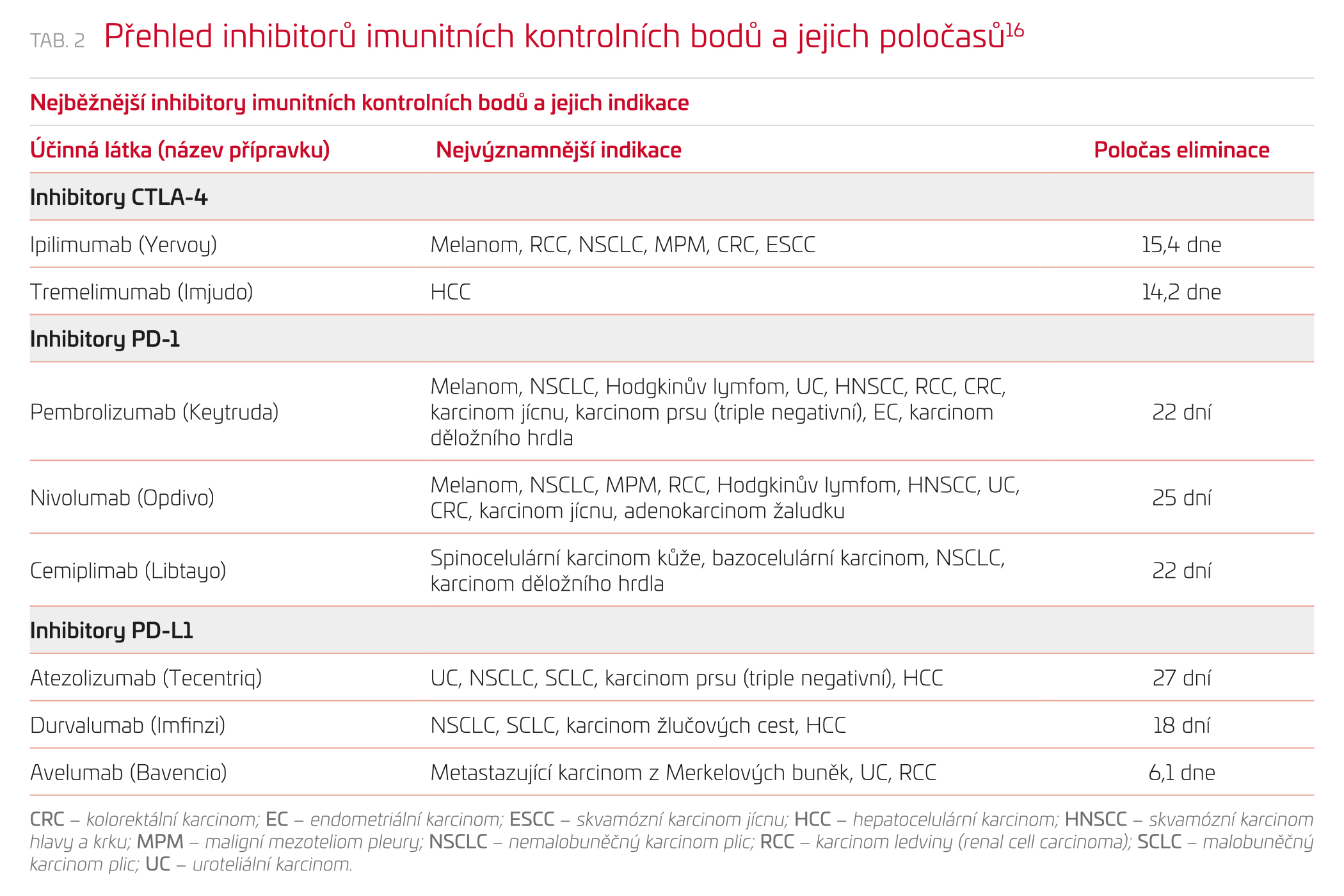
Inhibitory imunitních kontrolních bodů (immune checkpoint inhibitors, ICI) aktivují utlumenou imunitní odpověď proti nádorovým buňkám, a řadí se tak mezi nádorovou imunoterapii. Tělu vlastní a nádorové buňky se brání proti napadení T lymfocyty pomocí exprese CD80 a ligandu vázajícího se na protein programované buněčné smrti 1 (PD‑L1). Tyto molekuly jsou rozpoznány pomocí receptorů na T lymfocytech: proteinu 4 asociovaného s cytotoxickými T lymfocyty (CTLA‑4) a proteinu programované buněčné smrti 1 (PD1). Tím dochází k utlumení imunitní odpovědi a záchraně nádorové buňky. ICI tyto obranné interakce blokují a obnovují imunitní odpověď proti nádoru. Na základě molekulárního cíle potom dělíme ICI na inhibitory CTLA‑4 (ipilimumab, tremelimumab), inhibitory PD1 (nivolumab, pembrolizumab) a inhibitory PD‑L1 (atezolizumab, durvalumab)23,24 – viz tabulku 2 a obrázek 2.
Typickým nežádoucím účinkem ICI jsou autoimunitní reakce, které mohou postihnout celou řadu orgánů včetně ledvin. Americká společnost klinické onkologie uvádí AKI jako nežádoucí účinek vyskytující se u 1–2 % pacientů léčených monoterapií ICI a u 4,5 % pacientů užívajících kombinační terapii inhibitory CTLA‑4 a PD1.25 Může dojít k poškození nejčastěji v podobě aTIN, která vzniká většinou kolem 14. týdne léčby, nicméně může vzniknout i dříve, nebo naopak i několik týdnů po ukončení terapie. Vzácně může dojít při terapii ICI i k rozvoji glomerulonefritidy, včetně ANCA asociované vaskulitidy, nebo C3 glomerulopatie a ICI mohou aktivovat jakékoliv dosud subklinické autoimunitní procesy. V případě pacientů, u kterých se vyskytuje již preexistující neimunitně podmíněné CKD, je možno ICI podávat bez zvýšeného rizika, problematické je podávání těchto léků pacientům po transplantaci pro riziko rejekce štěpu (snad méně vyjádřené u inhibitorů CTLA‑4 než u inhibitorů PD1).25 Zajímavé je, že imunitně podmíněné nežádoucí účinky ICI byly asociovány s lepší účinností terapie, a daly by se tak považovat za známku dobré léčebné odpovědi.
Renální funkce mají být kontrolovány před každou dávkou ICI a v případě zvýšení koncentrace kreatininu by měla být terapie pozdržena do zjištění etiologie.25 Rovněž i zde je třeba si uvědomit, že u pacientů užívajících ICI se častěji setkáme s AKI jiné etiologie, a vždy by mělo být vyloučeno především prerenální selhání a posouzena další nefrotoxická medikace (cisplatina, kontrastní vyšetření, bylinné OTC přípravky,…). Při diferenciální diagnostice budeme spíše očekávat AKI indukované ICI u pacienta s postižením dalších orgánů (např. s ICI indukovanou tyreoiditidou, hepatitidou atd.),24,26 pro možnou etiologii ICI dále svědčí podávání léků, které rovněž mohou vyvolat alergické AKI, např. PPI (až 2,5× vyšší pravděpodobnost), NSA nebo antibiotik. Předpokládá se, že ICI aktivují do té doby utlumenou alergickou reakci na tyto léky. Při podezření na AKI vyvolané ICI je tedy vždy potřeba vysadit (pokud možno) i tyto další možné spouštěče. V každém případě, pokud jsou jiné příčiny AKI vyloučeny a došlo k rozvoji AKI druhého nebo vyššího stupně při terapii ICI, mělo by následovat přerušení terapie ICI a nasazení kortikoterapie. Zprvu se podává 0,5–1 mg/kg/den ekvivalentu prednisonu. V případě, že nedojde k úpravě do týdne, navyšuje se dávka na 1–2 mg/kg/den ekvivalentu prednisonu a od další terapie ICI se upouští. V případě, že do týdne dojde ke zlepšení, následuje detrakce kortikosteroidů. Úvahy o znovuzahájení léčby ICI by měly být provedeny při detrakci kortikosteroidů na dávku nižší než 10 mg/den ekvivalentu prednisonu. Při detrakci kortikosteroidů je vhodné rovněž zohlednit dlouhý poločas většiny ICI – obecně lze říci, že lék se v těle pacienta vyskytuje ještě čtyři poločasy po vysazení, což je v tomto případě i několik měsíců (viz tabulku 2). Při absenci odpovědi na kortikoterapii může být vhodné provedení biopsie.25 V případě, že nedojde k obnově renálních funkcí, je doporučeno zvážit další imunosupresivní terapii – cyklofosfamid, azathioprin, cyklosporin, mykofenolát nebo infliximab.26
Závěr
Nové skupiny léků v protinádorové terapii skýtají velké množství potenciálně nefrotoxických zástupců. Prevence nefrotoxicity by měla být založena především na identifikaci pacientů s rizikovými faktory. Dále je třeba přehodnotit současnou farmakoterapii a pokud možno vysadit potenciální nefrotoxiny (např. NSA, PPI), zabránit dehydrataci a kontrolovat krevní tlak a PU (především u pacientů s anti‑VEGF terapií), případně mineralogram (např. v případě terapie anti‑EGFR).6 Je třeba rovněž zohlednit fakt, že některé léky mohou způsobit reverzibilní vzestup hodnoty kreatininu blokádou jeho tubulární sekrece (inhibitory CDK, ALK). Zcela specifické nežádoucí účinky ve formě indukce autoimunitního procesu potom vyvolávají inhibitory imunitních kontrolních bodů, čemuž odpovídá léčba těchto nežádoucích účinků formou imunosupresivní terapie.
Literatura
- Lameire N. Nephrotoxicity of recent anti‑cancer agents. Clin Kidney J 2014;7:11–22.
- Izzedine H, Massard C, Spano JP, et al. VEGF signalling inhibition‑induced proteinuria: Mechanisms, significance and management. Eur J Cancer 2010;46:439–448.
- Perazella MA. Onco‑nephrology: renal toxicities of chemotherapeutic agents. Clin J Am Soc Nephrol 2012;7:1713–1721.
- Wanchoo R, Abudayyeh A, Doshi M, et al. Renal Toxicities of Novel Agents Used for Treatment of Multiple Myeloma. Clin J Am Soc Nephrol 2017;12:176–189.
- Hartinger JM. Farmakologické aspekty léčiv používaných pro cílenou léčbu. In: Tesař V (Ed.). Biologická a cílená léčba. Praha: Mladá fronta, 2019.
- Piscitani L, Sirolli V, Di Liberato L, et al. Nephrotoxicity Associated with Novel Anticancer Agents (Aflibercept, Dasatinib, Nivolumab): Case Series and Nephrological Considerations. Int J Mol Sci 2020;21:4878.
- Pilková A. Inhibitory protonové pumpy v praxi klinického farmaceuta. Čas Lék čes 2019;158:282–288.
- Meyer MM, Chen TP, Bennett WM. Chinese herb nephropathy. Proc (Bayl Univ Med Cent) 2000;13:334–337.
- Jhaveri KD, Wanchoo R, Sakhiya V, et al. Adverse Renal Effects of Novel Molecular Oncologic Targeted Therapies: A Narrative Review. Kidney Int Rep 2017;2:108–123.
- Perazella MA, Markowitz GS. Bisphosphonate nephrotoxicity. Kidney Int 2008;74:1385–1393.
- Izzedine H, Bahleda R, Khayat D, et al. Electrolyte disorders related to EGFR‑targeting drugs. Crit Rev Oncol Hematol 2010;73:213–219.
- Cellier M, Bourneau‑Martin D, Abbara C, et al. Renal Safety Profile of BCR‑ABL Tyrosine Kinase Inhibitors in a Real‑Life Setting: A Study Based on Vigibase®, the WHO Pharmacovigilance Database. Cancers (Basel) 2023;15:2041.
- Gafter‑Gvili A, Ram R, Gafter U, et al. Renal failure associated with tyrosine kinase inhibitors—Case report and review of the literature. Leuk Res 2010;34:123–127.
- Wanchoo R, Jhaveri KD, Deray G, Launay‑Vacher V. Renal effects of BRAF inhibitors: a systematic review by the Cancer and the Kidney International Network. Clin Kidney J 2016;9:245–251.
- Izzedine H, El‑Fekih RK, Perazella MA. The renal effects of ALK inhibitors. Invest New Drugs 2016;34:643–649.
- Platná SPC uváděných přípravků.
- Hartinger J, Vaněček V, Teřl M. Klinicko‑farmakologické aspekty biologické a cílené léčby. Revue Farmakoterapie 2019;6.
- 1 Gupta S, Caza T, Herrmann SM, et al. Clinicopathologic Features of Acute Kidney Injury Associated With CDK4/6 Inhibitors. Kidney Int Rep 2022;7:618–623.
- Pabla N, Gibson AA, Buege M, et al. Mitigation of acute kidney injury by cell‑cycle inhibitors that suppress both CDK4/6 and OCT2 functions. Proc Natl Acad Sci U S A 2015;112:5231–5236.
- Mielczarek Ł, Brodziak A, Sobczuk P, et al. Renal toxicity of targeted therapies for renal cell carcinoma in patients with normal and impaired kidney function. Cancer Chemother Pharmacol 2021;87:723–742.
- Izzedine H, Escudier B, Rouvier P, et al. Acute tubular necrosis associated with mTOR inhibitor therapy: a real entity biopsy‑proven. Ann Oncol 2013;24:2421–2425.
- Yang H, Rosove MH, Figlin RA. Tumor lysis syndrome occurring after the administration of rituximab in lymphoproliferative disorders: high‑grade non‑Hodgkin’s lymphoma and chronic lymphocytic leukemia. Am J Hematol 1999;62:247–250.
- de Mello RA, Veloso AF, Esrom Catarina P, et al. Potential role of immunotherapy in advanced non‑small‑cell lung cancer. Onco Targets Ther 2017;10:21–30.
- Sise ME, Seethapathy H, Reynolds KL. Diagnosis and Management of Immune Checkpoint Inhibitor‑Associated Renal Toxicity: Illustrative Case and Review. Oncologist 2019;24:735–742.
- Schneider BJ, Naidoo J, Santomasso BD, et al. Management of Immune‑Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol 2021;39:4073–4126.
- Seethapathy H, Herrmann SM, Sise ME. Immune Checkpoint Inhibitors and Kidney Toxicity: Advances in Diagnosis and Management. Kidney Med 2021;3:1074–10.
- Kategorie: Názor hosta
- Klíčová slova: blokátory epidermálního růstového faktoru; inhibitory angiogeneze; inhibitory cyklin dependentních kináz; inhibitory imunitních kontrolních bodů; monoklonální protilátky; nefrotoxicita; tyrozinkinázové inhibitory