Glifloziny – jaké zaujímají postavení v roce 2020?
Souhrn
Glifloziny (inhibitory sodíko‑glukózového kotransportéru 2, SGLT2) patří mezi skupinu novějších perorálních antidiabetik, která představují zásadní průlom v rozšíření léčebných možností u diabetického onemocnění ledvin (diabetic kidney disease, DKD). V České republice jsou v současné době k dispozici tři zástupci gliflozinů – empagliflozin (Jardiance®), kanagliflozin (Invokana®) a dapagliflozin (Forxiga®). Výsledky původně primárně kardiovaskulárně zaměřených studií jednoznačně poukazují na společný (class) efekt gliflozinů na riziko srdečního selhání a selhání ledvin. Prokázané neglykemické efekty gliflozinů u pacientů bez diabetes mellitus stavějí inhibitory SGLT2 do konkurence s pozicí metforminu jako první linií antidiabetické léčby.
Mechanismus účinku gliflozinů
Základním principem účinku gliflozinů (inhibitorů SGLT2) je ovlivnění transportu glukózy prostřednictvím sodíko‑glukózového kotransportéru (SGLT2) lokalizovaného v segmentu S1 proximálního tubulu ledvin. U pacientů s diabetes mellitus (DM) 2. typu je přítomna zvýšená exprese tohoto vysokokapacitního a nízkoafinitního transportéru, který navozuje zvýšenou reabsorpci glukózy a glomerulárního filtrátu v ledvinách s následným sníženým vylučováním glukózy do moče a negativním ovlivněním přítomného hyperglykemického stavu. Působením inhibitorů SGLT2 dochází k inhibici reabsorpce glukózy v proximálním tubulu s navozením glykosurie, doprovázené současně natriurézou a osmotickou diurézou. Efekt je nezávislý na účinku inzulinu a není spojen se zvýšeným rizikem hypoglykemie. V klinických studiích byl při jejich podávání pozorován pokles hodnoty glykovaného hemoglobinu (HbA1c) v rozsahu 7–10 mmol/l oproti placebu nezávisle na přidružené antidiabetické léčbě. Účinnost gliflozinů na snížení glykemie je proporcionální k úrovni glomerulární filtrace, s klesajícím farmakodynamickým účinkem u pacientů se středním stupněm renální dysfunkce (odhadovaná glomerulární filtrace [eGFR] ≥ 30 < 60 ml/min/1,73 m2) a se ztrátou účinku při eGFR < 30 ml/min/1,73 m2. Z těchto důvodů nejsou inhibitory SGLT2 schváleny pro léčbu pacientů s eGFR < 45 ml/min/1,73 m2.1
Naproti tomu efekty gliflozinů vázané na natriurézu jsou zachovány ve všech stadiích renální insuficience. Zahrnují účinky na tradiční rizikové faktory kardiovaskulárních onemocnění – tj. na pokles krevního tlaku, tělesné hmotnosti a urikemie. U diabetiků 2. typu je jejich podávání spojováno s poklesem systolického krevního tlaku o 3–5 mm Hg a diastolického tlaku o 1–2 mm Hg, bez ovlivnění již užívanou přidruženou antihypertenzní medikací. Účinek na redukci tělesné hmotnosti začíná po třech dnech od zahájení léčby pravděpodobně v důsledku zvýšení diurézy a mírné redukce plazmatického objemu. Tato akutní natriuréza se vytrácí po třech až čtyřech dnech, nicméně tělesná hmotnost klesá kontinuálně z důvodu úbytku tukové tkáně. Po šesti měsících užívání je léčba ve většině studií spojena s průměrným poklesem tělesné hmotnosti o dva až tři kilogramy.2
Kardioprotektivní účinky gliflozinů
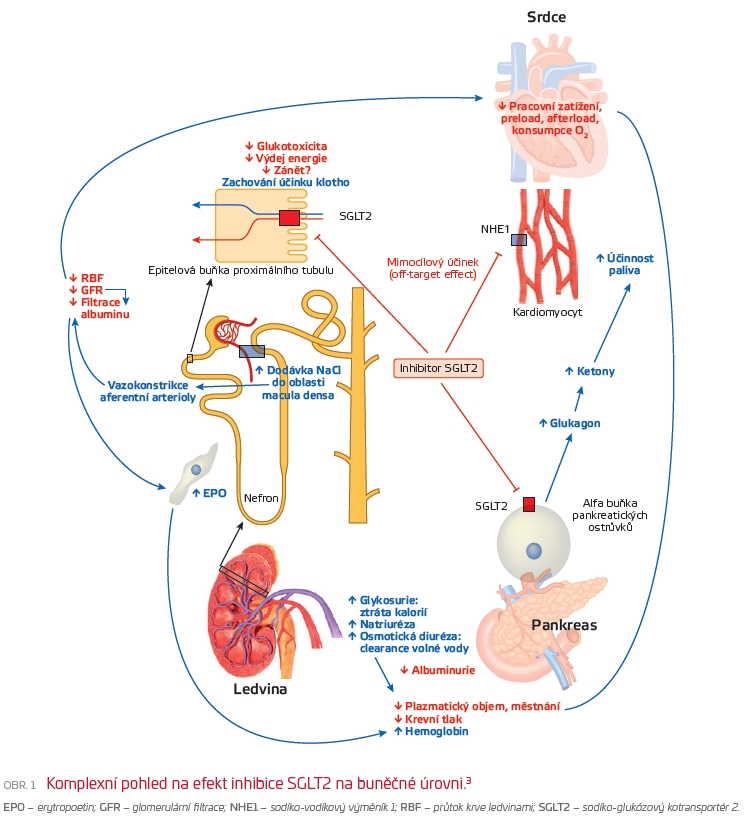
Protektivní účinky na kardiovaskulární (KV) systém jsou přisuzovány ovlivnění tří cílových orgánů, tj. ledvin, pankreatu a vlastních kardiomyocytů (obr. 1).
Pozitivní ovlivnění KV systému může být vysvětleno několika účinky inhibitorů SGLT2 v ledvinách zahrnujícími snížení glomerulární hyperfiltrace, modulaci renin‑angiotenzin‑aldosteronového systému (RAAS) a zvýšení hodnoty erytropoetinu. U diabetiků s glomerulární hyperfiltrací je přítomen zvýšený průtok krve ledvinami (renal blood flow, RBF), který může být až o 60 % vyšší než u normálních jedinců. Za normálních okolností RBF představuje 25 % srdečního výdeje, a tak pokles RBF působením gliflozinů může vést k promptnímu a příznivému vlivu na přetížení myokardu. Například snížení RBF o 30 % u hyperfiltrujících diabetiků 1. typu odpovídá pokles srdečního výdeje o zhruba 8 %. Redukce RBF může být jedním z faktorů vedoucích ke zvýšení hodnoty erytropoetinu. K tomuto efektu nepochybně přispívá současný účinek v ledvinách s navozením zvýšené koncentrace hemoglobinu a hematokritu z důvodu sníženého plazmatického objemu, s žádoucím zlepšením oxygenace tkání a srdečního návratu (preloadu). Popsaný účinek může být jedním z vysvětlení pro nepřítomnost aktivace sympatického nervového systému, jež je doložena stabilní tepovou frekvencí.
Hodnocení účinku inhibitorů SGLT2 na osu RAAS je modifikováno faktem, že většina pacientů užívá některý z blokátorů RAAS (inhibitor angiotenzin konvertujícího enzymu [ACEI] nebo blokátor receptoru AT1 pro angiotenzin II). Z důvodu zvýšené nabídky sodíku v oblasti macula densa je rovněž diskutována možnost suprese sekrece reninu.
Z dalších popisovaných účinků inhibitorů SGLT2 je známé ovlivnění sekrece glukagonu v alfa buňkách pankreatu. Vliv glukagonu na srdeční funkci je široce diskutován, s pravděpodobným přispěním glukagonu ke zvýšení tvorby ketolátek v játrech s následným zvýšením koncentrace cirkulujících ketolátek a s možným potenciálním rizikem vzniku euglykemické ketoacidózy. Ketolátky představují efektivnější zdroj adenosintrifosfátu (ATP), a tedy substrát energie pro myokard, ve srovnání s oxidací mastných kyselin.
Kromě výše popsaných účinků je dále prostudován přímý vliv inhibitorů SGLT2 na kardiomyocyty, a to vedlejší cestou ovlivněním sodíko‑vodíkového výměníku 1 (NHE1), snižujícího množství sodíku v cytosolu, a současným ovlivněním transportu intracelulárního vápníku do mitochondrií.3
Vliv na celkovou kardiovaskulární morbiditu a mortalitu z KV příčin byl již bohatě dokumentován napříč studiemi s jednotlivými zástupci gliflozinů (EMPA‑REG OUTCOME – empagliflozin, CANVAS – kanagliflozin, DECLARE‑TIMI 58 – dapagliflozin). Na základě dat z provedených metaanalýz k hodnocení primární a sekundární prevence vzniku KV a renálních příhod byl prokázán statisticky významně nižší počet hospitalizací pro srdeční selhání (o 31 %) a omezení progrese renálního postižení (o 45 %). Účinek gliflozinů se dále signifikantně projevil ve sdruženém ukazateli manifestace aterosklerózy (infarkt myokardu, cévní mozková příhoda, úmrtí z kardiovaskulárních příčin), a to snížením o 11 %.4
Nefroprotektivní účinky gliflozinů
Hlavní renoprotektivní účinek gliflozinů je založen na obnovení tubuloglomerulárního feedbacku – autoregulační zpětné vazby, při které je za fyziologických podmínek glomerulární filtrace (GFR) navzdory malým výkyvům krevního tlaku a plazmatického objemu udržována na relativně konstantní úrovni. Působením inhibitorů SGLT2 dochází ke zvýšení dostupnosti sodíku v distálním tubulu, oblast macula densa vnímá pak tuto zvýšenou nabídku a obnovuje tubuloglomerulární zpětnou vazbu navozením vazokonstrikce aferentní arterioly. Tímto mechanismem dochází k žádanému poklesu intraglomerulárního tlaku a glomerulární hypertenze. Během prvních dvou až tří týdnů je dokumentováno snížení eGFR průměrně o 6–7 ml/min/1,73 m2. Tento iniciální funkční pokles eGFR je hemodynamickým fenoménem, jenž připomíná účinek blokátorů RAAS a je asociován s dlouhotrvající nefroprotekcí a je reverzibilní po přerušení podávání gliflozinů.5
Z důvodu běžného užívání standardních dávek blokátoru RAAS je dalším vysvětlením protektivního účinku inhibitorů SGLT2 přesun k aktivaci neklasické osy RAAS. Neklasická osa RAAS oponuje aktivitě angiotenzinu II – AT1 receptorové ose, je vázána na vazbu ACE2 (angiotenzin konvertujícího enzymu 2) k produkci angiotenzinu‑(1–7), s následnou aktivací receptoru Mas, jež vede k systémové arteriolární vazodilataci, natriuréze, diuréze, snížení oxidačního stresu a antiproliferativní aktivity prostřednictvím oxidu dusnatého a upregulace prostaglandinů.6,7 Ovlivněním stejného receptoru může angiotenzin‑(1–7) redukovat aktivitu signalizačních cest, jež zodpovídají za fibrogenezi a chronický zánět.8
Jiná hypotéza, kterou by se daly objasnit renální výsledné ukazatele, se spojuje s optimalizací kyslíkové spotřeby ledvinami, podobně jako u kardiomyocytů, změnou energetického substrátu z volných mastných kyselin na ketolátky.9 Následkem účinku inhibitorů SGLT2 dochází k vzestupu reabsorpce sodíku prostřednictvím receptorů SGLT1 v segmentu S3 proximálního tubulu a zvýšením spotřeby kyslíku ve dřeni ledvin až o 26 %. Zvýšení spotřeby kyslíku v kortikomedulárním spojení může následně vést ke snížení tenze kyslíku v kůře ledvin a být tak stimulem pro produkci erytropoetinu.10
Další předpokládaná teorie k vysvětlení příznivých účinků v ledvinách je založena na interakci inhibitorů SGLT2 se sodíko‑vodíkovým (NHE) výměníkem. Izoformy NHE1 a NHE3 jsou přítomny v ledvinách, konkrétně v intercalary buňkách sběrného kanálku a v epiteliálních buňkách proximálního tubulu. Jejich exprese je zvýšena při hyperglykemii a hyperinzulinemii, obě izoformy přispívají k typickým známkám DKD, jako je hyperfiltrace, akcelerovaná reabsorpce sodíku a proliferace mezangiálních buněk. Jejich vystupňovaná aktivita je navíc vázána na vaskulární poškození asociované s hyperglykemií. Aktivita transportérů NHE v ledvinách je navíc akcentována u pacientů se srdečním selháním, pravděpodobně přispívajícím k rezistenci na diuretika. Inhibitory SGLT2 společně s inhibitory RAAS mohou snižovat expresi NHE a aktivitu v ledvinách, jež přispívají ke snížení hyperfiltrace a zabraňují účinkům vázaným na fibrózu a proliferaci.11
Klíčovou průlomovou studii k potvrzení renoprotektivních účinků gliflozinů, konkrétně kanagliflozinu, představuje CREDENCE (The Canagliflozin and Renal Endpoints in Diabetes with Established Nephropathy Clinical Evaluation), jež měla primární renální cílový ukazatel (zdvojnásobení koncentrace kreatininu, riziko terminálního selhání ledvin, úmrtí z renálních nebo kardiovaskulárních příčin). Do studie byli zařazeni pacienti s vysokým renálním rizikem (téměř 60 % účastníků studie mělo eGFR < 60 ml/min/1,73 m2, poměr albumin/kreatinin v moči [UACR] > 300 mg/g). U pacientů léčených kanagliflozinem se prokázalo snížení rizika kombinovaného renálního ukazatele o 30 %.
Bezpečnostní profil gliflozinů
Léčba inhibitory SGLT2 je asociována se zvýšenou frekvencí močení, s rizikem navození volumové deplece, dále pak s vyšším výskytem mykotických genitálních infekcí (balanitida, vulvovaginitida) a jen ve výjimečných případech s infekcí močových cest. Tyto nežádoucí účinky však obvykle nevyžadují přerušení léčby. Vzácně je častěji u diabetiků 1. typu, většinou léčených off‑label glifloziny, popisován výskyt euglykemické diabetické ketoacidózy. K mechanismu rozvoje diabetické ketoacidózy patří interkurentní onemocnění, operační stres či nadměrná konzumace alkoholu s doprovodným omezením konzumace stravy či dávek inzulinu.12
Současná doporučení pro praxi
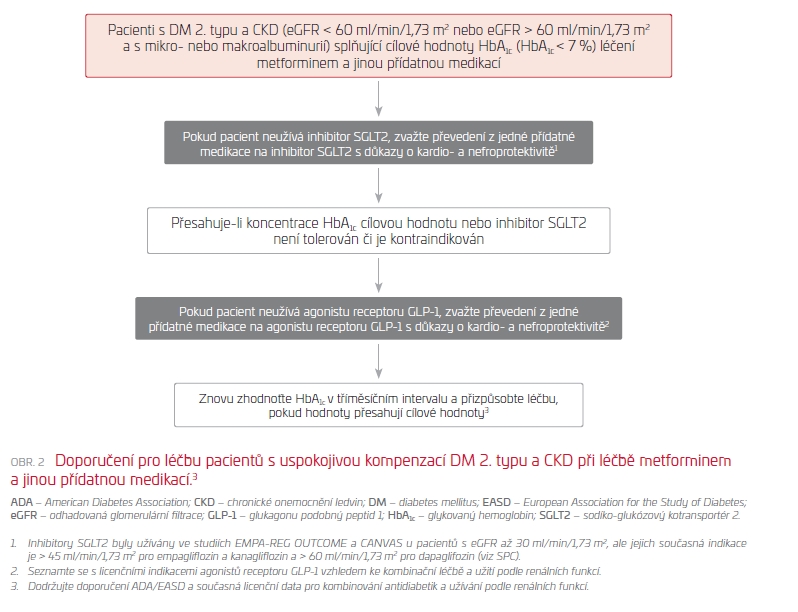
Na základě aktuálních guidelines Americké diabetické společnosti (ADA) a Evropské společnosti pro studium diabetu (EASD) je hlavním doporučením zahájení terapie bez ohledu na hodnotu glykovaného hemoglobinu, neboť neglykemické pozitivní účinky nejsou závislé na míře hyperglykemie a hodnotě HbA1c. Podle posledních doporučení by se také indikace léčby inhibitory SGLT2 měla řídit individuálně podle cílové orgánové protekce a komorbidit pacienta (tab. 1). Většina guidelines doporučuje terapii inhibitory SGLT2 nebo agonisty receptoru pro glukagonu podobný peptid 1 (glukagon‑like peptide 1, GLP‑1) jako druhou linii léčby po nasazení metforminu u DM 2. typu a po prodělané aterosklerotické KV příhodě, tj. v sekundární prevenci. Nově se však doporučuje zahájení terapie inhibitory SGLT2 u pacientů s DM 2. typu trpících srdečním selháním nebo chronickým onemocněním ledvin (CKD), nezávisle na anamnéze aterosklerotického KV onemocnění (obr. 2, 3). Další významnou změnou je posun indikací kardioprotektivní medikace do méně rizikových skupin pacientů s diabetem 2. typu, tj. do oblasti primární prevence u pacientů s větším množstvím rizikových faktorů. Rozhodnutí o zahájení terapie by mělo být konsenzuální v rámci multioborové spolupráce.13,14
Literatura
- Kalra S, Singh V, Nagrale D. Sodium–Glucose Contransporter‑2 Inhibition and the Glomerulus. A review. Adv Ther 2016;33:1502–1518.
- Cherney DZ, Kanbay M, Lovshin JA. Renal physiology of glucose handling and therapeutic implications. Nephrol Dial Transplant 2020;35:i3–i12.
- Sarafidis P, Ferro CJ, Morales E, et al. SGLT‑2 inhibitors and GLP‑1 receptor agonists for nephroprotection and cardioprotection in patients with diabetes mellitus and chronic kidney disease. A consensus statement by the EURECA‑m and the DIABESITY working groups of the ERA‑EDTA. Nephrol Dial Transplant 2019;34:208–230.
- Zelniker TA, Wiviot SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta‑analysis of cardiovascular outcome trials. Lancet 2019;393:31–39.
- Rocha NA, Neeland IJ, McCollough PA, et al. Effects of sodium glucose co‑transporter 2 inhibitors on the kidney. Diab Vasc Dis Res 2018; 15: 375–386.
- Chappell MC. Nonclassical renin–angiotensin system and renal function. Compr Physiol 2012;2:2733–2752.
- Mizuiri S, Ohaski Y. ACE and ACE2 in kidney disease. World J Nephrol 2015;4:74–82.
- Padda RS, Shi Y, Lo CS, et al. Angiotensin–(1–7): a novel peptide to treat hypertension and nephropathy in diabetes? J Diabetes Metab 2015;6:615.
- Mudaliar S, Alloju S, Henry RR. Can a shift in fuel energetics explain the beneficial cardiorenal outcomes in the EMPA‑REG OUTCOME study? A unifying hypothesis. Diabetes Care 2016;39:1115–1122.
- Layton AT, Vallon V, Edwards A. Modeling oxygen consumption in the proximal tubule: effects of NHE and SGLT2 inhibiton. Am J Renal Physiol 2015;308:F1343–F1357.
- Packer M. Activation and inhibition of sodium‑hydrogen exchanger in a mechanism that links the pathophysiology and treatment of diabetes mellitus with that of heart failure. Circulation 2017;136:1548–1559.
- Peters AL, Buschur EO, Buse JB, et al. Euglycemic diabetic ketoacidosis: a potential complication of treatment with sodium–glucose cotransporter 2 inhibition. Diabetes Care 2015;38:1687–1693.
- Neuen BL, Jardine MJ, Perkovic V. Sodium–glucose cotransporter 2 inhibition: which patient with chronic kidney should be treated in the future? Nephrol Dial Transplant 2020;35:i48–i55.
- Buse JB, Wexler DJ, Tsapas A, et al. 2019 update to: Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the Europe – an Association for the Study of Diabetes (EASD). Diabetologia 2020;63:221–228
- Kategorie: Přehledové články
- Klíčová slova: glifloziny; inhibitory SGLT2 ; kardioprotektivita; nefroprotektivita