Neobvyklé průběhy pulmorenálního syndromu
Pacient L. H.:
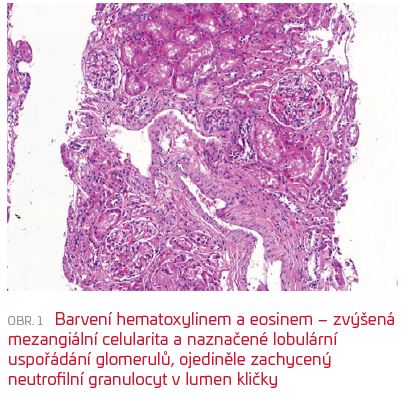
Osmnáctiletý, dosud nestonající muž byl v lednu 2019 vyšetřen u svého PLDD pro několik dní trvající bolest v bedrech, která se objevila po běžné sportovní zátěži. Po orientačním vyšetření moči byla indikována antibiotická léčba amoxicilin klavulanátem. S přetrvávajícím nálezem hematurie a proteinurie i s časovým odstupem byl pacient odeslán do nefrologické ambulance I. interní kliniky FN v Plzni. Zde jsme objektivizovali glomerulární selektivní proteinurii s poměrem celkové bílkoviny a kreatininu v moči (CB/krea) 240 mg/mmol a mikroskopickou hematurii. Funkce ledvin byla v normě (glomerulární filtrace [GFR] dle CKD‑EPI > 1,5 ml/s/1,73 m2). Hodnoty TK se pohybovaly v pásmu normotenze, přesto jsme s ohledem na proteinurii zahájili léčbu malou dávkou ramiprilu. Při vstupním vyšetření byla zachycena hraniční pozitivita anti‑GBM protilátek (protilátek proti bazální membráně glomerulů). Velmi slabá pozitivita anti‑GBM protilátek na hranici měřitelnosti byla potvrzena i z kontrolního odběru včetně vyšetření jinou metodou a na jiném pracovišti (enzymová imunoanalýza [ELISA], imunofluorescence [IF], FN v Motole). U pacienta jsme indikovali biopsii ledviny. V reprezentativním vzorku (zachyceno 24 glomerulů) byly ve světelné mikroskopii nalezeny pouze diskrétní patologické změny – zvýšená mezangiální celularita, ojediněle zachycený neutrofilní granulocyt v lumen kličky, naznačené lobulární uspořádání glomerulu (obr. 1). Nebyly patrné nekrózy kapilárních kliček či přítomné srpky. Imunofluorescenčně byla difuzně přítomna silná (3+) lineární pozitivita glomerulární bazální membrány v IgG (obr. 2). 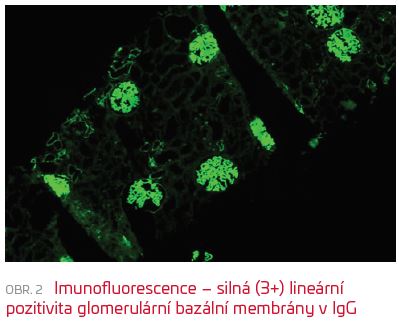 Zejména imunofluorescenční nález společně s nálezem v moči a hraniční pozitivitou anti‑GBM protilátek svědčil pro anti‑GBM glomerulopatii, zachycenou velmi pravděpodobně v časné fázi onemocnění. Nemocný byl bez jakékoli respirační symptomatologie, bez hemoptýzy, bez dušnosti, doplněné nativní CT vyšetření neprokázalo jakékoliv morfologické plicní postižení. Po kryoprezervaci spermatu jsme zahájili kombinovanou imunosupresivní terapii celkem šesti pulsy cyklofosfamidu (1 200 mg à dva a následně à tři týdny) a kortikosteroidy (čtyřikrát pulsy methylprednisolonu 500 mg à 24 hodin, dále 1 mg/kg prednisonu). Vzhledem k minimálnímu titru protilátek a absenci jednoznačných dokladů o pozitivním efektu této metody jsme do léčebného schématu nezařadili plazmaferézu. Začátek léčby byl komplikován rozvojem steroidního diabetu vyžadujícího přechodně léčbu metforminem, při snižující se dávce kortikosteroidu došlo postupně k normalizaci glykemií i glykovaného hemoglobinu. Do šesti měsíců od zahájení léčby byl kortikosteroid postupně zcela vysazen. První kontrolní hodnota anti‑GBM protilátek po dvou měsících léčby byla negativní, stejně tak všechny následující kontroly. Postupně ustupovala proteinurie, od čtvrtého měsíce léčby s CB/krea pod hodnotou 100 mg/mmol, ve 12. měsíci byla proteinurie prakticky v normě (CB/krea 15,4 mg/mmol). Nyní je pacient šest měsíců po ukončení imunosupresivní léčby v dobrém klinickém stavu a beze známek recidivy onemocnění. Trvá zcela normální funkce ledvin a perzistuje pouze malá mikroskopická hematurie. V medikaci je trvale zaveden blokátor receptoru AT1.
Zejména imunofluorescenční nález společně s nálezem v moči a hraniční pozitivitou anti‑GBM protilátek svědčil pro anti‑GBM glomerulopatii, zachycenou velmi pravděpodobně v časné fázi onemocnění. Nemocný byl bez jakékoli respirační symptomatologie, bez hemoptýzy, bez dušnosti, doplněné nativní CT vyšetření neprokázalo jakékoliv morfologické plicní postižení. Po kryoprezervaci spermatu jsme zahájili kombinovanou imunosupresivní terapii celkem šesti pulsy cyklofosfamidu (1 200 mg à dva a následně à tři týdny) a kortikosteroidy (čtyřikrát pulsy methylprednisolonu 500 mg à 24 hodin, dále 1 mg/kg prednisonu). Vzhledem k minimálnímu titru protilátek a absenci jednoznačných dokladů o pozitivním efektu této metody jsme do léčebného schématu nezařadili plazmaferézu. Začátek léčby byl komplikován rozvojem steroidního diabetu vyžadujícího přechodně léčbu metforminem, při snižující se dávce kortikosteroidu došlo postupně k normalizaci glykemií i glykovaného hemoglobinu. Do šesti měsíců od zahájení léčby byl kortikosteroid postupně zcela vysazen. První kontrolní hodnota anti‑GBM protilátek po dvou měsících léčby byla negativní, stejně tak všechny následující kontroly. Postupně ustupovala proteinurie, od čtvrtého měsíce léčby s CB/krea pod hodnotou 100 mg/mmol, ve 12. měsíci byla proteinurie prakticky v normě (CB/krea 15,4 mg/mmol). Nyní je pacient šest měsíců po ukončení imunosupresivní léčby v dobrém klinickém stavu a beze známek recidivy onemocnění. Trvá zcela normální funkce ledvin a perzistuje pouze malá mikroskopická hematurie. V medikaci je trvale zaveden blokátor receptoru AT1.
 Pacient I. S.:
Pacient I. S.:
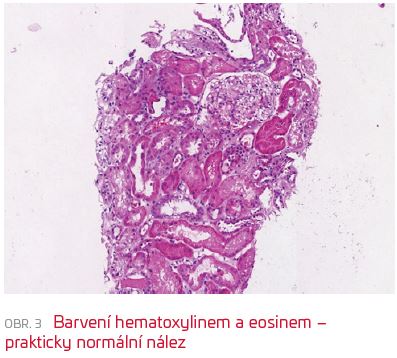
Dvaadvacetiletý muž cizí národnosti (Moldávie), kuřák bez známých komorbidit či anamnestických událostí předcházejících hospitalizaci, byl přivezen do Nemocnice Cheb po kolapsovém stavu s febriliemi a hemoptýzou. V úvodu dominovala pacientovu stavu těžká respirační insuficience, pro kterou musel být intubován, laboratorně byla přítomna hluboká mikrocytární hypochromní anémie (Hb 38 g/l). Pro závažnost stavu byl nemocný po krátkém pobytu v chebské nemocnici přeložen na jednotku intenzivní péče I. interní kliniky FN Plzeň. V době přijetí měl pacient normální renální funkci (GFR dle CKD‑EPI 2,07 ml/s/1,73 m2), v močovém sedimentu malou mikroskopickou hematurii a relativně nízké parametry zánětu (C‑reaktivní protein [CRP] 35 mg/l, PCT 0,19 µg/l). CT obraz byl popsán jako těžký syndrom akutní dechové tísně (ARDS) s difuzní alveolární hemoragií a masivním krvácením do dýchacích cest. Kultivační, sérologická i molekulárně genetická vyšetření zaměřená na infekční etiologii byla negativní, stejně tak panel autoimunit (včetně anti‑GBM protilátek). Vzhledem k trvající hemoptýze a těžké poruše oxygenační funkce plic s podezřením na autoimunitní etiologii jsme empiricky zahájili pulsní léčbu kortikosteroidy (1 g methylprednisolonu à 24 hodin po dobu tří dnů parenterálně, dále v dávce 1 mg/1 kg hmotnosti a den) s velmi dobrým efektem na klinický stav pacienta a se zlepšením ventilačních parametrů. Po 11 dnech byla možná extubace. Již od sedmého dne hospitalizace ale docházelo k rozvoji neoligurického renálního selhání. S ohledem na výše uvedené okolnosti a suspekci na možný pulmorenální syndrom byla indikována renální biopsie (devátý den hospitalizace). V bioptickém vzorku byl překvapivě nález téměř normální morfologie ve světelné mikroskopii. Všechny glomeruly byly vitální, s jemnou stavbou kapilárních kliček a přiměřenou buněčností. U žádného z glomerulů nebyla prokázána přítomnost nekróz kapilárních kliček, srpků či rozštěpů GBM, nebyla nalezena ani větší patologie v intersticiu (obr. 3). Imunofluorescenčně byla zjištěna silná (3+) lineární pozitivita glomerulární bazální membrány v IgG a lehkých řetězcích kappa i lambda (obr. 4). Tento nález neumožňoval stanovit jasnou histopatologickou diagnózu ani při komparaci s klinickým a laboratorním nálezem. Výsledky IF vyšetření byly nakonec hodnoceny jako pravděpodobně falešně pozitivní. 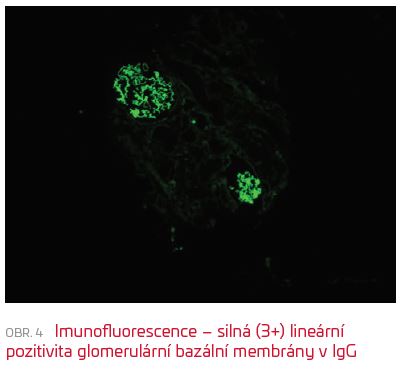 V dalším průběhu se stav zkomplikoval při nozokomiálním respiračním infektu další epizodou alveolární hemoragie s nutností reintubace. Akutní poškození funkce ledvin si vynutilo zahájení náhrady funkce nejprve kontinuální, následně intermitentní metodou. Při tomto postupu a změně antibiotik se v dalších dnech upravily plicní funkce, došlo k regresi hemoptýzy a nemocného bylo možné opět extubovat a postupně i ukončit náhradu funkce ledvin (po celkem 16 dnech – čtyři dny kontinuální venovenózní hemodialýza [CVVHD], pětkrát intermitentní hemodialýza [IHD]). Po stabilizaci stavu byl nemocný k další léčbě repatriován do země svého původu a i s ohledem na tyto okolnosti a obnovu jak renálních funkcí, tak plicního nálezu bylo pokračováno pouze v monoterapii kortikosteroidy. O dalším průběhu léčby nemáme bohužel podrobnější informace, nicméně nemocný je zřejmě bez potřeby specifické léčby, v dobrém klinickém stavu a bez větší alterace renálních funkcí či omezení v běžném aktivním denním životě.
V dalším průběhu se stav zkomplikoval při nozokomiálním respiračním infektu další epizodou alveolární hemoragie s nutností reintubace. Akutní poškození funkce ledvin si vynutilo zahájení náhrady funkce nejprve kontinuální, následně intermitentní metodou. Při tomto postupu a změně antibiotik se v dalších dnech upravily plicní funkce, došlo k regresi hemoptýzy a nemocného bylo možné opět extubovat a postupně i ukončit náhradu funkce ledvin (po celkem 16 dnech – čtyři dny kontinuální venovenózní hemodialýza [CVVHD], pětkrát intermitentní hemodialýza [IHD]). Po stabilizaci stavu byl nemocný k další léčbě repatriován do země svého původu a i s ohledem na tyto okolnosti a obnovu jak renálních funkcí, tak plicního nálezu bylo pokračováno pouze v monoterapii kortikosteroidy. O dalším průběhu léčby nemáme bohužel podrobnější informace, nicméně nemocný je zřejmě bez potřeby specifické léčby, v dobrém klinickém stavu a bez větší alterace renálních funkcí či omezení v běžném aktivním denním životě.
Komentář
- MUDr. Pavlína Richtrová, Ph.D., I. interní klinika LF UK Praha a FN Plzeň
Literatura
- Pusey CD. Anti‑glomerular basement membrane disease. Kidney Int 2003;64:1535–1550.
- Johnson JP, Moore J Jr, Austin HA III, et al. Therapy of anti‑glomerular basement membrane antibody disease: analysis of prognostic significance of clinical, pathologic and treatment factors. Medicine 1985;64:219–227.
- Waikar SS, McMahon GM. Expanding the role for kidney biopsies in acute kidney injury. Semin Nephrol 2018;38:12–20.
- Kategorie: Kazuistiky
- Klíčová slova: akutní poškození ledvin; anti GBM ; pulmorenální syndrom
Goodpastureova choroba je autoimunitní onemocnění charakterizované přítomností protilátek proti komponentám bazální membrány glomerulů a plicních alveolů a řadí se do skupiny vaskulitid malých cév. Autoprotilátky jsou namířeny proti nekolagenní doméně (NC1) řetězce alfa3‑kolagenu IV (složka cévních bazálních membrán). Klinicky nejčastěji dominuje obraz rychle progredující glomerulonefritidy, postižení plic má charakter plicních hemoragií. Oba tyto klinické projevy se vyskytují současně (60–80 %) nebo může být přítomno pouze izolované postižení renální – anti‑GBM glomerulonefritida (20–40 %), vzácně izolované postižení plicní (do 10 %). Širší název Goodpastureův syndrom označuje obecně pulmorenální postižení se selháním ledvin a krvácením do plic. Morfologicky jde o nekrotizující glomerulonefritidu s tvorbou srpků, v imunofluorescenčním vyšetření je typická lineární difuzní globální pozitivita imunoglobulinu G (IgG).
Jedná se o vzácné onemocnění s incidencí kolem jednoho až dvou případů na milion/rok. Typická je distribuce do dvou věkových skupin – první je třetí dekáda s predominancí mužů, druhá je šestá dekáda života a zde převažuje postižení žen. U mladých mužů je častější pulmorenální projev, u starších žen je častější izolované postižení ledvin. Uvádí se, že až 15 % bioptických nálezů krescentní glomerulonefritidy je spojeno s anti‑GBM protilátkami.1,2
Jak již bylo zmíněno, nejobvyklejším obrazem onemocnění je přítomnost progredujícího selhání ledvin, případně s krvácením do plic, průkaz cirkulujících anti‑GBM protilátek a bioptický nález nekrotizující glomerulonefritidy se srpky a lineární pozitivita IgG v imunofluorescenci. Ani jedna z našich popsaných kazuistik ale tyto běžné charakteristiky nenaplňuje. Hlavně proto jsme se rozhodli je zde prezentovat.
V prvním případě jsme zachytili Goodpastureovu chorobu ve velice časné fázi. Ukázalo se, že důslednost PLDD, který včas odeslal mladého nemocného k odbornému vyšetření, byla důležitým předpokladem následné úspěšné léčby. Také standardní odběr základních autoprotilátek při primovyšetření v nefrologické ambulanci (přestože klinický obraz v tom okamžiku podezření právě na tuto diagnózu rozhodně nevyvolával) hrál rovněž důležitou roli. Po zjištění byť hraniční pozitivity anti‑GBM protilátek byl již sled biopsie, interpretace nálezu a rozhodnutí o indikaci k léčbě rychlý. Přes poměrně diskrétní změny ve světelné mikroskopii dovolovala zejména imunofluorescence v kontextu s laboratorním a klinickým nálezem stanovení diagnózy. Rozhodli jsme se indikovat kombinovanou imunosupresivní léčbu kortikosteroidy a cyklofosfamidem, ale bez provádění plazmaferéz. Efekt léčby byl dostatečný a kontrolní anti‑GBM protilátky byly po několika týdnech negativní. Renální funkce byly po celou dobu léčby v normě, postupně klesala proteinurie a zatím nadále přetrvává mikroskopická hematurie (aktuálně po dobu 14 měsíců od diagnózy a 7 měsíců od ukončení léčby). Lze předpokládat, že bez včasné léčby by se mladý muž dostal do naší péče s delším časovým odstupem od prvních patologických nálezů v moči, ovšem pravděpodobně pod obrazem rychle progredující glomerulonefritidy, v horším případě i s pulmorenálním syndromem. V takovém případě by další prognóza, zejména renální, byla mnohem nepříznivější.
Naopak druhý případ je pro nás dodnes vlastně „nerozlousknutým oříškem“. Klinický obraz těžké plicní apoplexie u kuřáka s navazujícím selháním ledvin se přímo nabízí jako obraz Goodpastureova syndromu. Ani negativita anti‑GBM protilátek by této diagnóze nebránila. Existuje totiž skupina tzv. atypických anti‑GBM glomerulonefritid, u kterých nejsou anti‑GBM protilátky prokázány. Vysvětlení je většinou dvojí. Většina komerčních testů k průkazu anti‑GBM protilátek detekuje protilátky v třídě IgG1 a IgG3, méně IgG2 a IgG4. Druhá dvojice IgG protilátek méně aktivuje komplement. To vysvětluje často méně prudký klinický průběh i mírnější histologický nález (často s absencí srpků) a současně absenci průkazu protilátek jako takových. Komerční kity navíc detekují protilátky specifické proti nejběžněji postiženému epitopu, jejich nepřítomnost však nevylučuje možnost, že konkrétní pacient má protilátky namířené proti epitopu jinému. Druhým vysvětlením možné negativity protilátek je to, že volně cirkulující anti‑GBM protilátky mají kratší biologický poločas ve srovnání s protilátkami již navázanými na bazální membránu. To je argument pro možnou absenci průkazu protilátek v krvi při jinak jasném bioptickém nálezu. Nicméně v našem případě nehraje ani tak zásadní roli samotná nepřítomnost anti‑GBM protilátek jako absence jakékoliv větší patologie v bioptickém nálezu. Přestože v okamžiku biopsie ledvin bylo již vyjádřené akutní poškození ledvin (AKI) (s‑urea 24,8 mmol/l, s‑kreatinin 177 µmol/l), byl obraz v optické mikroskopii prakticky normální a nijak neobjasňoval podstatu selhání ledvin. Pouhá přítomnost silné lineární pozitivity IgG v imunofluorescenčním vyšetření při absenci jakékoliv významnější patologie jak v oblasti glomerulů, tak v intersticiu nám žádné vodítko k diagnóze selhání ledvin nedala. Můžeme spekulovat o tom, že biopsie byla provedena velice záhy, totiž již třetí den stoupající koncentrace kreatininu v séru. Bylo to zejména s ohledem na zvažovanou Goodpastureovu chorobu, na kterou jsme pojali podezření na základě klinického obrazu a při absenci anti‑GBM protilátek jsme spoléhali právě na bioptický nález. Ani ten nám ale jistotu diagnózy nakonec bohužel nepřinesl. Mezitím se klinický stav při monoterapii kortikosteroidy uspokojivě lepšil, upravovaly se plicní i renální funkce, nemocný se zbavil závislosti na přístrojové náhradě a směřoval k repatriaci do nemocnice v Moldávii. Za těchto okolností jsme přístup k agresivnější léčbě ani rebiopsii ledviny neindikovali a nemocného jsme po 31 dnech hospitalizace přeložili. I zpětně viděno bylo v našem příběhu více nejasností a nezodpovězených otázek než jasných odpovědí. Možné příčiny absence anti‑GBM protilátek byly již zmíněny výše, ty naši teorii Goodpastureovy choroby příliš nepodlamovaly. Větší nejasností byla absence významnějších morfologických změn v bioptickém nálezu. Snad nám ale může nahrávat fakt, že povědomí o histopatologických změnách v prvních dnech AKI prakticky jakékoliv etiologie je minimální. Těžko pak odhadovat, jaký morfologický nález považovat za úměrný 3. dni akutního poškození ledvin.3 Ovšem zásadní okolnost, která nám naši teorii Goodpastureovy choroby nabourává nejvíce, je reakce na léčbu. Obnova nejen plicních, ale zejména renálních funkcí při pouhé monoterapii kortikosteroidem by byla natolik výjimečná, že až hraničí s nepravděpodobností a vyvolává pochybnost o správné diagnóze. Na druhou stranu měl nemocný prakticky normální bioptický nález a prognóza se běžně vztahuje k množství srpků, které nebyly vůbec zachyceny. Takže snad i toto by mohlo být částečným vysvětlením. Anebo se prostě musíme smířit s tím, že ne vždy a vše jsme v naší klinické praxi schopni objasnit a pojmenovat. Že určitá část diagnóz stále zůstává na úrovni teorií, dohadů a spekulací. Že někdy se musíme spokojit s faktem, že jsme empirickým postupem dosáhli dostatečného léčebného efektu, aniž bychom byli schopni nemocnému jeho nemoc konkrétně pojmenovat a vysvětlit její podstatu. Tak jako v tomto případě, kdy jsme schopni konstatovat pouze fakt, že se jednalo o pulmorenální syndrom. Další podrobnější informace o průběhu onemocnění pacienta v Moldávii bohužel nemáme. Podařilo se nám nemocného kontaktovat, cítí se zdráv, je bez větší limitace v běžném životě a zřejmě bez trvalé medikace či dispenzarizace, konkrétnější informace ale nemáme.