Kdy zahájit náhradu funkce ledvin u kriticky nemocných s AKI?
Ostermann M, Dickie H, Barrett NA. Renal replacement therapy in critically ill patients with acute kidney injury – when to start. Nephrol Dial Transplant 2012 (e‑pub ahead of print).
Obecným cílem náhrady funkce ledvin (RRT) je alespoň částečně kompenzovat ztrátu renálních funkcí a minimalizovat z ní plynoucí důsledky. Těmi jsou akumulace dusíkatých katabolitů, uremických toxinů, poruchy elektrolytů a acidobazické rovnováhy a tekutinové přetížení. Proto také většina učebních textů uvádí jako absolutní indikace k zahájení RRT některé krajní situace, jakými jsou hyperkalémie (≥ 6,5 mmol/l), pokročilá azotémie (urea ≥ 35 mmol/l), urémie (encefalopatie, perikarditida), těžká acidóza (pH < 7,1), plicní otok. Tyto indikace, zejména arbitrárně zvolené hodnoty některých laboratorních ukazatelů, však nejsou obecně aplikovatelné u kriticky nemocných pacientů. Bohužel existuje značná variabilita v názorech na optimální načasování zahájení RRT u této populace nemocných. Do rozhodování o zahájení RRT vstupuje mnoho faktorů – názor lékaře, okolnosti konkrétního pacienta a v neposlední řadě i organizačně‑logistické aspekty. Podstata diskuse nad optimálním načasováním RRT u kriticky nemocných spočívá v tom, zda se časnější napojení pacienta na RRT a z toho plynoucí rychlejší kontrola metabolické homeostázy, účinnější kontrola volémie a v teoretické rovině i kontrola zánětlivé odpovědi může promítnout do lepšího léčebného výsledku. Obhájci zdrženlivější taktiky v indikaci k RRT argumentují riziky, která jsou s metodami RRT spojena (kanylace, antikoagulace, ztráty stopových prvků, vitaminů, aminokyselin, ovlivnění hladin antibiotik, bioinkompatibilita, cena) a tím, že časným napojením můžeme léčit pacienty, u nichž by došlo ke spontánní reparaci renálních funkcí, a kteří by tudíž byli RRT zbytečně vystaveni. Klinické rozhodnutí týkající se indikace a načasování RRT se tak stává velmi komplexním dějem, který je umocněn absencí jednoznačných důkazů, dle nichž bychom mohli postupovat. To je také důvodem, proč se autoři komentovaného článku rozhodli analyzovat dostupné klinické studie, které otázku načasování RRT řešily. Jejich cílem bylo na základě provedené analýzy 1) identifikovat optimální indikátory k zahájení RRT u kriticky nemocných s AKI, 2) posoudit, zda sérové koncentrace kreatininu a urey jsou vhodnými parametry k rozhodnutí o zahájení RRT, 3) navrhnout algoritmus indikace k RRT.
Autoři vyhodnotili dvě prospektivní randomizované (RCT) studie, dvě prospektivní kohortové studie, 13 retrospektivních kohortových studií a tři metaanalýzy. Většina z těchto malých studií posuzovala načasování zahájení RRT dle hodnot urey, kreatininu a/nebo diurézy. Stanovené hraniční hodnoty se však mezi studiemi značně lišily. Dvě RCT provedené převážně s kardiochirurgickými pacienty přinesly protichůdné výsledky. Podobně konfliktní jsou i všechny retrospektivní studie, které hodnotily sérový kreatinin jako spouštěč pro zahájení RRT, ačkoli některé naznačují lepší mortalitu při časnějším zahájení. Sérové koncentrace kreatininu, které byly považovány za časnou indikaci k RRT, však byly velmi heterogenní (např. zvýšení o 150 % oproti výchozí, o 200 % oproti výchozí, < 310 μmol/l). Podobně bylo v některých studiích pozorováno lepší přežívání, pokud byly RRT metody zahájeny při nižších hodnotách urey. I v těchto studiích se však hraniční hodnoty urey definující „časné“ zahájení velmi lišily (rozpětí od < 21 mmol/l do < 35,7 mmol/l) a ne všechny studie tento signál potvrdily. Osm studií si všímalo úlohy diurézy jako indikace k RRT. Většina z nich došla k závěru, že klinický výsledek je lepší, je‑li indikace k RRT posouzena dle oligurie než dle sérových koncentrací kreatininu či urey. Studie se opět značně lišily definicí oligurie (< 100 ml/8 h, < 400 ml/24 h, < 30 ml/h po dobu 6 h). Velká retrospektivní studie (1 847 pacientů vyžadujících RRT) ukázala, že hodnoty urey a kreatininu nejsou asociovány s mortalitou. Hlavními faktory, které byly nezávisle spojeny s horším přežitím, byly potřeba umělé plicní ventilace, multiorgánové selhání, acidóza, oligurie a věk (Ostermann et al., 2009). Tato data naznačují, že rozhodnutí k zahájení RRT by mělo v menší míře zohlednit absolutní hodnoty kreatininu a urey, a naopak vzít v úvahu celkovou tíži onemocnění, míru acidózy a diurézy. Rozpoznání nových biomarkerů je nadějí, že by se mohly stát vhodnými parametry k indikaci RRT. Analyzované studie však vedly autory komentovaného článku k závěru, že žádný z moderních biomarkerů (NGAL, cystatin C) zatím nelze rutinně v rozhodovacím procesu použít. Na základě provedené analýzy dostupných dat autoři navrhli klinický algoritmus (obr. 1), který by měl být vodítkem při rozhodování o napojení kriticky nemocného pacienta s AKI na některou z metod RRT.
Obr. 1 Rozhodovací algoritmus k zahájení RRT (dle Ostermann et al.)
Komentář
- Prof. MUDr. Martin Matějovič, Ph.D., I. interní klinika LF UK a FN Plzeň
Literatura
- Joannidis M, Forni LG. Clinical review: timing of renal replacement therapy. Crit Care 2011;15:223.
- Ostermann M, Chang RW. Correlation between parameters at initiation of renal replacement therapy and outcome in patients with acute kidney injury. Crit Care 2009;13:R175.
- Kategorie: Komentované články
- Klíčová slova: akutní poškození ledvin; dialyzační léčba
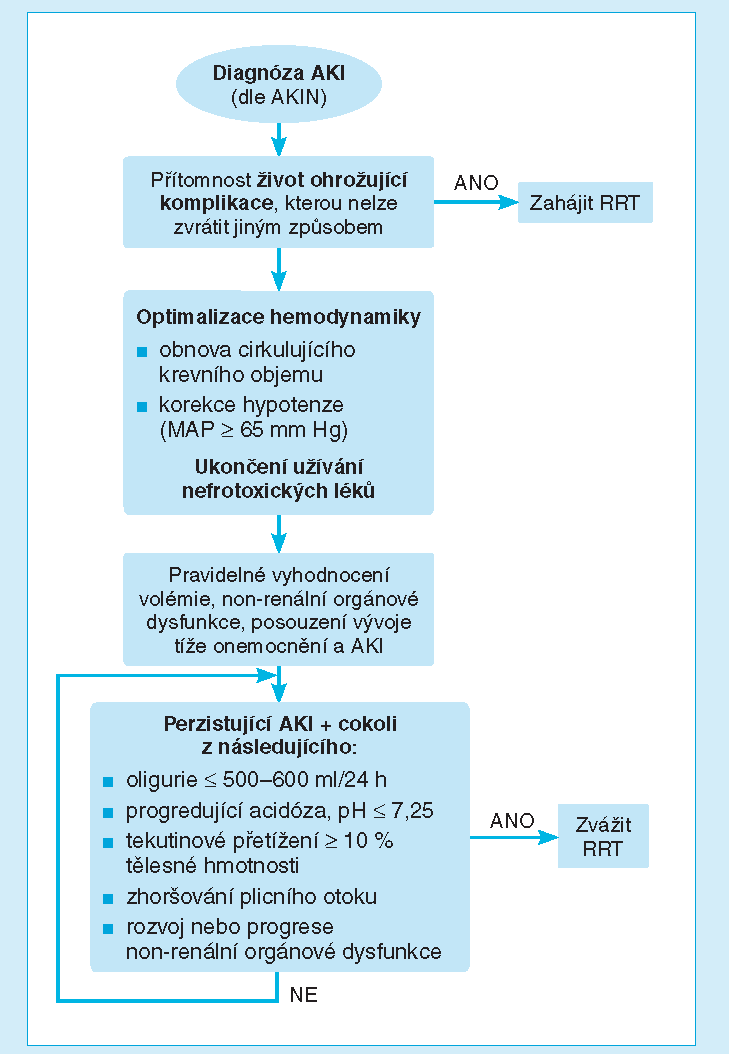
Správné načasování RRT je modifikovatelný faktor, který může hrát významnou úlohu v ovlivnění celkového léčebného výsledku. Při rozhodování o zahájení RRT má zcela zásadní význam charakter základního onemocnění, které je příčinou AKI. Na rozdíl od situace, kdy příčinou AKI je například intersticiální nefritida u jinak zcela stabilního a dosud zdravého pacienta, přístup bude zcela odlišný od stavu, kdy se AKI vyvíjí na pozadí septického šoku s multiorgánovým selháním u polymorbidního nemocného. Jinými slovy, při úvahách o načasování a indikaci RTT je nutné odlišit izolované AKI od AKI, které je součástí akutního systémového onemocnění s víceorgánovým postižením (sepse, polytrauma, pooperační komplikace, popáleniny, pankreatitida apod.). Druhým problémem, který je nezbytné zohlednit při analýze dostupných studií, je definice „časného“ versus „pozdního“ načasování RRT. Jak vyplývá z komentované studie, definice jsou velmi heterogenní a subjektivní. Některé studie rozlišují časný versus pozdní přístup dle absolutních hodnot či relativních změn konvenčních biochemických ukazatelů (urea, kreatinin), úrovně diurézy, jiné načasování definují intervalem od přijetí na jednotku intenzivní péče do doby napojení na RRT. Tyto významné limity dramaticky snižují výpovědní hodnotu dosud provedených studií. Velmi problematické je posuzování indikace k RRT pouze dle hodnot urey či kreatininu. Jejich absolutní hodnoty jsou u kriticky nemocných ovlivněny řadou proměnných. Hodnoty urey jsou zkresleny významnou změnou distribučního objemu, zvýšenou produkcí katabolickým stavem, zvýšenou tubulární reabsorpcí. Podobně sérové koncentrace kreatininu jsou ovlivněny mj. jeho produkcí (snížena např. při sepsi), zkresleny intenzivní tekutinovou resuscitací (diluce podhodnocující absolutní hodnoty). Ve svém důsledku absolutní hodnoty těchto biochemických ukazatelů nemusejí odrážet koncentraci jiných (uremických) toxinů ani skutečný stav renálních funkcí. I z těchto důvodů nejsou vhodnými kritérii k definování časné versus pozdní RRT léčby. Data z recentních velkých RCT obecně ukazují, že sérové koncentrace urey a kreatininu se v době zahájení RRT u kriticky nemocných s AKI pohybují v rozmezí 18–40 mmol/l (pro ureu) a 300–450 μmol/l (pro kreatinin) (Joannidis a Forni, 2011). V poslední době se na různých odborných fórech rovněž diskutuje o úloze nového klasifikačního systému AKI (kritéria AKIN či RIFLE) při indikacích k RRT. Zde je nutno zdůraznit, že tato kritéria byla vytvořena s cílem definovat AKI a klasifikovat jeho závažnost. I když tíže AKI dle těchto kritérií koreluje s prognózou, uvedený klasifikační systém nikdy nebyl vytvořen s cílem predikovat potřebu RRT. Jednotlivá kritéria AKIN tudíž nemohou sloužit jako argument k načasování RRT, aniž bychom nezohlednili další klíčové kompozitní proměnné, včetně charakteru základního onemocnění, který vedl k rozvoji kritického stavu (i pokročilé AKI III. stupně může být plně reverzibilní např. odstraněním obstrukce bez potřeby RRT; naopak převodněný pacient bez diuretické odezvy může profitovat z časné RRT nezávisle na absolutních hodnotách kreatininu). Autoři komentované studie navrhují algoritmus, který zcela správně akcentuje význam vyhodnocení stavu pacienta a jeho trendu a současně relativizuje přínos absolutních hodnost klasických biochemických ukazatelů renálních funkcí. Prioritním přínosem tohoto, byť jakkoli obecného algoritmu je přísné individuální posouzení, založené na frekventním vyhodnocení trajektorie kritického stavu, jeho odpovědi na úvodní léčbu a zohlednění kontextu víceorgánové dysfunkce. Nepříznivý vývoj hemodynamické situace (šokový stav), progredující metabolická acidóza, trvající oligurie, rozvoj multiorgánové dysfunkce a tekutinové přetížení rezistentní na léčbu diuretiky jsou okolnosti, které tvoří základní klinický argument pro zahájení RRT, zcela nezávisle na absolutních hodnotách urey či kreatininu. Předložený algoritmus je pochopitelně pouhým obecným rámcem pro klinickou rozvahu, neposkytuje vodítko pro jiné klíčové proměnné RRT (dávka, modalita), nezohledňuje některé non‑renální indikace k RRT. Otázka optimálního načasování RRT zůstává vzhledem k nedostatku dat založených na seriózních důkazech stále nedořešenou. V denní praxi však není správné klást si otázku, zda je časnější zahájení RRT u kriticky nemocných s AKI lepší než odložené. Správným postupem, byť často obtížným, je zahájit RRT v pravý čas. Jeho nalezení bude vždy u každého pacienta přísně individuální. Nikdy bychom však neměli dopustit, aby vyčkávání s indikací k RRT dospělo k naplnění konvenčních absolutních kritérií, uvedených v úvodu článku.