Dávkování antibiotik u kriticky nemocných s potřebou náhrady funkce ledvin – složitá teorie, empirická praxe
Eyler RF, Mueller BA. Antibiotic dosing in critically ill patients with acute kidney injury. Nat Rev Nephrol 2011;7:226–235.
Časná a správně zvolená (ve smyslu volby typu a dávky) antimikrobiální léčba patří mezi nejdůležitější faktory přežití kriticky nemocných pacientů ohrožených sepsí. Přesto zůstává jednou z nejobtížnějších výzev pro intenzivisty. Správné dávkování antibiotik (ATB) je všeobecně komplikované u kriticky nemocných.
Důvodem je řada patofyziologických změn, zahrnujících zvýšený distribuční objem, sníženou vazbu na bílkoviny a změněnou jaterní clearance léčiv. Situace je ještě komplikovanější, pokud je při volbě dávky ATB nutno navíc zohlednit současnou sníženou renální clearance léčiv a jejich případnou eliminaci způsobenou různými metodami a různou intenzitou mimotělních očišťovacích metod (RRT, renal replacement therapy). Kromě komplikovaných farmakokinetických proměnných jsou nefrologové i intenzivisté konfrontováni s další bariérou – nedostatkem klinických studií, které by umožnily vést strategii ATB léčby na podkladě solidních důkazů. Dosud provedené analýzy trpí řadou nedostatků – jsou obvykle prováděny na velmi malé, heterogenní populaci kriticky nemocných, předmětem studia jsou jen vybrané druhy ATB a výsledky často není možné extrapolovat na jiné modality RRT či na jiné dávky RRT. Vodítkem pro klinickou praxi mohou být souhrnné články, jejich kvalita a klinická využitelnost je však velmi variabilní. Nature Review Nephrology v letošním roce přináší přehledový článek, který očekávání kliniků v řadě ohledů uspokojuje. Předmětem tohoto článku je stručný výběr z původního článku doplněný komentářem autora.
Jedním z nejdůležitějších parametrů, který ovlivňuje farmakokinetiku u kriticky nemocných, je distribuční objem. Sepse je typickým onemocněním, kdy v důsledku zvýšené kapilární propustnosti dochází k významnému úniku tekutin do intersticia. Současná nevyhnutelnost velkoobjemové tekutinové resuscitace vede k výraznému zvětšení objemu extravaskulární tekutiny a tím i distribučního objemu. Anurie provázející akutní poškození ledvin (AKI) tento fenomén dále potencuje. Důsledkem je skutečnost, že distribuční objem hydrofilních ATB (aminoglykosidy, β‑laktamová ATB, glykopeptidy) se u těchto nemocných značně liší od údajů převzatých z farmakokinetických studií zdravé populace. Zvýšení distribučního objemu může mít při nesprávném dávkování za následek subterapeutické plazmatické koncentrace těchto ATB. Dávkování ATB je nutno přizpůsobit nejen v úvodu, ale i během dalšího pobytu na jednotce intenzivní péče. Klinické zlepšení je obvykle spojeno s rezolucí otoků, a tím i se snížením distribučního objemu. Podobně korekce kumulativní bilance prostřednictvím RRT povede ke změnám v distribučním objemu. Další z klíčových proměnných je pokles vazby ATB na plazmatické proteiny. Tento pokles je způsoben poklesem produkce bílkovin a současně jejich únikem extravaskulárně. U pacientů s AKI se na snížené vazebné kapacitě bílkovin může podílet i urémie. Některé uremické toxiny totiž mohou kompetitivně vazebné místa plazmatických bílkovin obsadit. AKI provázející sepsi není spojeno pouze se sníženou glomerulární filtrací, ale rovněž s narušenou tubulární sekrecí a reabsorpcí. Dávkování ATB tak může být ovlivněno způsobem, který obvykle není brán v úvahu. Například fluconazol podléhá významné reabsorpci ve zdravých ledvinách. Významná porucha tohoto procesu v průběhu těžkého AKI může znamenat nutnost podávání neadjustovaných nebo dokonce vyšších dávek než u nemocných s normální funkcí ledvin.
Všeobecně platí, že léky, které jsou eliminovány ledvinami, budou eliminovány i během RRT. Mezi snadno odstranitelné látky patří ATB s malou molekulární hmotností, malým distribučním objemem (< 1 l/kg) a malou vazbou na bílkoviny. I když snížení vazby na bílkovinu (velmi častý fenomén u kriticky nemocných) zvyšuje distribuční objem, eliminace je rovněž zvýšená, protože více volného léku je dostupného pro odstranění ledvinami nebo RRT. Metody RRT se však velmi liší, a tak výsledný vliv na eliminaci léčiv může být velmi variabilní. Mezi faktory, které mohou ovlivnit clearance léčiv, patří princip očišťování (konvekce, difuze, kombinace obou), typ membrány (povrch, velikost pórů, ultrafiltrační koeficient, adsorpční vlastnosti, prediluční vs. postdiluční uspořádání u kontinuálních metod). Nejdůležitějším činitelem, ovlivňujícím odstranění léčiv, je však dávka RRT, tj. velikost objemu efluentu. Ten je určen nejen nastavením (ml/kg/h), ale i dobou trvání RRT. Velikost dávky se v posledním desetiletí významně zvýšila, a proto není možné přejímat doporučení, která vzešla ze starších studií. Například vydání Drug Prescribing in Renal Failure z roku 2007 jsou založena na doporučeních, která vycházejí z dávky kontinuálních metod 2 l/h. To znamená, že tato doporučení nelze aplikovat na situace, kdy se používají vyšší (nebo naopak nižší) dávky CRRT.
Úspěšná ATB léčba u pacientů s AKI nevyžaduje jen farmakokinetické úvahy. Pozornost musí být soustředěna rovněž na farmakodynamické aspekty. Většinu ATB lze rozdělit do dvou farmakodynamických kategorií. První skupinou jsou ATB, jejichž účinek je závislý na čase (time‑dependent ATB), bez post‑antibiotického efektu (β‑laktamová, glykopeptidy, makrolidy, linkosamidy, linezolid). U těchto léčiv je pro dobrou účinnost a minimalizaci rizika vzniku rezistence rozhodující co nejdelší doba, kdy se plazmatická koncentrace léku pohybuje nad minimální inhibiční koncentrací (MIC) patogenu. Druhou skupinou jsou ATB, jejichž účinek je závislý na koncentraci (concentration‑dependent). U nich je rozhodující poměr maximální plazmatické koncentrace k MIC (aminoglykosidy, colistin, metronidazol). Oba předpoklady je vhodné uplatnit pro potřebu farmakodynamiky chinolonů (AUC/MIC). V případě time‑dependentních ATB mohou metody RRT odstranit významné množství β‑laktamových ATB. Jejich účinek lze optimalizovat prodloužením intermitentní infuze či kontinuálním podáváním. Příkladem ATB, která byla takto testována, jsou meropenem a ceftazidim. Kontinuální infuze meropenemu (nasycovací dávka 500 mg, udržovací 2 g/24 h) a ceftazidimu (2 g nasycovací dávka, udržovací 3 g/24 h) účinně udržovaly koncentraci testovaných ATB nad čtyřnásobkem MIC. Není‑li kontinuální podávání možné, je vhodné k udržení sérové koncentrace po úvodním neadjustovaném bolusu zvážit častější podávání menších udržovacích dávek. Ideálním přístupem by bylo monitorování terapeutických koncentrací, které je však t.č. pro β‑laktamová ATB rutinně nedostupné. Snaha dosáhnout maximálního účinku u koncentračně‑dependentních ATB je u nemocných vyžadujících RRT spojena s rizikem toxicity. U intermitentních metod někteří autoři doporučují podávat dávku ATB před procedurou a tu využít ke korekci přetrvávající vysoké koncentrace (např. aminoglykosidů). Problémem podávání ATB tohoto typu je variabilita RRT, které jsou často z řady důvodů přerušovány. Pokud má být načasování podání ATB sladěno s RRT, je nezbytné, aby dialýza byla zahájena každý den vždy ve stejný čas.
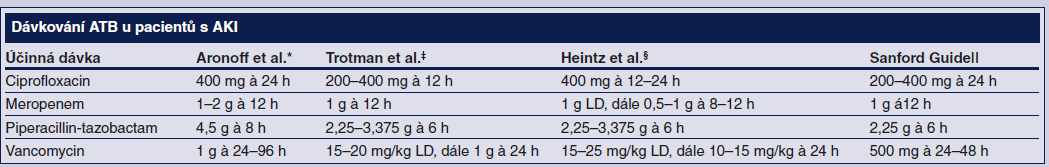
Strategie ATB léčby u těchto komplikovaných pacientů musí být vždy individualizována. Individualizovaná na proměnné pacienta (tělesná hmotnost, volum status), proměnné RRT (dávka, membrána, modalita) a na vlastní účinnou látku (farmakokinetika, farmakodynamika). Prakticky ve všech situacích dosáhneme standardní nasycovací dávkou žádoucí sérové koncentrace, a to bez nutnosti přizpůsobení funkci ledvin nebo současné léčbě některou z metod RRT. Monitorace koncentrací by měla být využita ve všech případech, kde je to dosažitelné. Orientační dávkování pro nemonitorovatelná ATB jsou uvedena v tabulce. Je vhodné počítat i s rebound fenoménem, tj. zvýšením koncentrací po ukončení RRT a redistribuci ATB z tkáňového do intravaskulárního kompartmentu. Čerpání informací z literatury je vhodné, ale klinická situace musí být srovnatelná s populací a technikou RRT užitou v dané studii. Přehledná doporučení uvádějící individualizované dávkování u pacientů na kontinuálních metodách RRT byla nedávno publikována (Choi, 2010).
* Doporučení jsou založena na dávce
dialyzátu/ultrafiltrátu/efluentu 2 l/h.
‡ Doporučení pro pacienty na kontinuální hemodialýze s dávkou 1
l/h.
§ Doporučení pro pacienty na kontinuální hemodialýze s dávkou 1–2
l/h.
|| Dávka není uvedena.
LD – nasycovací úvodní dávka; RRT – renal replacement therapy
Klíčové body
- Změny farmakokinetiky léku u kriticky nemocných s AKI a léčených různými technikami RRT znemožňují standardizované dávkování ATB.
- Většina kriticky nemocných s AKI vyžaduje navzdory snížené renální clearance vyšší dávky ATB, především v případě život ohrožujících komplikací.
- Rozhodnutí o dávce léku musí zahrnovat farmakodynamické i farmakokinetické úvahy.
- Je‑li dávkování přejímáno z publikovaných doporučení, je nezbytné se vždy ujistit, že doporučení jsou aplikovatelná na konkrétní klinickou situaci, resp. pacienta.
- Hybridní formy RRT vyžadují stejné změny v dávkování ATB jako v případě kontinuálních technik. Pro hybridní techniky musí být navíc zváženo načasování dávky.
Komentář
- MUDr. Jaroslav Raděj
- Prof. MUDr. Martin Matějovič, Ph.D., I. interní klinika LF UK a FN Plzeň
Literatura
- Gilbert DN, et al (eds). The Sanford Guide to Antimicrobial Therapy. Antimicrobial Therapy, Inc 2010.
- Choi G, Gomersall CD, Tian Q, et al. Principles of antibacterial dosing in continuous renal replacement therapy. Crit Care Med 2009;37:2268–2282.
- Novák I, Matějovič M, Černý V. Akutní selhání ledvin a eliminační techniky v intenzívní péči. Praha: Maxdorf, 2008.
- Kategorie: Komentované články
- Klíčová slova: akutní poškození ledvin; antibiotická léčba
Respektování farmakokinetiky a farmakodynamiky je stejně důležité jako správná volba léku. Dávkování mimo terapeutický interval vede na jedné straně k selhání léčby, na druhé straně k její toxicitě, v obou případech se zdravotními i ekonomickými důsledky. Dávkování některých léčiv lze snadno řídit dle jejich bezprostředně sledovatelné farmakodynamiky (např. katecholaminy, inzulin apod.), u ostatních látek je účinek léčby patrný po dnech či týdnech („tichý“ farmakodynamický profil). V těchto případech je nutné spoléhat se na doporučené dávkování, pokud není možné přímé monitorování koncentrace účinné látky (typicky antimikrobiální léky). Neadekvátní ATB léčba má za zřetelný důsledek vyšší mortalitu kriticky nemocných. Rozhoduje nejen účinné pokrytí vyvolávajícího agens, ale i dávka a délka antimikrobiální léčby. Vážným důsledkem neefektivní léčby je také nárůst bakteriální rezistence. Způsob eliminace léku a pravděpodobnost vylučování RRT lze odvodit na základě několika skutečností:
Doporučení o způsobu dávkování léčiv u pacientů s renálním postižením a při intermitentní hemodialýze je běžnou součástí informace o přípravku. Intermitentní hemodialýza je sice vysoce účinná očišťovací metoda, ale trvání procedury i její frekvence je ve vztahu k relevantnímu odstranění látky z organismu nízká (pomalá redistribuce léku mezi tělesnými kompartmenty). Nepředstavuje tak vysoké riziko poddávkování, zejména načasujeme‑li dávkovací interval na závěr procedury. Preparáty kombinované s inhibitory β‑laktamázy, amoxicilin/kyselina klavulanová, cefoperazon/sulbactam a trimethoprim/sulfamethoxazol, jsou nevýhodné při renální dysfunkci i při potřebě náhrady funkce ledvin, jelikož každá ze složek je vylučována odlišným typem eliminace, a dochází tak k rozštěpu obou komponent. U ostatních potencovaných léčiv obě složky podléhají ledvinnému způsobu vylučování, poměr komponent se může změnit vlivem jejich odlišné rychlosti eliminace, nejde ale již o tak závažný problém. Obtížnější je doporučení úpravy dávkování antimikrobiálních léků u kriticky nemocných s potřebou kontinuálních metod RRT. Nepřetržitý průběh procedury za pomalé mezikompartmentové redistribuce léčiva může znamenat významnou účast metody na eliminaci léku.
Jak již bylo uvedeno výše, úvodní dávkovací režim není problémem. Tím se stává strategie udržovací léčby. V literatuře existuje řada schémat, resp. vzorců pro kalkulaci udržovací dávky. Všechny metody jsou však orientační, prakticky limitované a zatížené značnou variabilitou stavu pacienta a potřebou znalosti farmakokinetických proměnných. Časově nejméně náročný způsob odhadu úpravy dávkování je na základě informací získaných z přehledů publikovaných farmakokinetických studií. V české literatuře je praktický návod dostupný v kapitole P. Dostála „Dávkování farmak a kontinuální eliminační metody“ (Novák et al., 2008). Dalším vhodným zdrojem pro rozhodovací algoritmus je ročně aktualizovaný referenční manuál antimikrobiální terapie (Gilbert et al., 2010).
Přesné dávkování antimikrobiální látky u kriticky nemocného s AKI a RRT neznáme. Mezi další základní pravidla pro jejich bezpečné a účinné podávání patří: