Postup při zpracování renálních biopsií
Amann K, Haas CS. What you should know about the work-up of a renal biopsy. Nephrol Dial Transplant. 2006;21:1157–1161.
V úvodu autoři zdůrazňují fakt, že získání optimální informace z renální biopsie (RB) představuje interdisciplinární záležitost, vyžadující úzkou spolupráci mezi klinikem a patologem. S cílem dosáhnout určitého standardního postupu při zpracování RB vytvořila Společnost pro renální patologii (Renal Pathology Society) doporučené postupy (Regele, 2000), pokrývající především následující kroky při provedení a zpracování RB:
- Odběr bioptického vzorku
- Transport bioptického vzorku
- Rozdělení bioptického vzorku
- Uchování bioptického vzorku
- Krájení bioptického vzorku
- Barvení bioptického vzorku
- Vypracování bioptického protokolu s popisem změn
- Stanovení diagnózy
Pokud jsou respektovány tyto jednotlivé kroky, lze přibližně se 40–50% pravděpodobností očekávat, že výsledky RB přímo ovlivní další péči o pacienta.
Jaká velikost vzorku RB je minimální a pro patologa optimální? Při renální biopsii doporučujeme odebrat dva válečky tkáně o minimální délce 1 cm a průměru 1,2 mm. Obecně se uznává, že v optimálním případě tkáň obsahuje 10 až 15 glomerulů, ačkoli často i počet 6–10 glomerulů je pro stanovení diagnózy dostačující. Corwin a spol. (1988) však oprávněně podotýkají, že v takovýchto případech se zvyšuje možnost chybného hodnocení pokročilosti onemocnění především u fokálních lézí. Navíc u malého vzorku je obtížné vyloučit fokální změny. Proto má patolog před rozhodnutím o tom, jak vzorek zpracovat kontrolovat velikost a kvalitu bioptického vzorku ve světelném mikroskopu. Jeden váleček s tkání by měl být fixován pro vyšetření ve světelné mikroskopii (SM) a druhý je určen pro vyšetření imunofluorescenční/imunohistologické, vyšetření v elektronové mikroskopii (EM) a další doplňková vyšetření.
Které klinické informace jsou pro patologa nezbytné? Žádoucí je poskytnout klinické údaje o anamnéze se zaměřením na současné ledvinné onemocnění, recentní laboratorní výsledky z moči (proteinurie, hematurie, leukocyturie, cylindrurie) a krve (urea, kreatinin, cholesterol, celková bílkovina, clearance kreatininu, C3 a C4 složky komplementu, autoprotilátky) a údaje o přítomnosti diabetes mellitus, hypertenze či systémového onemocnění a také údaje o léčbě.
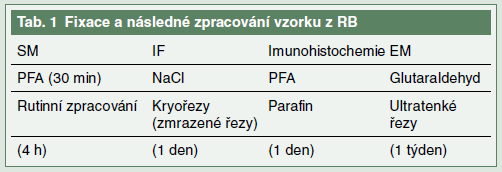
Jak by měl být vzorek z renální biopsie zpracován? Ideálním mediem pro rychlý lokální transport je izotonický roztok NaCl. Ten umožňuje následně použít další metody zpracování vzorku: zmrazení jedné části vzorku pro imunofluorescenční vyšetření (IF), fixaci paraformaldehydem (PFA) či formaldehydem (4 %) a souběžně fixaci malého vzorku v 3% glutaraldehydu (pro EM) (tab. 1).
Jaké metody zpracování RB užívá patolog? Vzorek zalitý v parafinu je vhodné krájet na 8–16 řezů (2–3 μm silných), určených pro SM a imunohistochemická barvení.
K barvení vzorku pro SM se používá ■ rutinní barvení hematoxylinem a eosinem (HE); ■ periodic acid-Schiff (PAS); ■ barvení na fibrózu (sírius červeň nebo trichrom aj.); ■ nějaký typ stříbření (např. PASM); ■ barvení znázorňující bílkoviny (např. AFOG).
Jako doplňková barvení mohou být použita různá speciální barvení, např. von Kossa (průkaz vápenných solí/ kalcifikací) nebo Kongo červeň (průkaz amyloidu).
Použití jednotlivých barvení poskytuje vzájemně se doplňující informace. Základní informaci o tkáni a jejím složení poskytuje HE (kůra vs. dřeň, počet glomerulů). Pro (detailnější) analýzu glomerulu (hodnocení mesangia, změn GBM) je vhodné barvení PAS, které umožňuje také hodnocení cévních změn. Masivní imunitní depozita mohou být detekována v barvení prokazujícím proteiny (např. kyselý fuchsin, Orange G: AFOG). Podezření na přítomnost imunodepozit může vzejít již z SM, jejich přesné posouzení je nutné provést jinými metodami. Hlavní výhodou stříbřících metod je schopnost detailně znázornit změny GBM. Dalším rutinně používaným barvením je některá z technik prokazujících fibrózu (trichrom, Sirius red).
Jaké informace poskytuje imunohistochemie a imunofluorescence? Protilátky bývají při vyšetření RB použity buď v rámci IF (vyšetření žádá nativní, tj. nefixovanou tkáň), či imunohistochemického vyšetření (které může být provedeno z formolem fixované, parafinovou technikou zpracované tkáně). Pro průkaz se používají antiséra či monoklonální protilátky proti imunoglobulinům anebo proti složkám aktivace komplementu (C1q, C3, C4), jakož i lehkým řetězcům κ a λ, albuminu, fibrinogenu aj. Patolog by měl zaznamenat nejen pozitivitu protilátek, ale i jejich lokalizaci (mesangiální vs. kapilární), vzor (lineární vs. granulární). Pokud to tento typ vyšetření umožní, měla by být rovněž uvedena lokalizace depozit (subendoteliální, intramembranózní či subepiteliální). Pro speciální účely je možno použít protilátky proti komponentám amyloidu (amyloid AA či AL, transthyretin aj.) nebo např. protilátky proti virovým antigenům (CMV, polyoma viry).
Kdy je nezbytné vyšetření vzorku RB elektronovou mikroskopií? Vyšetření elektronovou mikroskopií není nutné u všech RB, protože však výsledek bioptického vyšetření nemůže být předvídán, je rozumné ponechat část vzorku pro možné dodatečné EM zpracování. EM vyžaduje zvláštní fixaci a specifické zpracování, jde o časově náročnou techniku. V případě nutnosti lze EM provést i z tkáně zpracované v parafinu. Pro některé diagnózy je provedení EM nezbytné (Alportův syndrom, syndrom tenkých membrán, fibrilární/ imunotaktoidní GN, minimal change disease).
Jaké informace elektronová mikroskopie poskytuje? EM umožňuje posoudit následující změny: ■ přítomnost a stupeň buněčné proliferace (mesangiální vs. endoteliální); ■ změny buněčné struktury (splývání podocytárních výběžků či vakuolizace podocytů); ■ nekrózu a apoptózu buněk; ■ změny v GBM; ■ lokalizace imunoglobulinových depozit; ■ u některých renálních onemocnění, např. u systémového lupusu (SLE) lze rozpoznat specifické změny (obraz „fingerprints“ či tubuloretikulárních formací).
Jak by měl patolog popsat nálezy z renální biopsie? Pro komunikaci mezi klinikem a patologem je užitečné dodržovat standardní formát popisu. Informace patologa by měla obsahovat: ■ údaj o tom, zda vzorek je adekvátní z hlediska velikosti a obsahu jednotlivých struktur, zvl. glomerulů; ■ popis morfologických změn systematicky postihujících jednotlivé části tkáně (změny v glomerulech, v intersticiu, v cévách); ■ výsledky IF, event. imunohistochemie; ■ výsledky EM (toto vyšetření je časově náročné a obvykle vyžaduje samostatnou zprávu zaslanou později). Je výhodné nejdříve uvést popisný typ diagnózy (např. mesangioproliferativní glomerulonefritis) a následně konečnou diagnózu, která v sobě zahrnuje všechna dostupná vyšetření, jakož i klinické údaje (např. IgA nefropatie).
Lze předpokládat, že dodržování systematického postupu při zpracování renální biopsie zvýší význam tohoto vyšetření pro další léčbu nemocného.
Komentář
- Prof. MUDr. Miroslav Merta, CSc., Ph.D., Lékařská fakulta v Hradci Králové
Literatura
- Corwin HL, Schwartz MM, Lewis EJ. The importance of sample size in the interpretation of the renal biopsy. Am J Nephrol 1988;8:85–89.
- Iseki K, Miyasato F, Uehara H, et al. Outcome study of renal biopsy patients in Okinawa, Japan. Kidney Int 2004;66:914–919.
- Regele H, Mougenot B, Brown P, et al. Report from Pathology Consensus Meeting on Renal Biopsy Handling and Processing, Vienna, February 25, 2000 (http://www.kidney-e...hologyconsensus.htm)
- Kategorie: Komentované články
- Klíčová slova: biopsie
Cílem článku je upozornit na některé praktické okolnosti vztahující se k histologickému zpracování vzorků z renální biopsie, které nejsou klinickými pracovníky (především nefrology) vždy dostatečně doceňovány, a přitom mohou výtěžnost RB významně ovlivňovat.
Zásadní otázkou patrně je, do jaké míry lze vnímat RB jakožto důležitou (resp. klíčovou) diagnostickou metodu u nemocných s renálním onemocněním. Lze rozumně předpokládat, že dodržování vhodných metodických postupů (ze strany kliniků nefrologů) je do značné míry ve vazbě s jejich přesvědčením o přínosu RB pro další péči o tyto nemocné; z mnoha recentních prací lze uvést např. japonskou práci Isekiho a spol. (2004), zabývající se významem RB pro prognózu renálního onemocnění. Problematika indikací k RB versus komplikací při jejich provedení je jistě mimořádně zajímavá, avšak přesahuje rámec komentovaného článku.
První důležitou otázkou, ve které se názory nefrologů a patologů dosti často různí, je, jaká je nezbytná minimální velikost vzorku RB u konkrétního pacienta. Na jedné straně patolog oprávněně požaduje takové množství ledvinné tkáně, aby ji bylo možno vyšetřit veškerými potřebnými metodami a aby závěr histologického zpracování umožnil stanovení jednoznačné diagnózy. Na druhé straně klinik-nefrolog, který provádí RB, má jistě podvědomou tendenci odebrat pouze naprosto nezbytné minimální množství tkáně s vědomím toho, že snaha o odběr většího množství tkáně či většího počtu vzorků pro RB zvyšuje riziko vzniku komplikací. Je nepochybné, že obeznámení klinického pracovníka s podmínkami a možnostmi zpracování RB (které leží na straně patologa) zvyšuje pravděpodobnost, že vynaloží dostatečné úsilí na to, aby vzorek odebraný při RB byl dostatečně velký a reprezentativní. Jedním z metodických přístupů, zaručujících, že vzorek bude dostatečně reprezentativní, je vyšetření histologického vzorku ještě v průběhu RB (mikroskopem či turmonem) – se zaměřením na přítomnost glomerulů v odebrané tkáni. Lze tak získat okamžitou informaci, díky níž lze buď pokračovat ve výkonu (v případě, že nebyla odebrána ledvinná tkáň či vzorek ledvinné tkáně je marginální), či výkon ukončit (v případě, že odebraný vzorek byl reprezentativní).
V mnoha dalších případech je bolavým místech spolupráce klinika a patologa nedostatek klinických informací. Tento aspekt spolupráce by bylo jistě možno komentovat velmi obšírně, ale snad by bylo možné se omezit na konstatování, že ze strany klinických pracovníků zůstávají často „rezervy“, týkající se poskytnutí poměrně běžných relevantních klinických údajů. Je jistě poněkud paradoxní, je-li stanovena diagnóza mnohočetného myelomu (či jiných onemocnění ledvin spojených s produkcí atypických bílkovin z RB), lze-li tuto diagnózu stanovit jinými neinvazivními přístupy. Je nasnadě, že popis nálezu RB je nutno dát do kontextu s klinickým obrazem pacienta, tak aby umožnil plnou interpretaci průběhu daného onemocnění. Dobře lze tuto skutečnost dokumentovat na příkladu členění glomerulonefritid (GN) do podskupiny primárních vs. sekundárních GN. Zatímco histologický nález je v obou případech identický (či téměř identický), stává se důvodem pro jeho zařazení do jedné či druhé podskupiny vazba, či naopak nepřítomnost některých významných klinických faktorů.
Ne vždy je v praxi optimálně vyřešeno rozdělení a fixace vzorku. Vzorek může dělit klinik bezprostředně po provedení RB, nebo může vzorek dělit patolog, který bude následně tkáň vyšetřovat. Nevhodný způsob rozdělení tkáně může významně snížit výtěžnost bioptátu. Je-li např. vzorek určený na IF (kryořezy) bez glomerulů, nelze imunokomplexovou GN přesně klasifikovat. Klinický pracovník může v některých případech napomoci vhodnému a účelnému rozdělení odebraného vzorku tím, že zdůrazní, který typ informace z vyhodnocovaného vzorku má rozhodující význam (např. při opakované RB u nemocného s IgA nefropatií se lze obejít bez opětovného vyšetření IF).
Stanovení diagnózy představuje závěrečný výstup z práce patologa při vyšetření histologického vzorku. V některých případech vystupuje do popředí časový faktor předání informace o histologickém nálezu (např. u tzv. rychle progredujících GN). Úzká vzájemná spolupráce patologa a klinika-nefrologa může v podobných případech doslova vést k záchraně života či funkce ledvin pacienta.