Nové molekuly v nefrologii
Souhrn
V současné době je u nejčastější primární glomerulonefritidy IgA nefropatie testována řada nových léků. Některé z těchto nových léků již byly schváleny, například pomalu uvolňovaná forma budesonidu (Tarpeyo™). Řada dalších slibných molekul zasahujících na úrovni vlastní patogeneze onemocnění je studována v rámci klinických studií. V souhrnném článku je přehledně diskutována problematika nových léčebných možností v probíhajících klinických studiích.
Klíčová slova: B buňky – budesonid – IgA nefropatie – plazmatické buňky – proteinurie – renální insuficience
Po dlouhé době je u některých glomerulopatií testována řada nových léků, z nichž některé již úspěšně prošly závěrečným vyhodnocením a měly by být brzy dostupné i pro naše pacienty. Zaměřím se pouze na nejčastější primární glomerulonefritidu IgA nefropatii (IgAN).
Sparsentan (Travere Therapeutics), duální inhibitor receptoru pro angiotenzin II typu 1 (AT1) a endotelinového receptoru typu A (ET‑A) pravděpodobně dokáže snížit proteinurii účinněji než současná podpůrná léčba, jak vyplývá z dosavadních výsledků studie.1 Definitivní závěry této studie ještě nejsou známy.
Dapagliflozin (Forxiga®, AstraZeneca), inhibitor sodíko‑glukózového kotransportéru 2 (SGLT2), rovněž může pomoci ke snížení proteinurie a stabilizaci funkce ledvin,2 ale subanalýza u podskupiny pacientů s IgAN musí být potvrzena v dalších studiích s přesně definovanými vstupními kritérii (někteří pacienti neměli maximálně tolerované dávky inhibitoru angiotenzin konvertujícího enzymu [ACEI] po dobu tří měsíců před vstupem do studie) a histologickým potvrzením diagnózy IgAN. Od 1. 8. 2022 je léčivý přípravek Forxiga® plně hrazen z veřejného zdravotního pojištění u dospělých pacientů v indikaci léčby chronického onemocnění ledvin s odhadovanou glomerulární filtrací (eGFR) v rozmezí 25–75 ml/min/1,73 m2 (0,41–1,25 ml/s) a poměrem albumin/kreatinin v rozmezí 200–5 000 mg/g (22,6–565 g/mol), kteří jsou léčeni stabilní dávkou ACEI nebo blokátoru receptoru typu 1 pro angiotenzin II (ARB) nebo u kterých je terapie těmito přípravky kontraindikována.
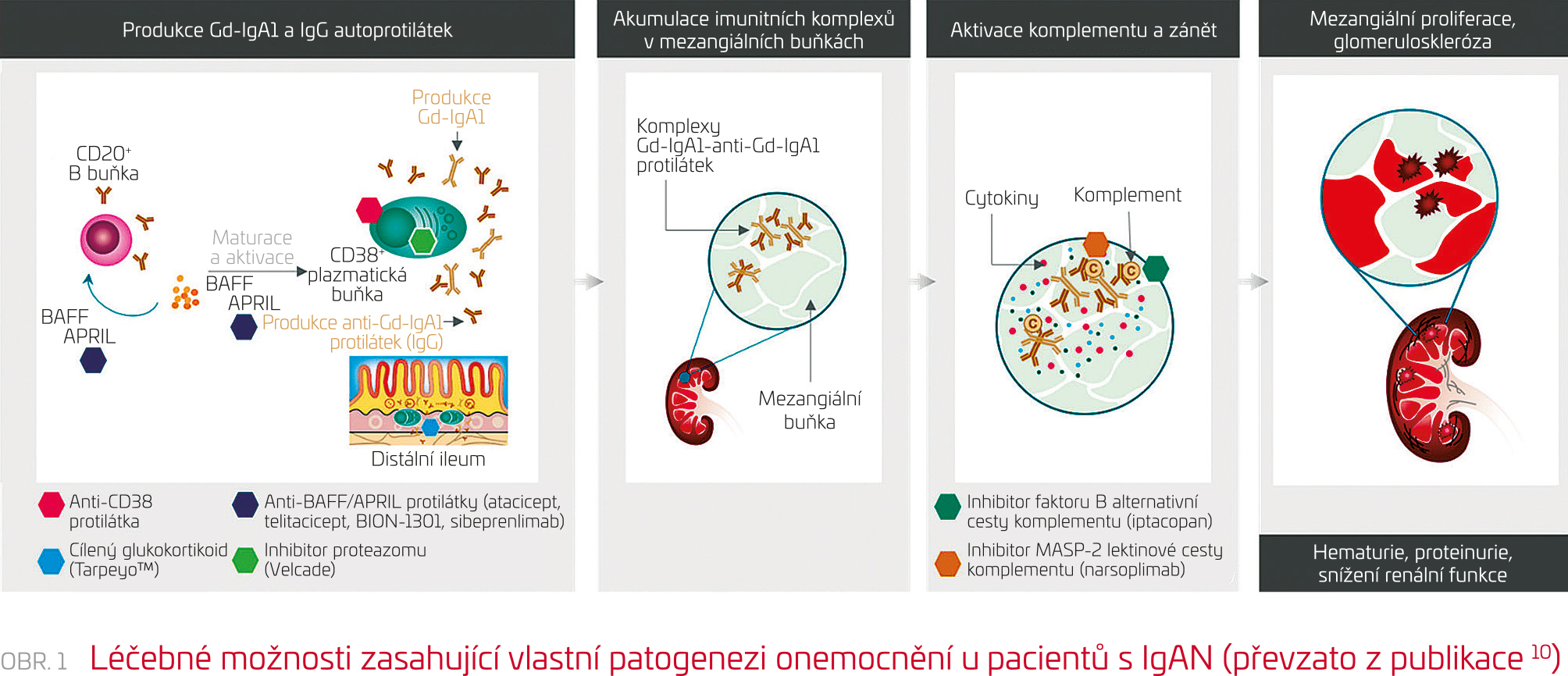
Za normálních podmínek hrají B buňky a plazmatické buňky důležitou úlohu v tvorbě protilátek, které pomáhají ochránit organismus před infekcí. U autoimunitních onemocnění včetně IgAN se tyto stejné buňky mohou aktivovat a přispívat ke vzniku onemocnění tvorbou autoprotilátek (obr. 1).9,10 Při vzniku a progresi IgAN hrají zásadní roli plazmatické buňky, které jsou hlavním zdrojem Gd‑IgA1 a anti‑Gd‑IgA1 protilátek.11 Několik studií potvrdilo zvýšenou tvorbu Gd‑IgA1 z plazmatických buněk ve střevní sliznici.12,13
U pacientů s IgAN bylo potvrzeno vyšší procento CD38+ plazmatických buněk než u zdravých kontrol.14 Zvýšené koncentrace cytokinů BAFF a APRIL jsou spojeny s proliferací, aktivací a dlouhodobým udržováním tvorby protilátek a autoprotilátek produkovaných plazmatickými buňkami u IgAN.15 Na rozdíl od B buněk jsou plazmatické buňky charakterizovány zvýšenou povrchovou expresí CD38 a ztrátou CD20,11 což je pravděpodobně důvod, proč anti‑CD20 protilátky jako rituximab jsou schopny deplece B buněk, ale selhávají při eliminaci plazmatických buněk s následnou tvorbou Gd‑IgA1 nebo protilátek anti‑Gd‑IgA1.16 Randomizovaná studie s rituximabem neprokázala efekt u pacientů s IgAN ve srovnání se standardní léčbou.16
Nové léčebné směry mají za cíl snížit tvorbu imunitních komplexů a jejich ukládání v ledvinách ovlivněním tvorby Gd‑IgA1 a anti‑Gd‑IgA1 protilátek. S aktivací a dlouhodobým udržováním tvorby protilátek i autoprotilátek produkovaných plazmatickými buňkami u IgAN jsou spojeny zvýšené koncentrace cytokinů, z rodiny tumor nekrotizujícího faktoru, BAFF a APRIL.15
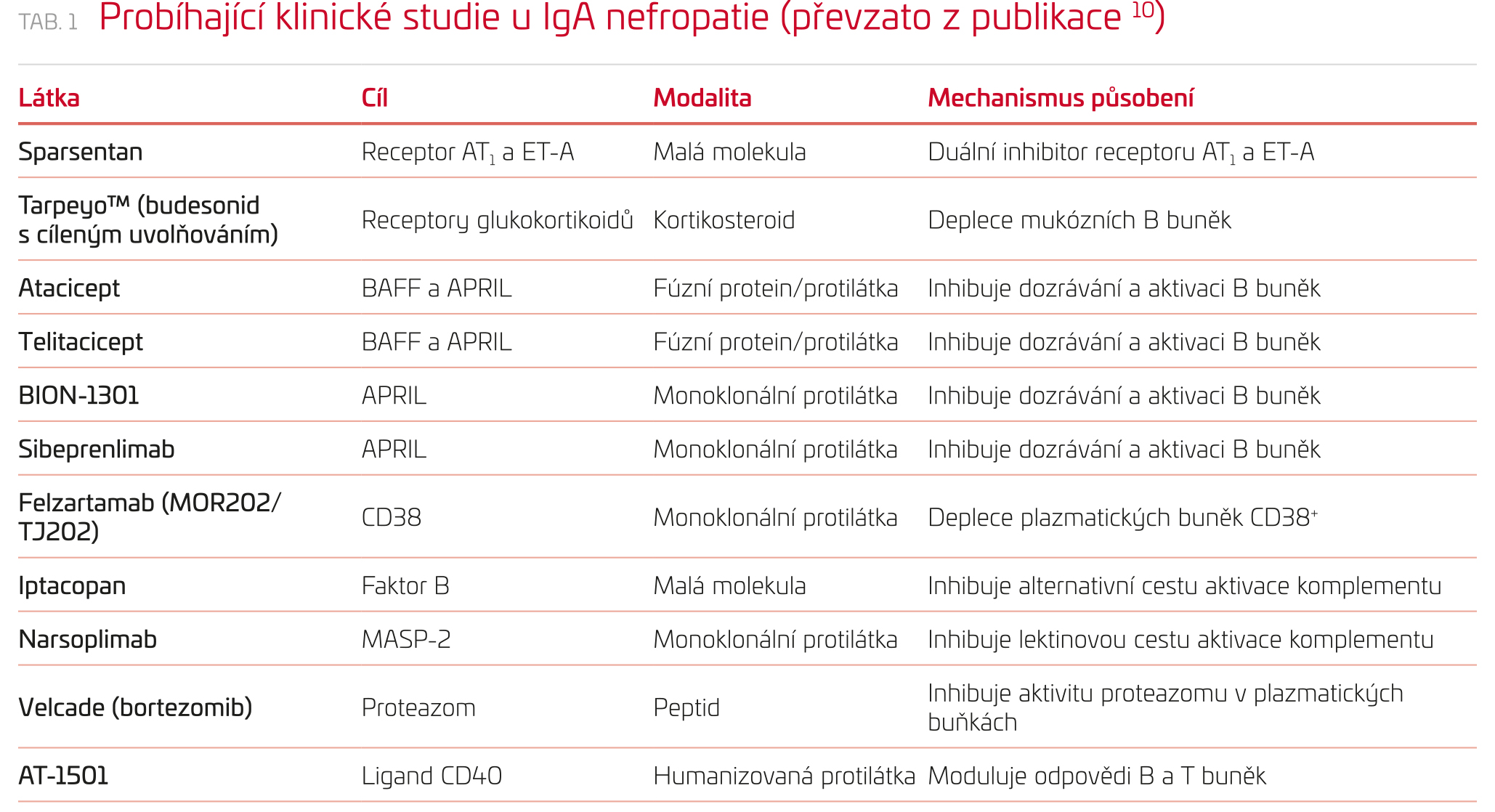
BAFF a APRIL aktivují cestu NF‑kB navázáním na několik povrchových buněčných receptorů včetně transmembránového aktivátoru a kalciového modulátoru i cyklofilin ligandového interaktoru (TACI), který podporuje přežívání plazmatických buněk a stimuluje tvorbu IgG protilátek.17 U pacientů s IgAN byla prokázána zvýšená exprese cytokinu APRIL, která korelovala i se zvýšenou expresí Gd‑IgA1 protilátek.17 Ovlivněním cytokinu APRIL tak lze omezit i tvorbu protilátek, což dokazují výsledky z klinické studie fáze 1/2 (NCT03945318) s BION‑1301 (Chinook Therapeutics), anti‑APRIL monoklonální protilátkou, která u 40 pacientů s IgAN ukázala přetrvávající snížení koncentrací Gd‑IgA1 protilátek i proteinurie.18 Podobně klinická studie fáze 2 (NCT02808429) s ataciceptem (Vera Therapeutics), solubilním TACI‑Ig fúzním proteinem inhibujícím BAFF i APRIL, ukázala snížení koncentrací Gd‑IgA1 protilátek a proteinurie u 16 pacientů s IgAN.19 V současné době probíhá studie fáze 2b u pacientů s IgAN (ORIGIN; NCT04716231).20 Další studie fáze 2 s telitaciceptem (RemeGen), solubilním TACI‑Ig fúzním proteinem, ukázala u 44 pacientů s IgAN snížení proteinurie (NCT04905212).21,22 Podobně sibeprenlimab, protilátka proti cytokinu APRIL (VIS649, Visterra/Otsuka), je hodnocen v klinické studii fáze 2 (NCT04287985).23,24 Výše uvedené výsledky podporují inhibitory cytokinů BAFF a APRIL v léčbě IgAN, nicméně další studie musejí odhalit širší vliv na imunogenicitu v případě omezení B buněk i plazmatických buněk.
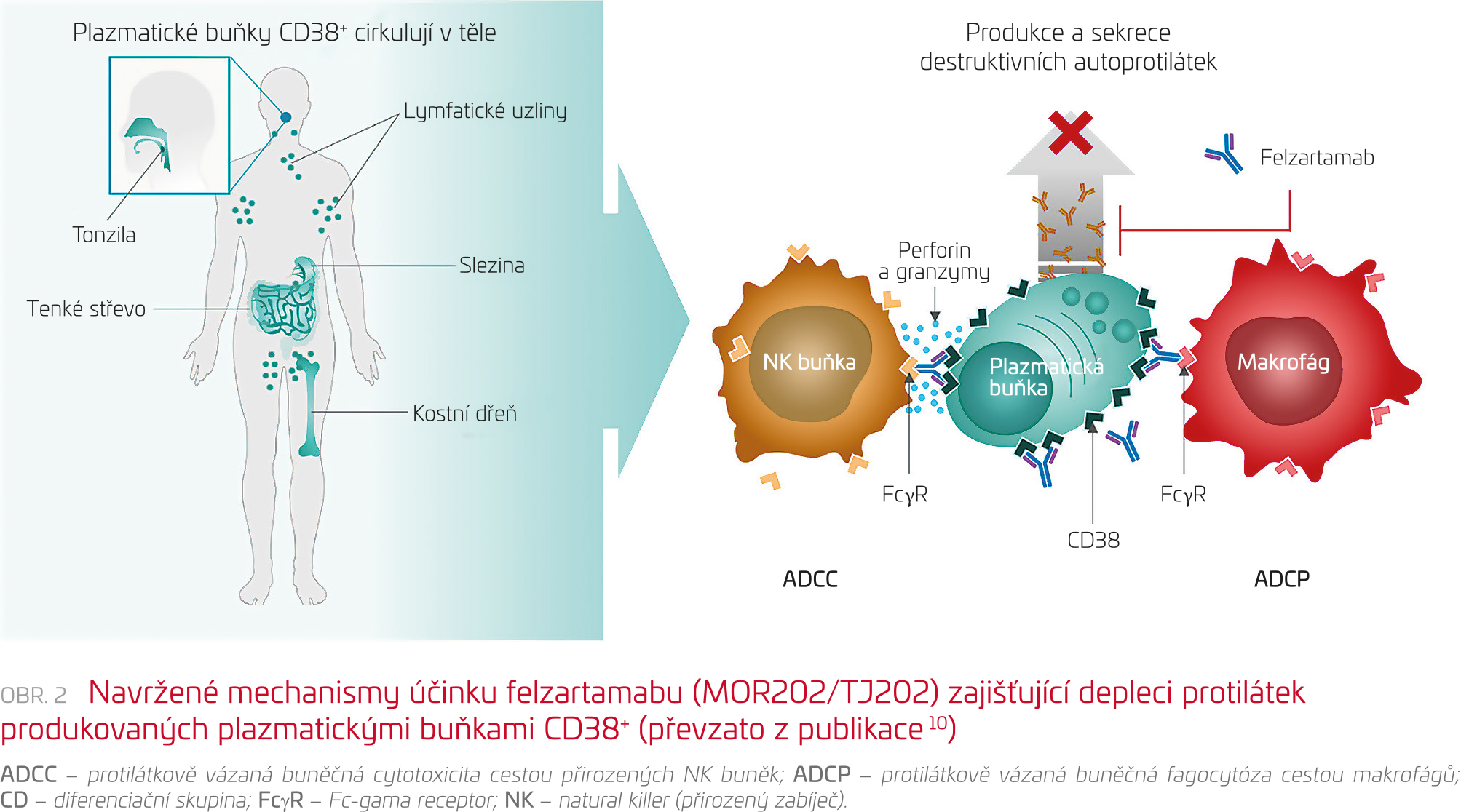
Zasažení na více úrovních patogeneze IgAN a ovlivnění plazmatických buněk vytvářejících autoprotilátky s možným snížením nejenom Gd‑IgA1, ale i protilátek anti‑Gd‑IgA1 by mohlo významně přispět ke zlepšení prognózy pacientů. V klinické studii fáze 2 u pacientů s IgAN (IGNAZ, NCT05065970) je studován felzartamab (MOR202/TJ202, MorphoSys), plně lidský imunoglobulin G1 (IgG1), monoklonální protilátka proti CD38 povrchovému antigenu na plazmatických buňkách. Navázáním felzartamabu na CD38+/CD20– plazmatické buňky se předpokládá zničení buňky mechanismem ADCC (protilátkově vázaná buněčná cytotoxicita cestou přirozených NK buněk) a ADCP (protilátkově vázaná buněčná fagocytóza cestou makrofágů) (obr. 2).
V patogenezi IgAN se uplatňuje aktivace jak alternativní, tak lektinové cesty komplementu vedoucí k poškození glomerulů, proto nyní probíhá několik studií zaměřených na inhibitory komplementu (tabulka 1, obr. 1). Iptacopan (LNP 023, Novartis) je inhibitor faktoru B alternativní cesty komplementu, který je studován u dospělých pacientů s IgAN.25,26 Výsledky z klinické studie fáze 2 (NCT03373461) ukázaly významné snížení proteinurie. Ve studii bylo randomizováno 112 pacientů s IgAN do tří větví s iptacopanem a do placebové větve. Výsledky ukázaly, že nejvyšší dávka iptacopanu (200 mg dvakrát denně) snížila proteinurii (protein: creatinine ratio, UPCR) za šest měsíců až o 40 % ve srovnání s placebem.27 Na základě těchto povzbudivých dat probíhá v současné době klinická studie APPLAUSE‑IgAN fáze 3 (NCT04578834).
Podobně narsoplimab (OMS721, Omeros) je lidská monoklonální protilátka inhibující mannan‑binding lectin‑associated serine protease‑2 (MASP‑2) lektinové cesty komplementu.28 Tříleté sledování u 12 vysoce rizikových pacientů s pokročilou IgAN léčených narsoplimabem potvrdilo významné snížení mediánu proteinurie o 64 % a dlouhodobé zlepšení nebo stabilizaci eGFR.29 V současné době probíhá klinická studie fáze 3 (NCT03608033). Iptacopan a narsoplimab zasahují na úrovni alternativní i lektinové cesty komplementu a neovlivňují terminální cestu komplementu, a nenaruší tak obranu organismu před infekčními patogeny.30,31
Nejčastější primární glomerulonefritida IgA nefropatie vede u 30–50 % nemocných k nezvratnému selhání ledvin. Nové léčebné možnosti v rámci probíhajících klinických studií jsou zaměřeny více na vlastní patogenezi onemocnění. Inhibitory komplementu ovlivňující plazmatické buňky a tvorbou imunitních komplexů mohou pomoci zlepšit funkci ledvin ovlivněním chronického zánětu, zároveň ale neutlumí pokračující tvorbu patogenních autoprotilátek. Zasažení B buněk a plazmatických buněk cestou inhibice aktivátorů BAFF a APRIL je nadějným příslibem snížení tvorby protilátek proti Gd‑IgA1. Klinické studie s BION‑1301, ataciceptem a telitaciceptem, které ovlivňují APRIL i BAFF, poukazují na možnost snížení hodnot protilátek i proteinurie. Novou možností v léčbě IgAN je pomalu uvolňovaná forma budesonidu (Tarpeyo™), jenž působí lokálně na imunitní buňky ve střevní sliznici a snižuje tvorbu Gd‑IgA1, ale neovlivňuje buňky tvořící Gd‑IgA1 v tonzilách a v NALT. Ovlivnění plazmatických buněk vyskytujících se téměř ve všech sliznicích těla by mohlo vést ještě k významnějšímu snížení hodnoty cirkulujících patogenních protilátek a imunitních komplexů. Uvidíme, zda se i v klinických studiích potvrdí efekt felzartamabu, anti‑CD38 protilátky zasahující cíleně CD38 pozitivní plazmatické buňky, a současně zajistí imunitní ochranu pomocí CD38 negativních B buněk.
Literatura
- Travere Therapeutics, Inc. A Randomized, Multicenter, Double‑Blind, Parallel‑Group, Active‑Control Study of the Efficacy and Safety of Sparsentan for the Treatment of Immunoglobulin A Nephropathy; clinicaltrials.gov, 2021.
- Wheeler DC, Toto RD, Stefánsson BV, et al. A Pre‑Specified Analysis of the DAPA‑CKD Trial Demonstrates the Effects of Dapagliflozin on Major Adverse Kidney Events in Patients with IgA Nephropathy. Kidney Int 2021;100:215–224.
- Lanzillotta M, Della‑Torre E, Milani R, et al. Increase of Circulating Memory B Cells after Glucocorticoid‑Induced Remission Identifies Patients at Risk of IgG4‑Related Disease Relapse. Arthritis Res Ther 2018;20:222.
- Floege J. Mucosal Corticosteroid Therapy of IgA Nephropathy. Kidney Int 2017;92:278–280.
- Coppo R, Mariat C. Systemic Corticosteroids and Mucosal‑Associated Lymphoid Tissue‑Targeted Therapy in Immunoglobulin A Nephropathy: Insight from the NEFIGAN Study. Nephrol Dial Transplant 2020;35:1291–1294.
- Fellström BC, Barratt J, Cook H, et al. Targeted‑Release Budesonide versus Placebo in Patients with IgA Nephropathy (NEFIGAN): A Double‑Blind, Randomised, Placebo‑Controlled Phase 2b Trial. Lancet 2017;389:2117–2127.
- Barratt J, Stone A, Kristensen J. POS‑830 NEFECON for the Treatment of IgA Nephropathy in Patients at Risk of Progressing to End‑Stage Renal Disease: The NEFIgArd Phase 3 Trial Results. Kidney Int Rep 2021;6:S361.
- Calliditas Therapeutics AB NCT03643965: A Randomized, Double‑Blind, Placebo Controlled Study to Evaluate Efficacy and Safety of Nefecon in Patients With Primary IgA (Immunoglobulin A) Nephropathy at Risk of Progressing to End‑Stage Renal Disease (NefIgArd); clinicaltrials.gov, 2021.
- Piedra‑Quintero ZL, Wilson Z, Nava P, Guerau‑de‑Arellano M. CD38: An Immunomodulatory Molecule in Inflammation and Autoimmunity. Front Immunol 2020;11:597959.
- Maixnerova D, El Mehdi D, Rizk DV, et al. New Treatment Strategies for IgA Nephropathy: Targeting Plasma Cells as the Main Source of Pathogenic Antibodies. J Clin Med 2022;11:2810.
- Khodadadi L, Cheng Q, Radbruch A, Hiepe F. The Maintenance of Memory Plasma Cells. Front Immunol 2019;10:721.
- He JW, Zhou XJ, Lv JC, Zhang H. Perspectives on How Mucosal Immune Responses, Infections and Gut Microbiome Shape IgA Nephropathy and Future Therapies. Theranostics 2020;10:11462–11478.
- Chang S, Li XK. The Role of Immune Modulation in Pathogenesis of IgA Nephropathy. Front Med (Lausanne) 2020;7:92.
- Wang YY, Zhang L, Zhao PW, et al. Functional Implications of Regulatory B Cells in Human IgA Nephropathy. Scand J Immunol 2014;79:51–60.
- Li W, Peng X, Liu Y, et al. TLR9 and BAFF: Their Expression in Patients with IgA Nephropathy. Mol Med Rep 2014;10:1469–1474.
- Lafayette RA, Canetta PA, Rovin BH, et al. A Randomized, Controlled Trial of Rituximab in IgA Nephropathy with Proteinuria and Renal Dysfunction. J Am Soc Nephrol 2017;28:1306–1313.
- Zhai YL, Zhu L, Shi SF, et al. Increased APRIL Expression Induces IgA1 Aberrant Glycosylation in IgA Nephropathy. Medicine (Baltimore) 2016;95:e3099.
- Barratt J, Hour BT, Schwartz BS, et al. Pharmacodynamic and Clinical Responses to BION‑1301 in Patients with IgA Nephropathy: Initial Results of a Ph1/2 Trial. Presented at the ASN Kidney Week 2021, Virtual, 2021.
- Barratt J, Tumlin JA, Suzuki Y, et al. 24‑Week Interim Analysis of a Randomized, Double‑Blind, Placebo‑Controlled Phase 2 Study of Atacicept in Patients with IgA Nephropathy and Persistent Proteinuria. Presented at the ASN Kidney Week 2020, Virtual, 2020.
- Vera Therapeutics, Inc. NCT04716231: A Phase IIb Randomized, Double‑Blinded, Placebo‑Controlled, Dose‑Ranging Study to Evaluate the Efficacy and Safety of Atacicept in Subjects With IgA Nephropathy (IGAN); clinicaltrials.gov, 2022.
- Lv J, Liu LJ, Hao CM, et al. A Phase 2, Randomized, Double‑Blind, Placebo‑Controlled Trial of Telitacicept in Patients with IgA Nephropathy and Persistent Proteinuria. Presented at the ASN Kidney Week 2021, Virtual, 2021.
- RemeGen Co., Ltd. NCT04905212: A Phase 2, Randomized, Double‑Blind, Multicenter Study of Telitacicept for Injection (RC18) in Subjects With IgA Nephropathy; clinicaltrials.gov, 2022.
- Mathur M, Barratt J, Suzuki Y, et al. Safety, Tolerability, Pharmacokinetics, and Pharmacodynamics of VIS649 (Sibeprenlimab), an APRIL‑Neutralizing IgG2 Monoclonal Antibody, in Healthy Volunteers. Kidney Int Rep 2022;7:993–1003.
- Visterra NCT04287985: Safety and Efficacy Study of VIS649 for IgA Nephropathy – Full Text View – ClinicalTrials.Gov. https://www.clinicaltrials.gov/ct2/show/NCT04287985?term=nct04287985&draw=2&rank=1. Navštíveno 22. 3. 2022.
- Barratt J. Interim Analysis of a Phase 2 Dose Ranging Study to Investigate the Effect and Safety of Iptacopan in Primary IGA Nephropathy. https://era‑edta.conference2web.com/#!resources/interim‑analysis‑of‑a‑phase‑2‑dose‑ranging‑study‑to‑investigate‑the‑efficacy‑and‑safety‑of‑iptacopan‑in‑primary‑iga‑nephropathy‑20ec3f83‑fd34‑441e‑8745‑44587bda74da. Navštíveno 22. 3. 2022.
- Novartis Announces Iptacopan Met Phase II Study Primary Endpoint in Rare Kidney Disease IgA Nephropathy (IgAN). https://www.novartis.com/news/media‑releases/novartis‑announces‑iptacopan‑met‑phase‑ii‑study‑primary‑endpoint‑rare‑kidney‑disease‑iga‑nephropathy‑igan. Navštíveno 15. 3. 2022.
- Barratt J, Rovin B, Zhang H, et al. POS‑546 efficacy and safety of iptacopan in IgA nephropathy: results of a randomized double‑blind placebo‑controlled phase 2 study at 6 months. Kidney Int Rep 2022;7:S236.
- Lafayette RA, Rovin BH, Reich HN, et al. Safety, Tolerability and Efficacy of Narsoplimab, a Novel MASP‑2 Inhibitor for the Treatment of IgA Nephropathy. Kidney Int Rep 2020;5:2032–2041.
- Wire B. Omeros Announces Results From Nearly Three‑Year Follow‑up of Patients in Phase 2 IgA Nephropathy Trial. https://www.benzinga.com/node/23920855. Navštíveno 15. 3. 2022.
- Schubart A, Anderson K, Mainolfi N, et al. Small‑Molecule Factor B Inhibitor for the Treatment of Complement‑Mediated Diseases. Proc Natl Acad Sci U.S.A. 2019;116:7926–7931.
- Rambaldi A, Gritti G, Micò MC, et al. Endothelial Injury and Thrombotic Microangiopathy in COVID‑19: Treatment with the Lectin‑Pathway Inhibitor Narsoplimab. Immunobiology 2020;225:152001.
- Kategorie: Přehledové články
- Klíčová slova: B buňky; budesonid; IgA nefropatie; plazmatické buňky; proteinurie; renální insuficience