Atypická forma Whippleovy choroby u pacienta po transplantaci ledviny
Kazuistika
Třiačtyřicetiletý pacient s chronickým onemocněním ledvin na podkladě primární fokálně segmentální glomerulosklerózy (FSGS), již téměř 20 let po transplantaci ledviny od kadaverózního dárce, byl nyní přijat k hospitalizaci na naše pracoviště k objasnění etiologie oboustranných plicních infiltrátů.
V posledním roce dochází k postupné progresi dysfunkce štěpu s koncentracemi kreatininu v séru v rozmezí 300–350 μmol/l. Recentní bioptický nález ukazuje chronické změny bez průkazu aktivního rejekčního procesu v terénu pokročilé fibrózy (grade II/III dle Banffské klasifikace). S myšlenkou znovuzařazení pacienta na čekací listinu k preemptivní retransplantaci byl zahájen zvyklý vyšetřovací algoritmus. V rámci vyšetřování je patrná stacionární elevace zánětlivých parametrů (prokalcitonin [PCT] 0,6 μg/l, C‑reaktivní protein [CRP] 30–50 mg/l). Pacient je však prost jakékoliv orgánově specifické symptomatologie či nespecifického projevu. Na provedeném rentgenu plic čtyři měsíce před admisí je však nově patrné zastření/ložisko nejasné povahy v oblasti průběhu VII. a VIII. žebra vpravo. Pro perzistující laboratorní inflamatorní aktivitu nejasné povahy a nově zjištěný plicní nález je indikováno vyšetření pozitronovou emisní tomografií/výpočetní tomografií (PET/CT) trupu, které ukazuje vícečetné neostře ohraničené plicní infiltráty oboustranně s dominantně periferní distribucí bez významné akumulace fluorodeoxyglukózy (FDG). Vedlejším nálezem je pak vyšší akumulace FDG v prosáklé stěně pyloru s podezřením na zánětlivé změny. S odstupem jednoho měsíce byla provedena kontrola výpočetní tomografií s vysokým rozlišením (HRCT) popisovaných plicních infiltrátů, které viditelně dál v počtu a velikosti progredují ve všech plicních segmentech oboustranně (obr. 1 a 2). Ze zobrazovacích vyšetření lze usuzovat spíše na oportunní infekční etiologii nežli na drobné alveolární hemoragie. Diferenciální diagnostika plicního procesu byla zahájena za hospitalizace.
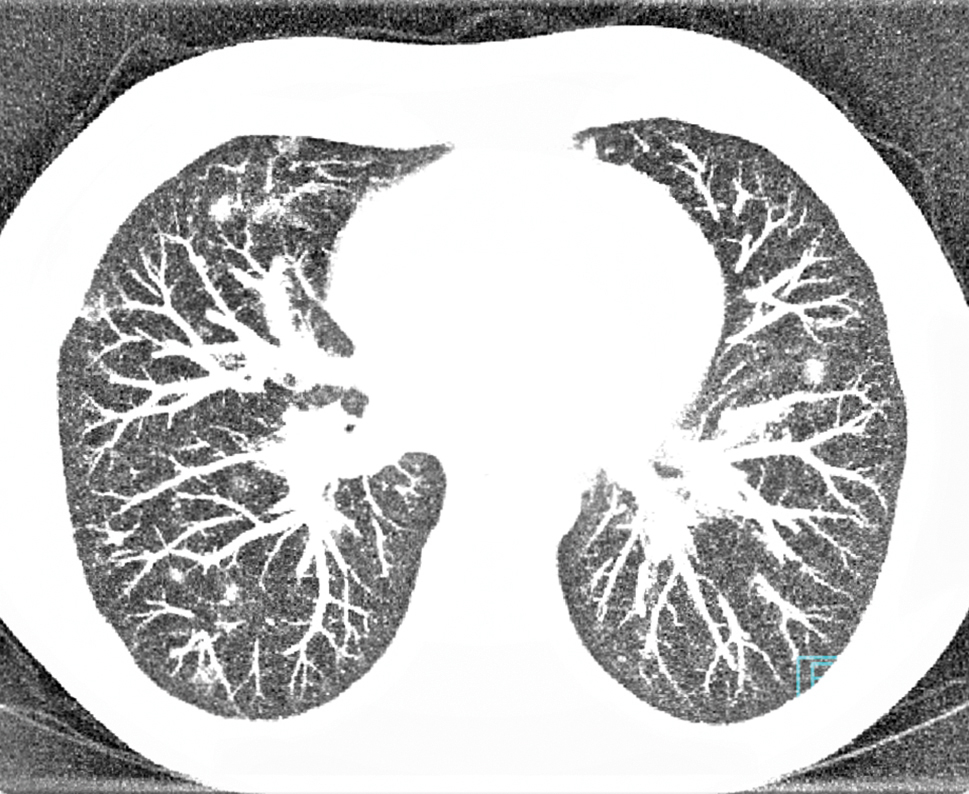
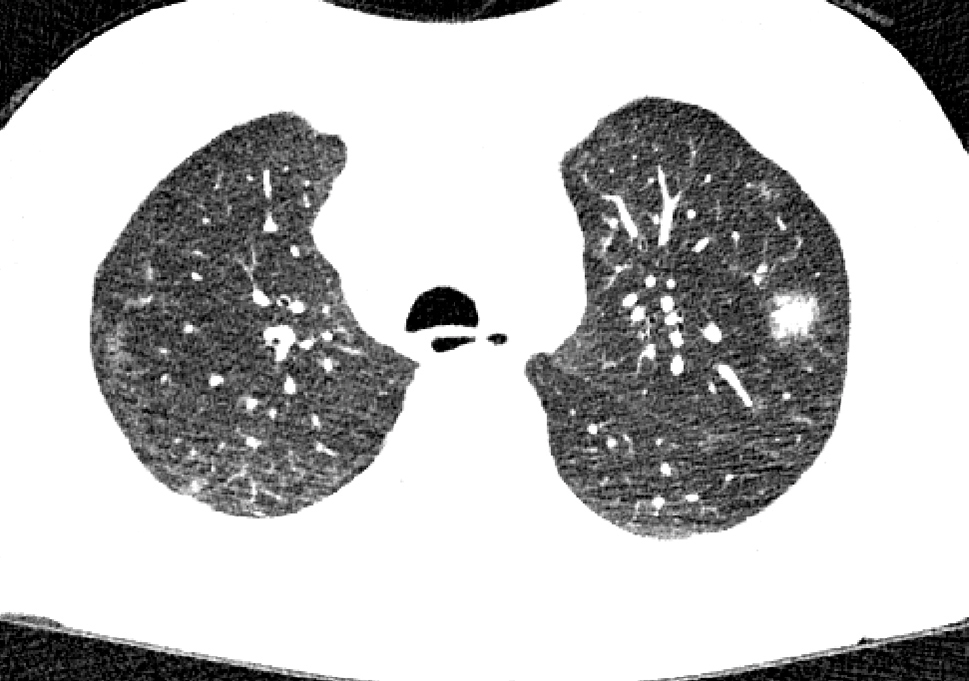
OBR. 1 A 2 HRCT plic. Oboustranné vícečetné neostře ohraničené zánětlivé infiltráty v plicním parenchymu s dominantně periferní distribucí při m. Whipple.
HRCT – výpočetní tomografie s vysokým rozlišením.
V tomto čase dochází k další progresi dysfunkce štěpu s konsekvencemi, které nutí k zahájení pravidelných dialyzačních procedur. S ohledem na plicní léze (ač pro alveolární hemoragie či granulomatózu s polyangiitidou [GPA] nejsou zcela typické) a nedávnou progresi renální dysfunkce (akutní poškození ledvin, AKI) pomýšleno i na imunologickou problematiku, která byla ale následně vyloučena. Přistupujeme tedy k bronchoskopii s bronchoalveolární laváží (BAL) s následným širokým mikrobiologickým rozborem. Z laváže jsme obdrželi dva pozitivní PCR výsledky, kdy jedním z nich je cytomegalovirus (CMV) a druhým grampozitivní aktinomyceta Tropheryma whipplei. Diagnostická kritéria Whippleovy choroby dále doplňuje PAS (periodic acid‑Schiff) – pozitivita makrofágů v mikroskopii z odebraného materiálu. Provedená enterobiopsie neprokazuje histopatologické či molekulárně genetické známky přítomnosti infekce T. whipplei (viz PET/CT nález v oblasti pyloru). Zahajujeme tedy iniciální intravenózní antibiotickou (ATB) terapii (ceftriaxon 2 g/den) po dobu 14 dní za hospitalizace s následnou dlouhodobou udržovací léčbou Biseptolem (480 mg 2krát denně po dobu jednoho roku) dle doporučeného schématu. Pro pozitivitu polymerázové řetězové reakce (PCR) CMV, ačkoliv virovou etiologii zde neuvažujeme jako dominantní, léčíme po obvyklou dobu valganciklovirem. Součástí terapie je také redukce stávající trojkombinační imunosuprese (vysazení antimetabolitu a redukce takrolimu).
V průběhu pravidelných intermitentních dialýz dochází ke kolísavé inflamatorní aktivitě (laboratorní i klinické) spolu s neadekvátní odpovědí anémie na léčbu látkami stimulujícími erytropoézu (erythropoietin‑stimulating agent, ESA). Kontrolní nízkodávkové CT ukazují jen mírnou regresi velikosti ložisek s občasnou tvorbou plicních výpotků, jejichž infekční etiologie je přinejmenším sporná vzhledem k omezené compliance pacienta k dodržování restrikce tekutin s projevy hypervolemie/hyperhydratace v interdialyzačním období. Za těchto okolností, při uvážení možného symptomatického štěpu v rámci redukované léčby imunosupresivy (IS) či perzistující aktivity Whippleovy choroby při pokračující imunosupresi, indikujeme pacienta ke graftektomii s cílem úplně ukončit podávání imunosupresivní terapie.
Po téměř jednom roce udržovací ATB terapie a třech měsících bez imunosupresivní léčby vidíme na HRCT plic rezidua zánětlivých infiltrátů. Znamenají perzistující aktivitu onemocnění? Prodlužujeme léčbu přípravkem Biseptol a současně pravděpodobně směřujeme ke kontrolnímu hybridnímu vyšetření (PET/CT), jehož výpovědní hodnota v posouzení aktivity (akumulace FDG) reziduálních plicních ložisek je však vzhledem k jejich velikosti nejistá. Červený krevní obraz nyní vykazuje dobrou odpověď na léčbu ESA, inflamatorní aktivita osciluje na nízkých hodnotách (CRP 15–30 mg/l). Pacient zůstává aktuálně asymptomatický.
Komentář
Literatura
- Swartz MN. Whipple’s disease – past, present and future. N Engl J Med 2000;342:648–650.
- Lagier JC, Papazian F, Fenollar L, et al. Tropheryma whipplei in bronchoalveolar lavage samples: a case control study. Clin Microbiol Infect 2016;22:875–879.
- Schneider T, Moos V, Loddenkemper C, et al. Whipple’s disease: new aspects of pathogenesis and treatment. Lancet Infect Dis 2008;8:179–190.
- Dulty F, Altwegg M. Whipple’s disease and „Tropheryma whipplei“. Clin Microbiol Rev 2001;14:561–583.
- Ehrbar HU, Bauerfeind P, Dutly F, et al. PCR‑positive tests for Tropheryma whipplei in patients without Whipple disease. Lancet 1999;353:2214.
- Feurle GE, Junga NS, Marth T. Efficacy of ceftriaxon or meropenem as initial therapies in Whipple’s disease. Gastroenterology 2010;138:478–486.
- Kategorie: Kazuistiky
- Klíčová slova: akutní poškození ledvin; imunosuprese; infekce; transplantace ledvin; Whippleova nemoc
Whippleova nemoc je vzácné infekční onemocnění způsobené pomalu rostoucí aktinomycetou T. whipplei, která je běžně přítomna v životním prostředí, zvláště pak v odpadní vodě a kanalizacích. U pracovníků kanalizací je T. whipplei často detekovatelná ve stolici, nicméně zřídkakdy jim působí klinické potíže. Předpokládá se genetická dispozice, která umožňuje masivní intestinální kolonizaci, rozšíření do dalších míst infekce, kde lze doložit velkou kumulaci T. whipplei s minimální zánětlivou reakcí, ale naopak se zvýšeným zastoupením regulačních T lymfocytů. Klasická Whippleova nemoc je multisystémové onemocnění typicky se čtyřmi hlavními symptomy: artralgiemi, chronickým průjmem, ztrátou hmotnosti (resp. obrazem malabsorpce) a bolestmi břicha. Postižena však může být řada dalších orgánů, z nichž je třeba zdůraznit infekci centrálního nervového systému (CNS) s projevy progresivní demence a endokarditidu. U našeho pacienta bylo dominantní plicní postižení, které je u Whippleovy nemoci vzácné a u pacientů po transplantaci ledviny lze v literatuře nalézt jediný popsaný případ.
Diagnostika Whippleovy nemoci je při nespecifické symptomatologii obtížná a sama o sobě přispívá k podhodnocení skutečného výskytu této jednotky. V současné době je situace příznivější vzhledem k možnosti využít molekulárně diagnostických metod k detekci T. whipplei. Při klasických symptomech je správným postupem v první fázi vyloučit jiné nemoci charakterizované kloubní symptomatologií, chronickými průjmy, malabsorpcí a hubnutím, jako jsou především idiopatické střevní záněty, jiné střevní infekce, nemoci pojiva a pokročilá HIV infekce. Po vyloučení ostatních příčin je pro diagnózu Whippleovy nemoci kritická endoskopie horního trávicího traktu s enterobiopsií, kde může diagnózu potvrdit pozitivní PAS barvení makrofágů. Vysokou senzitivitu pak má PCR testování z bioptického vzorku. V případě atypické symptomatologie s absencí gastrointestinálních projevů, jako tomu bylo u našeho pacienta, je nezbytná PCR diagnostika materiálu (BAL, likvor atd.). Samotná ATB léčba je rozdělena do dvou fází: iniciální dvoutýdenní fáze s intravenózní aplikací ATB s předpokládanou dobrou in vitro citlivostí optimálně pronikající hematoencefalickou bariéru vzhledem k častému asymptomatickému postižení CNS. Tato kritéria splňuje ceftriaxon nebo krystalický penicilin, při alergii je alternativou meropenem. Následná udržovací fáze většinou zahrnuje trimethoprim‑sulfamethoxazol podávaný v perorální formě po dobu jednoho roku. Ve většině případů vede léčba k dramatickému zmírnění symptomů v průběhu jednoho až tří týdnů.
Prezentovaná kazuistika poukazuje na běžnou problematiku nemocných po orgánových transplantacích, kdy řada infekcí probíhá atypicky, nacházíme neobvyklé oportunní patogeny a diagnostické postupy musejí zahrnovat komplexní zobrazovací metody, invazivní vyšetřovací postupy a specializovanou mikrobiologickou diagnostiku včetně molekulárně diagnostických metod.