Aferetické metody
Souhrn
Aferetické techniky jsou používány s cílem odstranit patologické komponenty z plazmy pacienta. Liší se podle způsobu separace plazmy, způsobu odstranění jednotlivých komponent a typu molekul, které odstraňujeme, popřípadě podle substituce plazmy, pokud je potřeba. V nefrologii a transplantační medicíně se jedná o plazmaferézy, výměny plazmy, lipidové aferézy, imunoadsorpce, kaskádovou filtraci a extrakorporální fotoferézu. V současnosti jde o plně etablované metody používané v rámci léčebných protokolů.
Klíčová slova: aferéza – extrakorporální fotoferéza – imunoadsorpce – kaskádová filtrace – lipoproteinová aferéza – plazmaferéza
Terapeutické aferézy (TA) jsou techniky používané k selektivnímu odstranění plazmy, buněk nebo látek z cirkulace pacienta s cílem zlepšit jeho klinický stav. Jednotlivé aferetické techniky se liší na základě komponenty, která je z krve odstraňována, a způsobem, jímž je nahrazena.
Nejstarší zmínky o TA pocházejí z Indie, Egypta a Řecka. V roce 1914 byl pro techniku odstranění plazmy z uremických psů použit termín plazmaferéza (Abel, 1914). První aferetické přístroje byly vyvinuty již ve 30. letech minulého století. Jednalo se o ručně ovládané separátory, jejichž využití však bylo kvůli náročné obsluze nízké.1 K rozmachu terapeutických aferéz došlo o několik dekád později, kolem roku 1980, kdy byly na trh uvedeny první automatizované stroje. Aferézy, jejichž účelem je léčba choroby odstraněním abnormálních krevních buněk nebo toxických plazmatických substancí, jsou známy jako léčebné plazmaferézy, výměny plazmy a cytaferézy.2
Základní techniky aferéz jsou založeny na třech základních separačních metodách krevních komponent: centrifugaci, membránové filtraci a adsorpci proteinů nebo buněk, a to buď z plné krve, nebo z již separované plazmy. Při centrifugaci dochází k oddělení plazmy od buněčných elementů odstředivou silou podle molekulové hmotnosti a hustoty, při membránové filtraci jsou látky separovány na základě velikosti molekul.3 Podle následného způsobu zpracování a substituce plazmy rozlišujeme výměnu plazmy (plasma exchange, PE), plazmaferézu (PF), lipidové aferézy (LA), imunoadsorpci (IA), kaskádovou filtraci. K aferetickým metodám používaným v nefrologii a transplantologii ještě řadíme extrakorporální fotoferézu (EP).
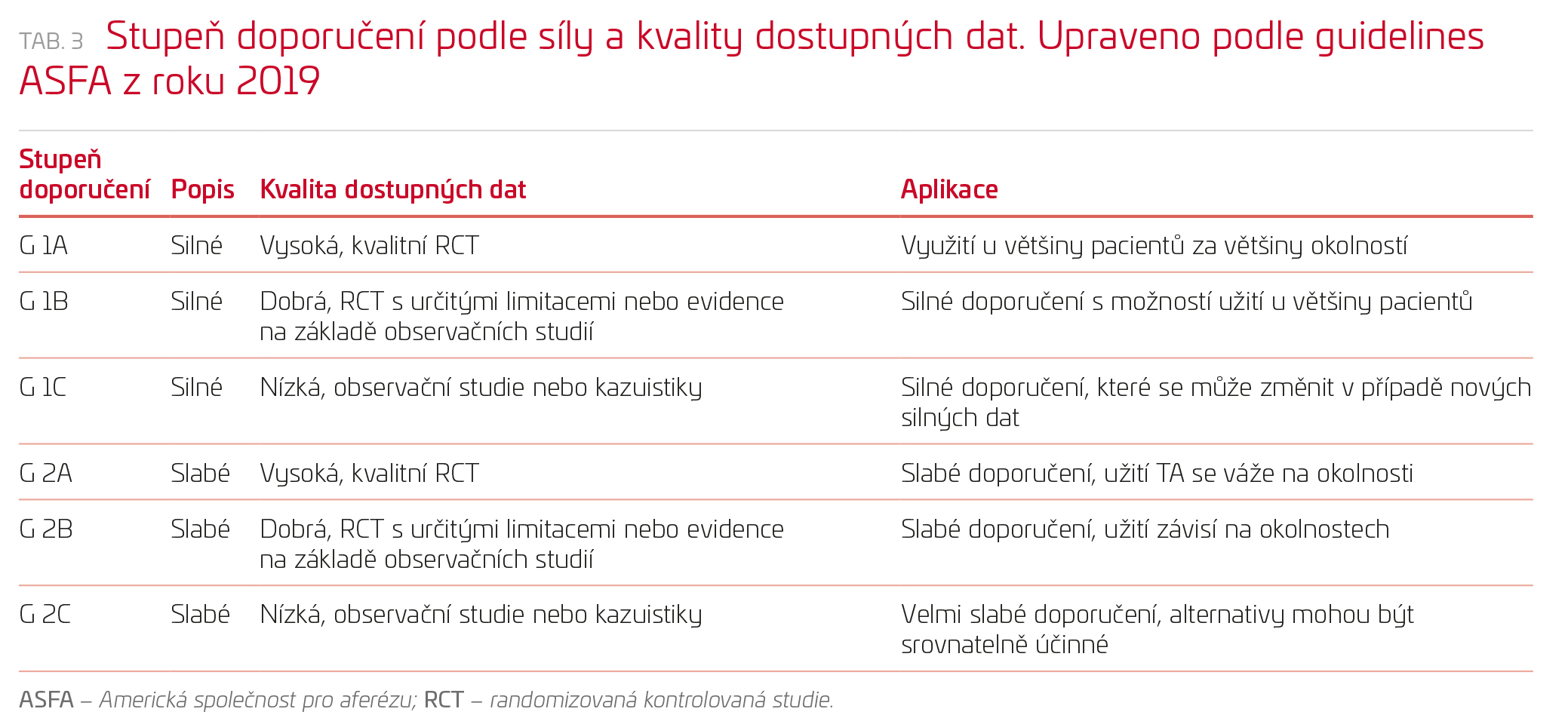
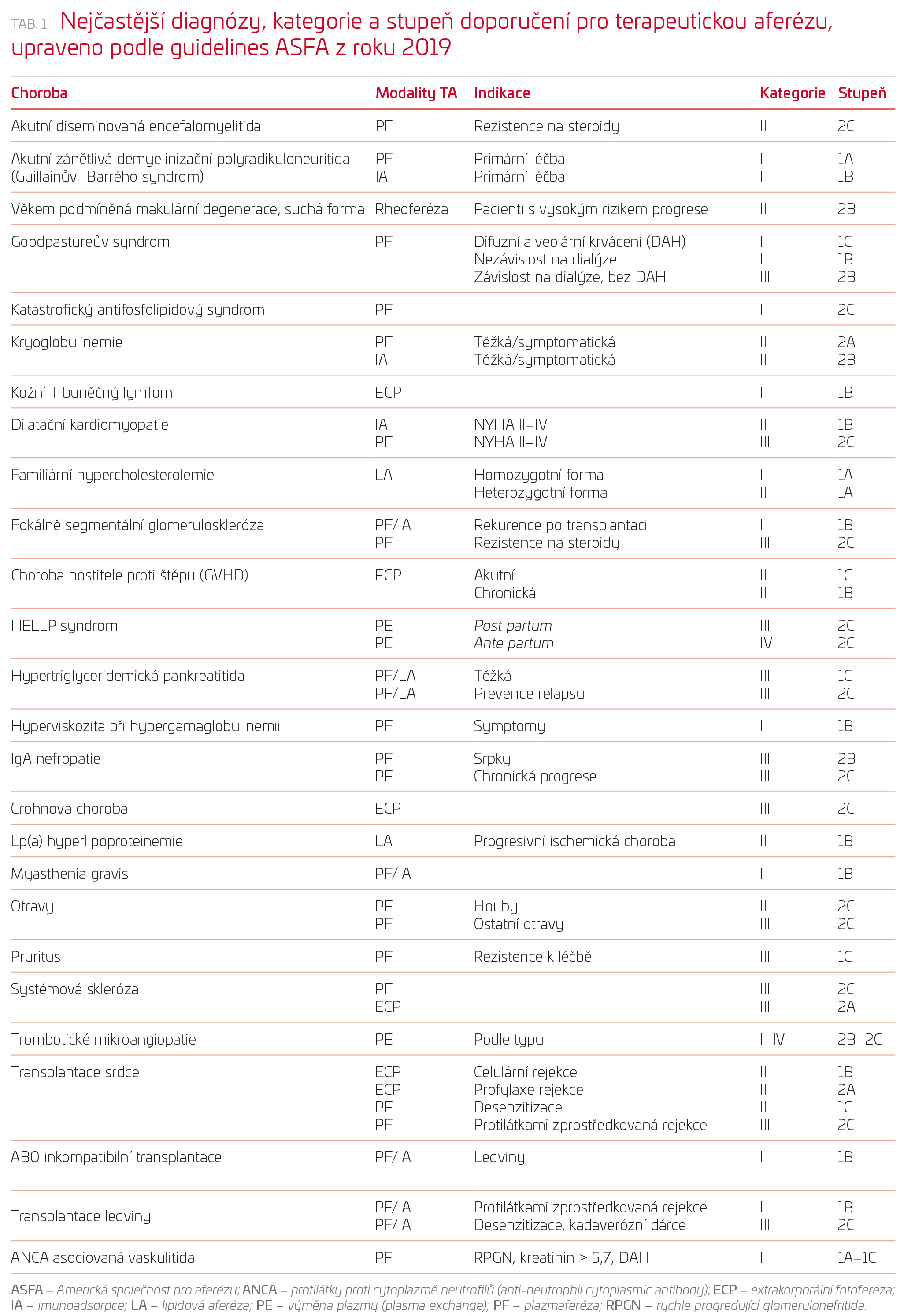
V tabulce 1 jsou uvedena doporučení týkající se indikací aferetických metod podle Americké společnosti pro aferézu (ASFA) z roku 2019, jež jsou platná v současné době. Kategorizace a síla doporučení na základě kvality dostupných dat jsou blíže specifikovány v tabulkách 2 a 3.4
 Terapeutická plazmaferéza nebo výměna plazmy patří mezi nejstarší aferetické techniky. Plazma je oddělena a následně odstraněna s cílem odstranit patogenní materiál z cirkulace pacienta. Při plazmaferéze mohou být eliminovány látky o vysoké molekulové hmotnosti (> 15 000 D), s malým distribučním objemem a malým obratem, jako jsou auto‑ a aloprotilátky, komplexy antigen‑protilátka, imunoglobuliny, paraprotein, endogenní toxiny, exogenní jedy, případně další neidentifikované toxické součásti plazmy.5 Odstraněná plazma je nahrazována plazmou dárce nebo koloidním roztokem s albuminem. Je to neselektivní metoda odstraňující všechny složky přítomné v plazmě. Hlavními faktory ovlivňujícími účinnost jsou filtrační rychlost plazmy a vnitřní charakteristika membránového filtru. Aby nedocházelo ke srážení na separátoru, je filtrační frakce limitována na 30–35 % objemu plazmy. Vnitřní charakteristika membrány je dána velikostí pórů a jejich distribucí. Sieving koeficient (poměr koncentrace velkých molekul mezi filtrátem a krví) je 1 pro proteiny od molekulové hmotnosti blížící se hmotnosti albuminu (67 000) přes kryoglobuliny (900 000) až po B lipoprotein (2 400 000).6 Účinnost je in vivo snižována adhezí látek na filtru během procedury, vysrážením na filtru, adsorpcí proteinů či elektrickým nábojem adsorbovaných proteinů na vnitřních površích filtru.
Terapeutická plazmaferéza nebo výměna plazmy patří mezi nejstarší aferetické techniky. Plazma je oddělena a následně odstraněna s cílem odstranit patogenní materiál z cirkulace pacienta. Při plazmaferéze mohou být eliminovány látky o vysoké molekulové hmotnosti (> 15 000 D), s malým distribučním objemem a malým obratem, jako jsou auto‑ a aloprotilátky, komplexy antigen‑protilátka, imunoglobuliny, paraprotein, endogenní toxiny, exogenní jedy, případně další neidentifikované toxické součásti plazmy.5 Odstraněná plazma je nahrazována plazmou dárce nebo koloidním roztokem s albuminem. Je to neselektivní metoda odstraňující všechny složky přítomné v plazmě. Hlavními faktory ovlivňujícími účinnost jsou filtrační rychlost plazmy a vnitřní charakteristika membránového filtru. Aby nedocházelo ke srážení na separátoru, je filtrační frakce limitována na 30–35 % objemu plazmy. Vnitřní charakteristika membrány je dána velikostí pórů a jejich distribucí. Sieving koeficient (poměr koncentrace velkých molekul mezi filtrátem a krví) je 1 pro proteiny od molekulové hmotnosti blížící se hmotnosti albuminu (67 000) přes kryoglobuliny (900 000) až po B lipoprotein (2 400 000).6 Účinnost je in vivo snižována adhezí látek na filtru během procedury, vysrážením na filtru, adsorpcí proteinů či elektrickým nábojem adsorbovaných proteinů na vnitřních površích filtru.
Mezi hlavní faktory determinující eliminaci na straně odstraňovaných molekul patří distribuční objem, biologický poločas a předpokládaný rebound molekuly do vaskulárního prostoru po ukončení procedury. Během procedury je kontinuálně odstraňováno 65–70 % aktuální koncentrace látky v plazmě, ta však během procedury klesá vlivem nedostatečně rychlého rebound fenoménu a v důsledku diluce plazmy substitučním roztokem. Nelze tedy předpokládat, že navýšením objemu na trojnásobek bude odstraněno třikrát více patologické substance. Během zpracování prvního plazmatického objemu bude koncentrace redukována přibližně o 60–65 %, při dalším objemu už dojde k redukci pouze o 20–25 % a při zpracování třetího objemu už bude koncentrace redukována o méně než 10 %. Pokud je sieving koeficient pro danou látku menší než 1, pak bude účinnost nižší.7 Čisté množství odstraněné látky během plazmaferetické léčby je tedy ovlivněno redistribucí látky z extra‑ do intravaskulárního prostoru, rychlostí syntézy a velikostí distribučního objemu. Je třeba mít na paměti, že pohyb látek je dynamický stav, který se neustále mění v závislosti na okolním prostředí, což ovlivňuje aktuální koncentraci v krvi. Látky se plynule a neustále pohybují mezi intracelulárním, intersticiálním a intravaskulárním prostorem. Biologický poločas látky ovlivňuje rychlost, s jakou stoupá plazmatická koncentrace odstraňované látky po ukončení procedury. U látek s krátkým poločasem bude plazmatická koncentrace stoupat rychle zpět k předplazmaferetickým hodnotám, proto je u těchto pacientů nutná frekventní terapie. Protilátky mají naopak dlouhý biologický poločas. Pokud tedy nebudou odstraňovány, i když jejich tvorba bude imunosupresivní terapií potlačena, hodnoty zůstanou po dlouhou dobu vysoké. Vezmeme‑li v úvahu, že biologický poločas imunoglobulinu M (IgM) je pět dní, obrat činí přibližně 20 %/den. Pokud nedochází k nové produkci, pokles koncentrace IgM je poměrně rychlý. Oproti tomu biologický poločas IgG je 22 dní, obrat je pouhých 7 %/den a pokles koncentrace bude mnohem pomalejší. Další rozdíl mezi imunoglobuliny IgG a IgM je ve velikosti molekuly. IgM protilátky mají velkou molekulu (970 000 D), 90 % se nachází intravaskulárně. Stačí jedna až dvě plazmaferézy, aby jejich koncentrace byla významně redukována, rebound není téměř žádný. Většina autoimunitních onemocnění je vázána na produkci IgG protilátek. Mají molekulu přibližně osmkrát menší než IgM (150 000 D), 30–45 % se nachází extravaskulárně. K dostatečnému odstranění z cirkulace a intersticia je tak potřeba více procedur. K poklesu koncentrace IgG na 20 % vstupní hodnoty představuje předpokládaná potřeba šest procedur.8,9
Většina renálních indikací zahrnuje onemocnění související s tvorbou protilátek třídy IgG. Typickým příkladem onemocnění spojeného s přítomností IgG protilátek a indikovaného k plazmaferetické léčbě je Goodpastureův syndrom. Anti‑GBM protilátky jsou detekovatelné v krvi téměř všech pacientů. Jejich množství významně koreluje se závažností morfologických změn v renální biopsii. Cirkulující anti‑GBM protilátky jsou primárně imunoglobuliny IgG1. Výše jejich koncentrace je považována za nezávislý prediktor úmrtí. Pro indikaci PF pro difuzní alveolární krvácení existuje velmi malá evidence. Nicméně data pro provedení PF k dosažení nezávislosti na dialýze jsou silná, proto doporučení American Society for Apheresis (ASFA) pro časné provedení PF patří do kategorie IA. PF by měly být do léčebného protokolu zahrnuty co nejdříve, než se pacient stane dependentním na dialýze. Tehdy je již glomerulární poškození ireverzibilní. Pokud je imunosupresivní terapie provázena plazmaferézami, titr anti‑GBM protilátek klesá dvojnásobně rychleji než u pacientů, kteří jsou léčeni pouze imunosupresí. Cílem léčby je dosažení nedetekovatelné hodnoty anti‑GBM, tehdy je doporučeno ukončení PF (většinou 10–14 procedur).10,11 Odlišnou indikací je hyperviskózní syndrom, vzácné závažné onemocnění nejčastěji přítomné při Waldenströmově makroglobulinemii spojené s přítomností monoklonálních IgM. Procedura plazmaferézy snižuje hodnotu IgM o více než 40 % s reparací retinopatie asociované s hyperviskozitou. Smíšená kryoglobulinemie je charakterizována přítomností kryoglobulinů o velikosti přibližně 200 kD obsahujících více než jeden typ imunoglobulinu. Nejčastější kryoglobuliny jsou složeny z polyklonálních imunoglobulinů IgG, IgM s revmatoidní aktivitou a IgA. Může se jednat o kryoglobulinemii idiopatickou nebo asociovanou s infekcí nebo malignitou. Základem je léčba základního onemocnění. PF účinně odstraňuje kryoglobuliny, mění poměr antigen/protilátka, čímž napomáhá zvýšit rozpustnost imunitních komplexů. Je indikována u pacientů se středně těžkou až těžkou kryoglobulinemií doprovázenou membranoproliferativní glomerulonefritidou, neuropatií, artralgiemi, ulcerující purpurou.6 K odstranění cirkulujících regulačních komponent komplementu nebo protilátek a zároveň k substituci chybějících inhibičních faktorů komplementu se provádějí výměny plazmy (PE) při trombotických mikroangiopatiích. V transplantační medicíně se PF používají v rámci peritransplantačních protokolů u senzitizovaných pacientů s přítomnými donor specifickými protilátkami s cílem snížit imunologické riziko vývoje rejekce a v rámci desenzitizace u AB0 inkompatibilních transplantací ke snížení titru hemaglutininů proti krevně skupinovému antigenu / skupinovým antigenům dárce. Dále jsou součástí léčby protilátkami zprostředkované rejekce po transplantaci.
Imunoadsorpce (IA) byla vyvinuta v 90. letech minulého století jako metoda zacílená především na eliminaci molekul imunitního systému. V současnosti jsou k dispozici různé druhy kolon lišící se aktivní komponentou a umožňující selektivní odstranění částic podle indikace, ve které je IA použita (imunoglobuliny, cirkulující imunokomplexy, hemaglutininy, lipidy, fibrinogen, endotoxiny, cytokiny).12 Selektivní odstranění molekul bez nutnosti substituce albuminu nebo plazmy je její nespornou výhodou oproti ostatním aferetickým metodám. Základní princip IA je při použití různých adsorbérů stejný. Jde o mimotělní techniku, krev je vedena z řečiště pacienta k plazmatickému separátoru (membránový filtr, centrifuga), poté plazma prochází kolonou, aby byla následně opětovně sloučena s krevními elementy a vrácena zpět pacientovi. Krevní průtok nutný k bezpečnému průběhu procedury je 100–150 ml/min, většinou je prováděna pomocí centrálního žilního katétru nebo arteriovenózní fistule, u pacienta s kvalitním venózním řečištěm mohou být využity i vlastní cévy. Imunoadsorpce je založena na principu afinitní chromatografie, při které dochází k separaci proteinů na základě reverzibilní kovalentní vazby mezi proteinem a aktivním adsorpčním ligandem navázaným na nosič (celulóza, dextran, agaróza). Tak jsou z plazmy vyvázány pouze ty proteiny, které s ligandem tvoří silné vazby, zbytek protéká kolonou beze změny. Po nasycení kolony je kolona promyta elučním pufrem, který uvolní cílové molekuly z afinitního ligandu, dojde k disociaci komplexu ligand‑cílová látka a kolona je připravena k opětovnému použití. Imunoadsorpční kolony jsou většinou vyplněny agarózovým gelem, který slouží jako inaktivní nosič, ve kterém je navázán imunologicky aktivní ligand. Podle typu ligandu rozlišujeme selektivní a semiselektivní imunoadsorpce. Zatímco při plazmaferéze je odstraněno přibližně 60 % imunoglobulinů za současných významných ztrát jiných plazmatických bílkovin, při semiselektivní IA by mělo být odstraněno více než 95 % aktuálně přítomných imunoglobulinů v plazmě. IA ligandem je ovčí antihumánní globulin (Ig ‑TheraSorb®), syntetický Peptid GAM (Globaffin®) nebo stafylokokový protein A (Prosorba®). Ligandy mají silnou vazebnou afinitu k Fc fragmentům imunoglobulinů třídy G 1–4 s nejnižší afinitou pro podtřídu IgG3.12 Rovněž nižší afinita je pro IgM, IgA protilátky v závislosti na typu použitých kolon. Rychlost eliminace IgG závisí na jejich vstupních plazmatických koncentracích a rychlosti přesunu z extravaskulárního prostoru. IgM a IgA bývají redukovány o 30–50 %.13 Míra eliminace IgG3 se u jednotlivých pacientů liší, závisí na hodnotě ostatních podtříd IgG. IgG3 mají oproti ostatním podtřídám vzhledem k větší molekulové hmotnosti, menšímu distribučnímu prostoru a kratšímu biologickému poločasu kratší eliminační poločas, což by mělo zabezpečit jejich dostatečné odstraňování. Nicméně, při přítomnosti vysokých hodnot ostatních podtříd imunoglobulinů dochází ke kompetici o vazebná místa ligandu. To může zpozdit nebo úplně inhibovat vazbu mezi IgG3 a ligandem a vést k nízké eliminaci imunoglobulinů této podtřídy. Imunokomplexy mají 300krát vyšší afinitu k ligandům než IgG, proto je IA vhodnou metodou u kteréhokoliv onemocnění mediovaného imunokomplexy. IA vykazuje nejen eliminační účinek vzhledem k imunoglobulinům, ale i imunomodulační účinek na celulární imunitní odpověď. Během IA procedur dochází k poklesu hodnoty antigenů hlavního histokompatibilního komplexu (HLA) 2. třídy na monocytech. Klesá množství T lymfocytů s posunem od aktivovaných T lymfocytů ke zvyšujícímu se procentu naivních T buněk. Dochází k normalizaci sníženého poměru CD4/CD8 lymfocytů.14
Kolony mohou být určeny na jedno použití nebo na opakované použití. Opakované použití může být limitováno množstvím procedur nebo délkou exspirační doby v závislosti na výrobci a typu kolon. Pokud jsou kolony použitelné opakovaně, po ukončení procedury je kolona promyta eluačním, neutralizačním a konzervačním roztokem a poté uschována k dalšímu použití. Kolony jsou vždy použity u jednoho samého pacienta, nelze je mezi pacienty střídat. Pro semispecifickou imunoadsorpci jsou používány dvě kolony současně. Střídavě plazma prochází jednou kolonou, zatímco druhá je regenerována. Když je aktivní kolona saturována vyvázanými protilátkami, dojde k přesmyku průtoku plazmy do druhé kolony, zatímco první prochází regeneračním procesem, kdy je disociován komplex ligand‑protilátka, kolona propláchnuta a připravena k opětovnému použití. Množství těchto cyklů (přesmyků) závisí na celkovém zpracovaném plazmatickém objemu. Tento systém dovoluje kontinuální odstraňování molekul bez teoretického horního limitu pro zpracovaný objem plazmy. Při specifických imunoadsorpcích jsou vždy používány kolony k jednomu užití (Glycosorb®). Oligosacharidové krevně skupinové antigeny A a B kovalentně vázané do agarózové matrix vyvazují hemaglutininy IgG a IgM. Zpracovaný objem plazmy během jedné procedury závisí na diagnóze, pro kterou je imunoadsorpce indikována. Maximální efektivita vzhledem k délce procedury a eliminaci látek při zpracování se rovná 2,5násobku plazmatického objemu. Při dalším navyšování plazmatického objemu je odstraňování imunoglobulinů neadekvátně nízké vzhledem k délce procedury. Vzhledem k rychlosti krevního průtoku a velikosti zpracovaného objemu se jedná o časově náročné procedury (4–6 hodin). Metoda vyžaduje antikoagulaci. Ideální je citrátová antikoagulace s intravenózní substitucí kalcia. Pokud je použita heparinová antikoagulace, je vždy v kombinaci s citrátem.
Aferetické metody ke snížení hodnot lipoproteinů o nízké denzitě (LDL cholesterol), lipoproteinu (a) (Lp(a)) a apoB lipoproteinů začaly být používány přibližně před půlstoletím. Nejdříve se za tímto účelem používala plazmaferéza, posléze imunoadsorpce. Lipoproteinové aferézy (LA) byly dlouho poslední možností léčby pacientů s dyslipidemií, u kterých možnosti konzervativní léčby byly s neúspěchem vyčerpány.15 Po uvedení inhibitorů proprotein konvertázy/subtilisin kexin typu 9 (PCSK9) na trh potřeba využití LA klesla, jelikož většina pacientů s heterozygotní familiární hypercholesterolemií a dalšími formami hypercholesterolemie na léčbu velmi dobře odpovídá. Nutnost využití LA tak zůstává u pacientů s homozygotní formou familiární hypercholesterolemie a velmi malého počtu pacientů s těžkými formami heterozygotní familiární hypercholesterolemie rezistentních k současným možnostem léčby. Další skupinou indikovanou k LA jsou pacienti s hyper Lp(a) lipoproteinemií. Vzhledem k novým potentním antisense nukleotidům, které snižují koncentraci Lp(a) a budou pravděpodobně v blízké budoucnosti uvedeny do běžné praxe, nebude LA ani u těchto pacientů nutná. Indikací nabývající na významu je ischemická choroba dolních končetin (ICHDK), u níž je prokázán kauzální vztah ke zvýšeným koncentracím Lp(a). Indikaci mají pacienti s ICHDK vyžadující opakované revaskularizace, s progresí choroby z asymptomatického stadia do symptomatického s klaudikacemi nebo s progresí do kritické končetinové ischemie s nutností/nebo nemožností dalších revaskularizací.16,17
Systémy používané pro LA mohou být v principu rozděleny na dva druhy. První, jenž odstraňuje pouze Lp(a), a druhý, který představují nespecifické systémy eliminující všechny lipoproteiny obsahující molekulu apoB‑100 (LDL, lipoproteiny o velmi nízké hustotě [VLDL], lipoproteiny o střední hustotě [IDL], Lp(a)). Existují různé možnosti způsobu odstranění lipoproteinů, všechny jsou pacienty dobře tolerovány, nežádoucí reakce bývají řídké. Dextran sulfát‑celulózová adsorpce je založena na schopnosti dextran sulfátu, který je kovalentně navázán na kuličky celulózy, selektivně vázat LDL, VLDL a Lp(a). Metoda nevyžaduje separaci plazmy, zpracovávána je plná krev. Používají se vždy současně dvě kolony, které jsou v pravidelných intervalech regenerovány, prakticky tak neexistuje limit pro množství vyvázaného LDL. Hodnota LDL cholesterolu klesá o 75–80 %, hodnota Lp(a) o 65–70 %. Pokud jsou procedury prováděny dvakrát týdně, průměrná redukce hodnoty LDL cholesterolu se pohybuje okolo 40–50 % oproti původní. Při dvojité filtrační plazmaferéze (double filtration plasmapheresis, rheoferéza, DFPP) jsou komponenty odstraňovány na základě fyzikálních vlastností, velikosti a molekulové hmotnosti.18 Plazma je separována od buněčných elementů filtrem z dutých vláken, poté prochází přes druhý filtr, který selektivně zachytává menší molekuly (lipoproteiny o vysoké hustotě [HDL], albumin) a propouští molekuly o velké hmotnosti. Nejen lipoproteiny (LDL, Lp(a)), ale i fibrinogen a imunoglobuliny. Další možností je heparinem indukovaná extrakorporální LDL precipitace (HELP). Po přidání heparinu do separované plazmy za dostatečně nízkého pH dochází k precipitaci LDL. Precipitáty jsou následně odstraněny filtrací, heparin je z plazmy odstraněn další adsorpční kolonou a po průchodu dialyzačním filtrem k obnově pH je plazma navracena spolu s krevními elementy zpět do pacienta. Kromě redukce hodnoty LDL cholesterolu a Lp(a) dochází ke snížení hodnot fibrinogenu přibližně o 50 %. Hodnota LDL cholesterolu klesá dlouhodobě o 30 %, procedura není spojena s krvácivými komplikacemi. Přímá adsorpce lipoproteinů metodou hemoperfuze (DALI) nevyžaduje separaci plazmy. LDL cholesterol a Lp(a) jsou adsorbovány na polyakrylamidové kuličky potažené polyakrylátem. Hodnoty LDL a Lp(a) klesají o 60–70 % bez současného poklesu hodnoty HDL cholesterolu a fibrinogenu. Jako cévní přístup jsou většinou používány vlastní žíly, antikoagulace je nejčastěji prováděna citrátem a heparinem. Incidence klinicky zřejmých nežádoucích reakcí je kolem 4 %, většina je méně závažných. Mezi závažné komplikace (incidence nižší než 1 %) patří alergické reakce, horečka, hemolýza, dyspnoe, šokový stav, arytmie. K těžké anafylaxi může dojít během digitální subtrakční angiografie (DSA) nebo DALI, pokud pacient užívá inhibitory angiotenzin konvertujícího enzymu (ACEI). Iontově nabitý dextran sulfát a polyakrylový gel způsobují konverzi kininogenu na bradykinin, jehož nadbytek může u pacientů užívajících ACEI vést k těžké hypotenzi a anafylaxi. ACEI by měly být vysazeny nejméně den před procedurou, je možno je nahradit blokátory receptoru AT1 pro angiotenzin II (ARB). Někdy dlouhodobou léčbu provází anémie s nutností substituce železa a folátu. Těhotenství není kontraindikací k provedení procedur.15,19
Extrakorporální fotoferéza (ECP) byla v roce 1988 uznána americkým Úřadem pro kontrolu potravin a léčiv (FDA) jako součást paliativní léčby kožních T lymfomů. V současnosti je její imunomodulační účinek využíván v léčbě onemocnění mediovaných T buňkami. Při léčbě choroby štěpu proti hostiteli (GVHD) jako komplikace alogenních transplantací kostní dřeně nebo kmenových buněk, v léčbě sklerodermie, systémové sklerózy, některých kožních onemocnění, zánětlivých onemocnění střeva (ulcerózní kolitida, Crohnova choroba) nebo u orgánových transplantací. Je etablovanou terapií v léčbě rejekcí po transplantaci srdce a plic.20 Základním principem je sběr periferních mononukleárů obsahujících patogenní nebo autoreaktivní T lymfocyty z pacientovy krve, jejich ex vivo expozice fotoreaktivnímu činidlu (8‑methoxypsoralen, 8‑MOP) a následně ultrafialovému záření UVA s následnou reinfuzí ozářených buněk do oběhu pacienta. Zjednodušeně, na neaktivované T lymfocyty nemá 8‑MOP vliv, působí na aktivované T lymfocyty, na jejichž strukturu DNA se naváže. Při následném ozáření UVA dochází k poškození DNA tvorbou zkřížených vazeb mezi oběma řetězci a k následné apoptóze aktivovaných T lymfocytů. Účinek vydrží 24 hodin po expozici UVA záření. K apoptóze dochází nejdříve po čtyřech hodinách po reinfuzi do pacientova krevního oběhu. Přímý toxický efekt má ECP pouze na 5–10 % cirkulujících leukocytů, mnohem důležitější, širší a kaskádovitě se zvyšující je její imunomodulační vliv vyvolaný buňkami ošetřenými ECP na efektorové mechanismy imunity, které zajišťují její terapeutický účinek.21 Za normálních okolností cizorodý antigen (transplantovaný štěp, virus, bakterie) je pohlcen antigen prezentující buňkou, čímž dojde k její aktivaci, produkci prozánětlivých cytokinů a následně ke klonální expanzi specifických cytotoxických T lymfocytů s cílem vystupňování buněčné imunitní reakce proti cizorodému antigenu. Jestliže jsou aktivované cytotoxické T lymfocyty ošetřeny ECP, dojde k jejich apoptóze. Specifické proteiny související s apoptózou na povrchu T lymfocytů jsou rozpoznány receptory antigen prezentujících buněk s inhibiční signální kapacitou.22 Tento signál spustí kaskádu dějů vedoucí k produkci protizánětlivých cytokinů a T regulačních lymfocytů, k posunu Th1 k Th2 buněčné odpovědi a navození imunotolerance.23 Terapeutický režim se liší v závislosti na indikaci, nejčastěji jsou prováděny dvě procedury dva dny po sobě následující každé 2–4 týdny. Procedury jsou většinou dobře tolerovány. Vlivem uvolnění cytokinů mohou pacienti za 2–12 hodin po reinfuzi vyvinout subfebrilie. Kontraindikováni k ECP jsou pacienti s afakií nebo fotosenzitivitou. Dvacet čtyři hodin po proceduře by se pacienti neměli vystavovat slunečnímu záření.22
Aferézy jsou v současnosti již dobře zavedenými metodami. Představují důležitou součást léčebných protokolů, při správné indikaci s excelentní terapeutickou účinností a současně nízkým množstvím nežádoucích reakcí. Mají významnou roli v desenzitizačních protokolech v transplantační medicíně, při léčbě některých hematologických, neurologických a kožních onemocnění. Silná evidence a kvalitní randomizované kontrolované studie však chybějí. Optimální načasování, dávka a interval procedur jako adjunktivní terapie k imunosupresivní léčbě stále zůstávají výzkumnou výzvou.
Literatura
- Chegini A, Ahmadi Karvigh S, Rahbar M, Sharifi Rayeni A. Therapeutic apheresis in neurological, nephrological and gastrointestinal diseases. Transfus Apher Sci 2019;58:266–272.
- Khalife N. Advances in Therapeutic Plasma Exchange Technology and its Immunomodulatory effect in neuromuscular diseases. Eur Neurol Rev 2019;14:61–63.
- Szczepiorkowski ZM. Indications for therapeutic apheresis in hematological disorders. Semin Hematol 2020;57:57–64.
- Padmanabhan A, Connelly‑Smith L, Aqui N, et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice – Evidence‑Based Approach from the Writing Committee of the American Society for Apheresis: The Eighth Special Issue. J Clin Apher 2019;34:171–354.
- Roman PE, DeVore AD, Welsby IJ. Techniques and applications of perioperative therapeutic plasma exchange. Curr Opin Anaesthesiol 2014;27:57–64.
- Williams ME, Balogun RA. Principles of separation: indications and therapeutic targets for plasma exchange. Clin J Am Soc Nephrol 2014;9:181–190.
- Samtleben W, Randerson DH, Blumenstein M, et al. Membrane plasma exchange: principles and application techniques. J Clin Apher 1984;2:163–169.
- Ward DM. Conventional apheresis therapies: a review. J Clin Apher 2011;26:230–238.
- Kaplan AA. Therapeutic plasma exchange: core curriculum 2008. Am J Kidney Dis 2008;52:1180–1196.
- Cui Z, Zhao J, Jia XY, et al. Clinical features and outcomes of anti‑glomerular basement membrane disease in older patients. Am J Kidney Dis 2011;57:575–582.
- Johnson JP, Moore J Jr, Austin HA 3rd, et al. Therapy of anti‑glomerular basement membrane antibody disease: analysis of prognostic significance of clinical, pathologic and treatment factors. Medicine (Baltimore) 1985;64:219–227.
- Braun N, Risler T. Immunoadsorption as a tool for the immunomodulation of the humoral and cellular immune system in autoimmune disease. Ther Apher 1999;3:240–245.
- Braun N. Fundamentals and applications of immunoadsorption. 1st edition. Bremen: UNI‑MED, 2009, p. 14–16.
- Braun N, Gutenberger S, Erley CM, Risler T. Immunoglobulin and circulating immune complex kinetics during immunoadsorption onto protein A sepharose. Transfus Sci 1998;19(Suppl):25–31.
- Pokrovsky SN, Afanasieva OI, Ezhov MV. Therapeutic Apheresis for Management of Lp(a) Hyperlipoproteinemia. Curr Atheroscler Rep 2020;22:68.
- Stefanutti C, Thompson GR. Lipoprotein apheresis in the management of familial hypercholesterolaemia: historical perspective and recent advances. Curr Atheroscler Rep 2015;17:465.
- Weiss N, Julius U. Lipoprotein(a) apheresis in patients with peripheral arterial disease: rationale and clinical results. Clin Res Cardiol Suppl 2019;14(Suppl 1):39–44.
- Thompson G, Parhofer KG. Current Role of Lipoprotein Apheresis. Curr Atheroscler Rep 2019;21:26.
- Pokrovsky SN, Afanasieva OI, Ezhov MV. Lipoprotein(a) apheresis. Curr Opin Lipidol 2016;27:351–358.
- Cho A, Jantschitsch C, Knobler R. Extracorporeal Photopheresis – An Overview. Front Med (Lausanne) 2018;5:236.
- Mankarious M, Matthews NC, Snowden JA, Alfred A. Extracorporeal Photopheresis (ECP) and the Potential of Novel Biomarkers in Optimizing Management of Acute and Chronic Graft vs. Host Disease (GvHD). Front Immunol 2020;11:81.
- Simmons SC, Schwartz J, Pham HP. Extracorporeal photopheresis. Transfusion Medicine and Hemostasis, third edition, 2018, p. 487–491.
- Xipell M, Molina‑Andújar A, Cid J, et al. Immunogenic and immunotolerogenic effects of extracorporeal photopheresis in high immunological risk kidney recipients. A single center case series. J Clin Apher 2021 Dec 22. doi: 10.1002/jca.21958. Epub ahead of print.
- Kategorie: Přehledové články
- Klíčová slova: aferéza; extrakorporální fotoferéza ; imunoadsorpce; kaskádová filtrace ; lipoproteinová aferéza ; plazmaferéza