Glomerulární postižení asociovaná s malignitami a nefrotoxicita chemoterapie
V posledním roce se objevila celá řada článků popisujících postižení ledvin po podávané chemoterapii či po podání biologických léků u onkologických nemocných. Díky pokrokům v medicíně se s touto problematikou setkáváme stále častěji, a to nejen na klinických pracovištích, ale i v rámci poskytování konsiliárních služeb kdekoli v periferii. Tento souhrnný článek přináší některé nové poznatky z této oblasti, i když je jasné, že nemůže postihnout celou, velmi širokou problematiku.
Paraneoplastické postižení ledvin
Paraneoplatické glomerulopatie/glomerulonefritidy
Paraneoplastické glomerulopatie (PG) nejsou u nádorových onemocnění nijak vzácnou entitou. V naprosté většině případů nejsou způsobeny invazí tumoru do ledvin či velikostí nádorové masy, ale produkcí abnormálních působků, většinou proteinové povahy, které vedou k imunologickému poškození ledvin. Jejich léčba se proto liší od léčby idiopatických glomerulonefritid. Problémem je skutečnost, že ačkoli nové a velmi účinné protinádorové léky mohou tumor vyléčit, poškození některých orgánů či buněčných struktur (např. cévního endotelu) může být ireverzibilní. Různé typy nádorů mohou být spojeny s různým typem glomerulárního postižení (Jhaveri, 2013).
Membranózní nefropatie
Membranózní nefropatie (MN) je pravděpodobně nejčastější paraneoplastickou glomerulopatií. Odhaduje se, že asi 10 % všech MN je paraneoplastických (Lefaucheur, 2006). Bohužel, jen asi u poloviny takto diagnostikovaných nemocných jsou již v době vzniku nefropatie symptomy malignity zřetelné. U zbytku se projeví až s odstupem několika měsíců. Není výjimkou, že se nádor objeví až po jednom roce až dvou letech od vzniku MN. Zvýšenou pravděpodobnost přítomnosti malignity u nemocných s MN lze očekávat u jedinců starších 60 let. Membranózní nefropatie nejčastěji komplikuje karcinomy různé lokalizace, poměrně vzácně se vyskytuje u jedinců se sarkomy či neuroendokrinními tumory. Etiopatogeneticky se může na vzniku nefropatie uplatňovat: a) formování imunokomplexů in situ proti antigenům tumoru, které jsou lokalizovány subepiteliálně, anebo proti antigenům podocytů, které jsou identické či podobné těm tumorózním; b) ukládání imunokomplexů namířených proti tumoru v glomerulárních kapilárách; c) infekce či jiné poruchy imunitního systému, které umožnily vznik tumoru i nefropatie. Jedním z velmi důležitých bodů, který nám může pomoci rozlišit idiopatickou (primární) MN od sekundární (paraneoplastické), je přítomnost anti‑PLA2R protilátek v séru či jejich zvýšená exprese (spolu s protilátkami IgG4) v glomerulech u nemocných s idiopatickými MN. Zdá se, že u nemocných s paraneoplastickými MN se tyto nálezy vyskytují méně častěji (Qin, 2011). Existují ale výjimky, kdy anti‑PLA2R jsou pozitivní i u pacientů s karcinomem. Pokud anti‑PLA2R přetrvávají i po odstranění tumoru, je velmi pravděpodobné, že jde o koexistenci obou forem onemocnění. Kromě negativity anti‑PLA2R v séru může pro paraneoplastickou MN svědčit i přítomnost IgG1/IgG2 infiltrátu v renální biopsii spolu se zvýšeným počtem zánětlivých elementů (více než 8 buněk v glomerulu). Stále diskutovanou otázkou je, u kterých nemocných a v jakém rozsahu provádět screening na malignity. Měl by se provádět zejména u nemocných starších 65 let a s negativitou anti‑PLA2R. Vyšetřovací program by měl zohlednit rizikovost nemocného, nicméně mezi základní doporučená vyšetření patří: stolice na okultní krvácení (event. kolonoskopie), mamografie u žen a PSA u mužů, RTG hrudníku (u rizikových kuřáků i CT plic) a sonografie břicha.
Další nefropatie
Prakticky kterýkoli solidní nádor může být spojen s nefropatií. Přehled nejčastějších nádorů a glomerulopatií, které mohou vyvolávat, je uveden v tabulce 1 (tab. 1). Zajímavá je i asociace nejčastější idiopatické GN – IgA nefropatie (IgAN) s některými nádory. Doprovází zejména nádory v ORL oblasti a plic a otázkou je, zda se právě respirační infekce nemohou etiopatogeneticky podílet na vzniku těchto nádorů. Podobné je to i u Henochovy‑Schönleinovy purpury, kde je za rizikový faktor vzniku onemocnění a současně nádoru považován vyšší věk a mužské pohlaví. Spíše ojediněle doprovází nádory AA amyloidóza, výjimkou je renální karcinom. Nádorové buňky karcinomu totiž secernují interleukin 6, který je důležitým cytokinem stimulujícím produkci SAA, prekurzoru pro vznik AA amyloidózy. Dalším spouštěcím faktorem pro vznik například minimálních změn glomerulů (MCN) či kolabující formy fokálně segmentální glomerulosklerózy (FSGS) je vaskulární endoteliální růstový faktor (VEGF), který může být produkován řadou nádorových buněk.
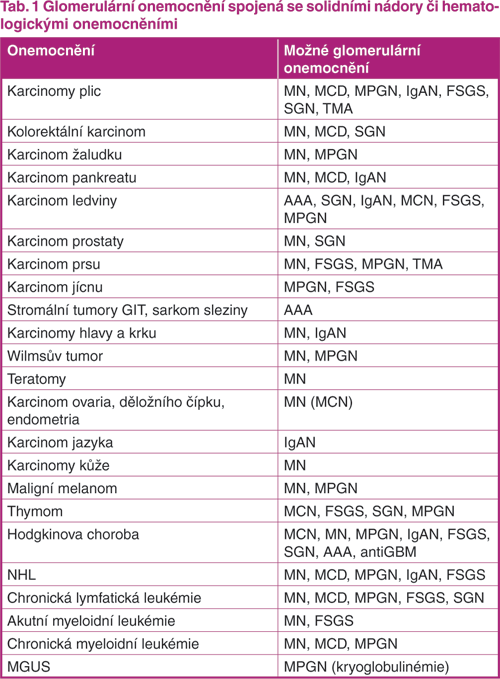
AAA – AA amyloidóza; antiGBM – glomerulonefritida s protilátkami proti glomerulární bazální membráně; FSGS – fokálně segmentální glomeruloskleóza; IgAN – IgA nefropatie; MCN – minimální změny glomerulů; MGUS – monoklonální gamapatie nejasného významu; MN – membranózní nefropatie; MPGN – membranoproliferativní glomerulonefritida; NHL – non‑hodgkinské lymfomy; SGN – glomerulonefritida se srpky; TMA – trombotická mikroangiopatie
Převzato a upraveno podle: Jhaveri KD, Shah HH, Calderon K, et al. Glomerular diseases seen with cancer and chemotherapy: a narrative review. Kidney Int 2013;84:34–44.
U hematologických malignit může kromě imunitních dějů a produkce různých cytokinů či růstových faktorů do hry zasáhnout i infiltrace ledvin nádorovými buňkami (chronická lymfatická leukémie – CLL). Mezi nejčastější glomerulopatie patří u hematologických malignit MCN, MN a MPGN. Výskyt MCN je popisován až u 1 % všech nemocných s Hodgkinovým lymfomem, přičemž není výjimkou, že rozvoj nefrotické proteinurie i o několik měsíců předchází manifestaci nádorového onemocnění. Klíčovým cytokinem zodpovědným za rozvoj proteinurie a hypalbuminémie je interleukin 13, mediátor imunitní reakce zprostředkované Th‑2 lymfocyty. Vymizení proteinurie po zahájení chemoterapie bývá velmi rychlé a kompletní. Nemocní s CLL mívají velmi často membranoproliferativní glomerulonefritidu (MPGN) s pozitivitou kryoglobulinů, na druhém místě co do četnosti výskytu je pak MN. Chronická lymfatická leukémie se může někdy také komplikovat relativně vzácnými nefropatiemi, jako jsou fibrilární či imunotaktoidní glomerulonefritida. A zatímco fibrilární GN může být i idiopatická, imunotaktoidní GN bývá prakticky vždy paraneoplastická, a proto by jedinci s touto diagnózou měli být pečlivě vyšetřeni na případnou přítomnost malignity. Myeloproliferativní onemocnění bývají nejčastěji doprovázena FSGS. Stejný typ nefropatie se vyskytuje i u polycythaemia vera a esenciální trombocytémie. Jednou z příčin může být skutečnost, že z destiček se uvolňují některé faktory (např. PDGF), které přispívají k rozvoji glomerulosklerózy.
Velmi specifickou skupinu nemocných představují pacienti po transplantaci krvetvorných kmenových buněk, zejména allogenní. Kromě poškození cévního endotelu při rozvoji trombotické mikroangiopatie (TMA) se u nich můžeme setkat i s glomerulárním poškozením doprovázeným nefrotickým syndromem. Nejčastěji se zde diagnostikuje MN a MCN, přičemž časově je vznik nefropatie často vázán na rozvoj GVHD choroby (graft versus host disease).
Postižení ledvin při chemoterapii a biologické léčbě Málokterý obor medicíny zažívá v posledních dvou dekádách takový nápor nových léčiv jako onkologie. I když řada těchto látek představuje mnohem cílenější léčbu než dříve, určitý stupeň toxicity zde zůstává. Pokud současně nasedne na některé rizikové faktory ze strany pacienta, může být léčba komplikována závažnými nežádoucími účinky. Možných mechanismů negativního účinku na ledviny je několik:
- Postižení ledvin v důsledku přítomnosti tumoru ("tumor‑related effects"). Sem patří například přímé renální postižení při myelomové ledvině, infiltrace ledviny (CLL, lymfomy), obstrukce močových cest tumorem či paraneoplastické glomerulopatie. Mezi nepřímé renální postižení lze zařadit dehydrataci při zvracení, průjmech či polyurii, ztrátu efektivního volumu (ascites, pleurální výpotky, kardiomyopatie) či hyperurikémii nebo hyperkalcémii.
- Přímá toxicita chemoterapie. Zde se mohou uplatnit vysoké dávky chemoterapie a její opakované podávání, lék či jeho metabolit formující krystaly intratubulárně, přímý toxický účinek léku na endotel či tubulární epitel či kombinace chemoterapie s dalšími nefrotoxickými léky (nesteroidní antiflogistika, aminoglykosidy, radiokontrastní látky).
- Rizikové faktory na straně pacienta. Mezi tyto faktory lze řadit starší věk (> 65 let), preexistující chronické onemocnění ledvin či nasedající akutní poškození ledvin (AKI), alergickou reakci na podávaný lék či farmakogenetickou dispozici zvyšující toxicitu léku (např. při mutaci v genu pro CYP450 nebo mutaci v genech pro transport proteinů či renální transportéry).
- Renální vylučování a metabolismus podávaných léčiv. Do této kategorie rizikových faktorů patří vysoká koncentrace léku v renálních tubulech a v intersticiu, zpětná resorpce toxinů v proximálním tubulu, vysoký metabolický obrat tubulárních buněk v Henleově kličce a biotransformace chemoterapeutika s produkcí volných kyslíkových radikálů a spuštěním oxidačního stresu.
Jednotlivá léčiva se liší také v tom, kterou část renálního parenchymu postihují. Přehled nejčastějších typů postižení a léčiv, která je mohou vyvolávat, je uveden v tabulce (tab. 2).
Inhibitory VEGF
Vaskulární endoteliální růstový faktor je velmi důležitý mediátor regulující vaskulogenezi a angiogenezi během vývoje plodu a orgánů, je ale také nezbytným faktorem pro růst nádorových buněk. Jeho blokování je tedy logickým krokem, který by měl zabránit dalšímu růstu nádoru. Problém ale je, že VEGF je produkován podocyty a poté se váže prostřednictvím VEGF receptorů (VEGFRs) především na renální endotel, ale i mesangium a peritubulární kapiláry. Jeho produkce je důležitá pro správné fungování všech těchto buněk, včetně jejich regenerace a obnovy. Do značné míry se také podílí na integritě a správné funkci interpodocytární membrány (slit diafragmy). Podání inhibitorů VEGF tedy logicky vede k poškození ledvin, které se nejčastěji manifestuje jako nově vzniklá nebo zhoršující se hypertenze a rozvoj AKI. Tíže hypertenze může do určité míry vypovídat o efektivitě protinádorového účinku, a tak se nedoporučuje léčbu vysazovat, ale intenzivně léčit pomocí antihypertenziv (De Stefano, 2011). Během léčby také dochází k vzestupu proteinurie, která ale nemívá nefrotický ráz. V histologii lze pozorovat edém endotelu, vakuolizaci a odloupnutí endotelií a zároveň disrupce v oblasti interpodocytární membrány. Kromě těchto změn se mohou objevit typické známky TMA. K poškození ledvin dochází až u 50 % nemocných, kteří jsou léčeni bevacizumabem (monoklonální protilátka proti VEGF). Z dalších inhibitorů VEGF jmenujme ještě ranabizumab (monoklonální protilátka), dasatinib (inhibitor rodiny Src kináz) a sorafenib, sunitinib, pazopanib a axitinib (inhibitory VEGF receptorů).
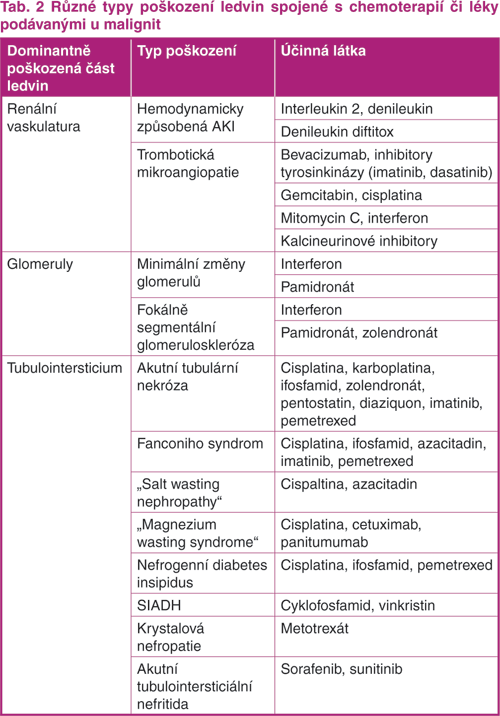
AKI – akutní renální poškození; SIADH – syndrom nepřiměřené sekrece antidiuretického hormonu
Upraveno podle: Perazella MA. Onco‑Nephrology: renal toxicities of chemotherapeutic agents. Clin J Am Soc Nephrol 2012;7:1713–1721.
Gemcitabin
Gemcitabin patří mezi pyrimidinové antagonisty a používá se v léčbě řady malignit, jako jsou např. karcinomy plic, pankreatu, močového měchýře a prsu. Jeho podávání může být spojeno s poškozením ledvin charakteru TMA způsobující různý stupeň AKI. Jde o relativně vzácnou komplikaci, kde se za rizikový faktor považuje předchozí předléčení nemocných mitomycinem C. Reparace renální funkce je velmi variabilní a závisí na celkové podané dávce, přičemž zhruba třetina postižených zůstane závislá na dialýze. Plazmaferézy nebývají v léčbě tohoto typu TMA příliš účinné.
Interferony
Interferony jsou přirozeně zapojeny do obrany organismu před patogeny, jako jsou viry, paraziti či bakterie, stejně tak i do obrany před nádorovými buňkami. Interferon α (INFα) a interferon β (INFβ) redukují replikaci virů a syntézu některých proteinů, interferon γ (INFγ) aktivuje makrofágy a buňky hlavního histokompatibilního systému (MHC). Největší uplatnění v současné medicíně má INFα, který se užívá nejen při léčby chronických virových hepatitid, ale je důležitou součástí léčby některých solidních tumorů či mnohočetného myelomu. Chronické podávání kteréhokoli INF může vést k renálnímu poškození, které se projevuje zejména poškozením podocytů. Přesný mechanismus poškození podocytů není jasný, ale INF pravděpodobně zasahují do metabolických pochodů podocytů a zvyšují expresi antigenů (MHC) II. třídy na svém povrchu spolu s aktivací makrofágů. Terapie zejména INFα je spojována s rozvojem nefrotického syndromu na podkladě MCN. Po vysazení terapie INF a zahájení kortikoterapie došlo u většiny nemocných k rychlému vymizení proteinurie. Popsány jsou i případy s rozvojem FSGS jak po podání INFα, tak INFβ. U tohoto typu poškození ledvin byla pozorována velmi vysoká proteinurie (až 42 g/den!), a i častější výskyt AKI. Specifickým typem FSGS pak je kolabující forma, která byla pozorována po všech typech podávaných INF, odpověď na léčbu steroidy a vysazení INF bývá ale u této formy postižení nekonzistentní.
Cisplatina
Cisplatina je velmi často užívaným cytostatikem v léčbě řady karcinomů a sarkomů, účinná bývá i u lymfomů. Nefrotoxicita a případně i ototoxicita jsou plně závislé na podané dávce a individuální vnímavosti pacienta k léčbě. Cisplatina způsobuje nekrózu buněk či jejich apoptózu a může postihovat různé části ledvin (arterioly, glomeruly, ale zejména tubulární buňky). Poškození tubulů se může manifestovat různými formami tubulární dysfunkce, ale může vést i k AKI. Díky chloridu navázanému v cis-pozici molekuly platiny dochází k snadnému pronikání látky do nitra tubulárních buněk, kde pak spouští řadu patologických pochodů (aktivaci kaspáz, cyklin-dependentních kináz, signální cesty p53 i aktivaci mitogen‑aktivujících proteinkináz). Výsledkem aktivace těchto signálních cest je zánět a oxidační stres tubulárních buněk a také ischémie cévních struktur ledviny.
Spektrum tubulopatií po terapii cisplatinou je velmi široké a může zahrnovat jak postižení proximálního tubulu (plně vyvinutý Fanconiho syndrom či „salt wasting nephropathy“), tak postižení distálního tubulu (porucha reabsorpce magnézia s těžkou hypomagnezémií či plně vyvinutý diabetes insipidus). Rozvoj AKI po terapii cisplatinou bývá nejčastěji způsoben akutní tubulární nekrózou nebo rozvojem TMA. Mezi základní preventivní opatření patří dostatečná hydratace nemocného před zahájením léčby a zajištění dostatečné diurézy, někdy i za pomoci forsírované diurézy či hypertonických roztoků. Amifostin je analog glutathionu, který snižuje toxicitu cisplatiny, jeho podávání ale bývá spojeno s nauzeou a zvracením. Tam, kde to lze, je vhodné podat méně nefrotoxické deriváty platiny, jako je karboplatina či oxaliplatina.
Ifosfamid
Ifosfamid patří, podobně jako cyklofosfamid, mezi alkylační cytostatika, ale na rozdíl od cyklofosfamidu se metabolizuje na mnohem toxičtější metabolit chloracetaldehyd, který poškozuje tubulární buňky. Mezi nejčastější tubulopatie pozorované po podání ifosfamidu patří Fanconiho syndrom a nefrogenní diabetes insipidus. Pokud dojde k rozvoji AKI, bývá často reverzibilní. Chronické poškození ledvin s proximální tubulopatií je popisováno zhruba u 1 % léčených nemocných, ve 20 % případů dochází k trvalé fosfaturii, která může vést až k rozvoji osteomalacie. Rizikové faktory pro rozvoj renálního poškození zahrnují předchozí léčbu cisplatinou, kumulativní dávku ifosfamidu > 90 g/m2 a preexistující renální poškození. Léčba je pouze symptomatická.
Pemetrexed
Pemetrexed patří mezi antimetabolity a inhibuje enzymy účastnící se syntézy purinů/pyrimidinů a tímto mechanismem blokuje syntézu DNA nádorových buněk. Využívá se v léčbě maligních mezoteliomů a ne‑malobuněčných tumorů plic. Pemetrexed se ze 70–90 % vylučuje nezměněný ledvinami, a proto se snáze dostává do buněk proximálního tubulu, kde je polyglutaminizován, a tímto mechanismem se zvyšuje jeho intracelulární koncentrace. To vede k poruše metabolismu kyseliny listové s následným poškozením syntézy RNA/DNA.
Po opakovaném podání pemetrexedu byly popsány různé typy renálního postižení, mezi nejčastější patří akutní tubulární nekróza, akutní tubulointersticiální nefritida (TIN), nefrogenní diabetes insipidus či renální tubulární acidóza.
Cetuximab
Cetuximab je chimerická monoklonální protilátka proti receptoru pro epidermální růstový faktor (EGFR). Užívá se v léčbě různých epiteliálních malignit (kolorektální tumory, nádory krku a hlavy, prsu a plic). Zvýšená aktivita EGF u těchto tumorů redukuje apoptózu a tímto způsobem usnadňuje růst nádorů. Poměrně častým nežádoucím účinkem léčby cetuximabem je rozvoj hypomagnezémie. Ta je způsobena poruchou zpětného vstřebávání magnézia v distálním tubulu, které je zčásti závislé na EGFR (zprostředkováno TRPM6 receptorem). Výskyt významné hypomagnezémie je popisován až u poloviny léčených nemocných, u všech pak lze zaznamenat určitý pokles koncentrace Mg (i když u některých jde jen o relativní pokles s ještě normálními sérovými koncentracemi). Hypomagnezémie bývá často doprovázena i hypokalémií a hypokalcémií. Rizikovými faktory pro rozvoj těžší hypomagnezémie jsou vyšší věk nemocných, délka trvání terapie a vstupní koncentrace Mg. Léčba vyžaduje intravenózní aplikaci Mg, jelikož perorální substituce nebývá dostačující a je navíc často spojena s průjmy.
Další inhibitory EGF, jako např. panitumumab, vyvolávají hypomagnezémii také, i když v menší míře.
Metotrexát
S nefrotoxicitou metotrexátu (MTX) se setkáváme zejména po jeho podávání ve vysokých dávkách (1–12 g/m2), které se používají zejména v léčbě lymfomů. Dlouhodobě podávané malé dávky (jako např. u revmatických onemocnění) nefrotoxické nebývají. Metotrexát a jeho metabolit 7‑OH MTX jsou filtrovány glomeruly a k jejich precipitaci ve formě krystalů dochází v distálním tubulu. Akutní poškození ledvin je způsobeno nejen mechanickou obstrukcí krystaly, ale u zvýšeným sklonem k apoptóze tubulárních buněk způsobené vzestupem reaktivních forem kyslíku v důsledku poklesu aktivity adenosin deaminázy. Akutní poškození ledvin se vyskytuje asi u 1,8–12 % léčených nemocných. Mezi rizikové faktory rozvoje AKI patří volumová deplece se sníženým výdejem moči, kyselé pH moči a preexistující renální postižení s GF < 60 ml/min. Předejít formování krystalů v distálním tubulu lze tedy dostatečnou hydratací, alkalizací moči a podáváním leucovorinu 24–36 hodin po podání MTX. Plazmatickou koncentraci MTX lze měřit a pokud dojde při vysokých koncentracích MTX k AKI, je možné použít high‑flux dialýzu, která odstraní značnou část volně cirkulujícího MTX. Problémem je ale jeho silná vazba na proteiny a v intersticiu, a tudíž rebound po skončení dialýzy. Jako velmi účinná prevence renálního poškození se jeví glukarpidáza, enzym, který odbourává MTX velmi rychle po jeho podání. Je ale rezervována jen pro těžší intoxikace, jelikož její podání může interferovat s účinkem léčby (Patterson, 2010). V ČR ale lék není registrován.
Kalcineurinové a mTOR inhibitory
Tacrolimus, sirolimus či cyklosporin se v onkologii používají jako léky zabraňující rozvoji GVHD u pacientů po allogenní transplantaci kostní dřeně. Pro akutní renální poškození těmito léky je typické TIN postižení s arteriolopatií, nicméně občas můžeme pozorovat i vznik typické TMA či glomerulárního poškození. Jedním z klíčových mechanismů vzniku endoteliálního poškození je pokles produkce prostaglandinu I2 cyklosporinem s následným snížením koncentrace NO v cévní stěně. Inhibitory m‑TOR se také používají v léčbě renálního karcinomu a kromě projevů TMA byly u vnímavých jedinců popsány i další typy poškození ledvin, mezi něž patří zejména FSGS a MCN, které se projevují někdy i významnou proteinurií. Kromě glomerulárního poškození se na proteinurii může podílet i porucha zpětné resorpce proteinů poškozenými tubuly. U zvířecích modelů byla po podání sirolimu pozorována také zvýšená tvorba intratubulárních válců spolu se zvýšenou proliferací epiteliálních buněk. Spekuluje se také o tom, že zde dochází ke zvýšené expresi VEGF v podocytech (Izzedine, 2005).
Podávání bisfosfonátů a renální postižení
Bisfosfonáty nepatří mezi cytostatika, ale často se onkologickým nemocným podávají. Pamidrinát patří mezi bisfosfonáty podávané při metastatickém kostním poškození nemocných s mnohočetným myelomem, ale i u jiných malignit. Tento lék ale může způsobit poškození ledvin kolabující formou FSGS či rozvojem nefrotické proteinurie na podkladě MCN. U lehčích forem postižení může po vysazení léku dojít k normalizaci močových nálezů. Při delším podávání a zejména v případech, kdy se dává nemocným se sníženou GF, může dojít k ireverzibilnímu poškození ledvin. Důvodem je to, že pamidrinát je silně navázán na kostní struktury a plazmatické bílkoviny a i po vysazení dochází k jeho dlouhodobému uvolňování. A jelikož dominantní cesta jeho vylučování je renální, může se kumulovat a poškozovat ledviny. Zolendronát způsobuje zejména tubulární poškození i s mírnou formou obstrukce, glomerulární léze nevyvolává.
Další látky vyvolávající možné postižení ledvin
Postižení ledvin po podávání antracyklinových derivátů je dlouho známo a využívá se i výzkumně u myších modelů (andriamycinová nefropatie). U lidí byl po podání doxorubicinu nebo daunorubicinu popsán rychlý rozvoj nefrotického syndromu způsobený MCN či kolabujícími formami FSGS. Mediátorem renálního poškození je zřejmě receptor RAGE na povrchu podocytů, na který se doxorubicin váže a spouští oxidační stres.
Poškození ledvin bylo popsáno i po některých dalších látkách. Filgrastin (růstový faktor pro granulocyty) může vyvolat proteinurii a mikrohematurii, pegfilgrastin (pegylovaný filgrastin) zase může vést ke vzniku srpkovité glomerulonefritidy. Po podání ipilimumabu (anti‑CTLA 4) nemocným s maligním melanomem byl zase zaznamenán vznik lupus‑like nefritidy.
Literatura
- Flombaum CD. Nephrotoxicity of chemotherapy agents and chemotherapy administration in patients with renal disease. In: Cohen EP (ed). Cancer and the kidney. The frontier of nephrology and oncology. 2nd ed. New York, Oxford University Press, 2011:115–176.
- Jhaveri KD, Shah HH, Calderon K, et al. Glomerular diseases seen with cancer and chemotherapy: a narrative review. Kidney Int 2013;84:34–44.
- Lefaucheur C, Stengel B, Nochy D, et al. Membranous nephropathy and cancer: epidemiologic evidence and determinants of high‑risk cancer association. Kidney Int 2006;70:1510–1517.
- Qin W, Beck LH Jr, Zeng C, et al. Anti‑phospholipase A2 receptor antibody in membranous nephropathy. J Am Soc Nephrol 2011;22:1137–1143.
- Perazella MA. Onco‑Nephrology: renal toxicities of chemotherapeutic agents. Clin J Am Soc Nephrol 2012;7:1713–1721.
- Wallace E, Lyndon W, Chumley P, et al. Dasatinib‑induced nephrotic‑range proteinuria. Am J Kidney Dis 2013;61(6):1026–1031.
- Izzedine H, Brocheriou I, Frances C. Post transplantation proteinuria and sirolimus. N Engl J Med 2005;353;2088.
- Sasaki K, Anderson E, Shankland SJ. Diffuse proliferative glomerulonephritis associated with cetuximab, an epidermal growth factor receptor inhibitor. Am J Kidney Dis 2013;61:988–991.
- De Stefano A, Carlomagno C, Pepe S, et al. Bevacizumab‑related arterial hypertension as a predictive marker in metastatic colorectal cancer patients. Cancer Chemother Pharmacol 2011;68:1207–1213.
- Patterson DM, Lee SM. Glicarpidase following high‑dose methotrexate: Update on development. Expert Opin Biol Ther 2011;10:105–111.
- Valentine C, Hebert LA. Paraneoplastic glomerulopathies. In: Cohen EP (ed). Cancer and the kidney. The frontier of nephrology and oncology. 2nd ed. New York, Oxford University Press, 2011:53–72.
- Kategorie: Novinky v nefrologii
- Klíčová slova: glomerulonefritida; glomerulopatie; inhibitory; nefropatie