Perspektivy: Hepcidin, anémie chronických chorob a rezistence na erytropoetin
Anémie chronických chorob
Anémií chronických chorob se často komplikují chronické infekce, autoimunitní onemocnění (např. revmatoidní artritida, nespecifické střevní záněty, systémový lupus erythematodes a vaskulitidy), hematologické i solidní nádory nebo chronická rejekce transplantovaných orgánů. Také chronické onemocnění ledvin bývá často provázeno zánětem (tzv. syndrom MIA – malnutrice, zánět, ateroskleróza) a renální anémie způsobená deficitem erytropoetinu se může kombinovat se současně přítomnou anémií chronických chorob.
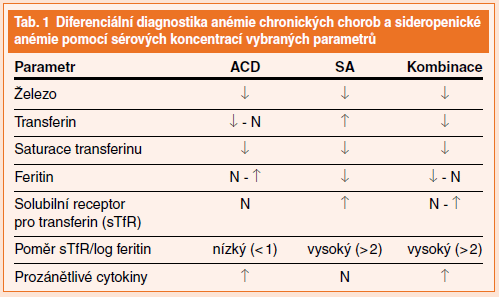
Anémie chronických chorob (ACD) je normocytární normochromní anémie, kterou je třeba v praxi odlišit zejména od (obvykle mikrocytární a hypochromní) sideropenické posthemoragické anémie (SA) z nedostatku železa v důsledku krevních ztrát. V praxi se také poměrně často vyskytuje i kombinace obou typů anémie (viz tab. 1). K odlišení sideropenické anémie a anémie chronických chorob přispívá nejvíce stanovení hodnot sérového feritinu, sérového solubilního receptoru pro transferin a jejich vzájemný poměr.
Rezistence na erytropoetin
V patogenezi anémie chronických chorob hrají rozhodující roli tři faktory: 1) snížená tvorba erytropoetinu, 2) snížená odpověď na erytropoetin a 3) porucha metabolismu železa.
U pacientů s chronickým selháním ledvin je nepochybně rozhodujícím faktorem anémie snížená renální produkce erytropoetinu. Vzhledem k častému výskytu chronického zánětu (nebo alespoň mikrozánětu s elevací CRP) přispívá ale poměrně často (ve 23–50 %; Weiss, 2005) k těžké anémii vedle čistě renální anémie i anémie chronických chorob (diabetické komplikace, infekce shuntu, katétrová sepse, bioinkompatibilita membrán, dialyzát).
Zvýšená produkce prozánětlivých cytokinů (IL-1, TNFα, IL-6, interferonu-γ, ale i IL-4 a IL-13) se tradičně pokládá za hlavní mediátor jak snížené erytropoézy, tak snížené odpovědi na erytropoetin (Macdougall, 2002; Cooper et al., 2003). Uremičtí pacienti mají ve srovnání s kontrolami s normální renální funkcí snížené počty erytroidních kolonií (colony forming units-erythroid, CFU-E), počet erytroidních kolonií je dále významně snížen u uremických pacientů s klinickými a laboratorními známkami zánětu (Macdougall, 2002). Interferon-γ, IL-1 i TNFα snižují expresi erytropoetinu na CFU-E, inhibují proliferaci a diferenciaci CFU-E i BFU-E (burst forming unit-erythroid) a indukují jejich apoptózu.
Pacienti se sníženou odpovědí (rezistencí) na erytropoetin mají ve srovnání s erytropoetin-senzitivními pacienty významně kratší dožití (Macdougall, 2002). Důvodem mohou být jak komplikace vedoucí k aktivaci prozánětlivých cytokinů (viz výše, pacienti s rezistencí na erytropoetin mají vyšší CRP – Macdougall, 2002), tak i současné podávání vyšších dávek parenterálního železa, které může stimulovat mechanismy oxidačního stresu.
Nedávná analýza faktorů, které ovlivňují rezistenci na erytropoetin (López-Gómez et al., 2008), na velkém souboru 1 710 pacientů potvrdila, že rezistence na erytropoetin významně ovlivňuje dožití pacientů zřejmě i v souvislosti s vyšším zastoupením komorbidit (kardiovaskulárních komplikací, infekcí i tumorů). Význam chronického zánětu byl demonstrován např. negativní korelací mezi indexem rezistence na erytropoetin (poměr týdenní dávky erytropoetinu a koncentrace hemoglobinu) se sérovým albuminem nebo vyšším indexem rezistence na erytropoetin u pacientů s permanentním katétrem ve srovnání s pacienty s nativní fistulí. Zatímco index rezistence na erytropoetin negativně koreloval se saturací transferinu, korelaci mezi indexem rezistence na erytropoetin a sérovým feritinem nebylo možno prokázat. Zvýšené sérové koncentrace feritinu tedy nejsou dobrým ukazatelem rezistence na erytropoetin.
Důležitým faktorem v patogenezi anémie chronických chorob je omezená dostupnost železa pro erytropoézu, které je hůře absorbováno z trávicího traktu a zvýšeně deponováno ve vazbě na feritin v jaterních buňkách a makrofázích. Prozánětlivé cytokiny (IL-1, IL-6, IFN-γ, TNFα) stimulují transkripci feritinu a snižují expresi ferroportinu, transportního proteinu, který je nezbytný pro uvolnění železa z enterocytů a makrofágů.
Hepcidin, hormon regulující metabolismus železa
Rozhodující roli v regulaci metabolismu železa hraje ale nedávno (v roce 2000, Krause et al., 2000; Park et al., 2001) objevený hormon hepcidin (Ganz et al., 2006; Kemna et al., 2008; Swinkels et al., 2008). Lidé a ostatní savci nemají žádný účinný mechanismus, jak se zbavit nadbytečného železa, regulace zásob železa je uskutečňována na úrovni regulace jeho střevní absorpce. Nedojde-li při zvyšujících se zásobách železa k výraznému omezení jeho další střevní absorpce (jak je tomu u hereditární hemochromatózy), dochází ke kumulaci železa v játrech a řadě dalších orgánů.
Hepcidin je 25-aminokyselinový peptid, produkovaný zejména hepatocyty. Zvýšený příjem železa v dietě (ale i parenterální podání železa) indukuje zvýšenou syntézu hepcidinu v játrech. Molekulární detaily aktivace hepcidinu železem nejsou zcela jasné, určitou roli zřejmě hraje receptor pro transferin 2, receptor pro BMP (bone morphogenetic protein) a rovněž nedávno indentifikovaný protein hemojuvelin. Kongenitální deficit hepcidinu nebo hemojuvelinu vede k hemochromatóze. Vlastním senzorem deficitu železa je zřejmě serinová proteáza matriptáza-2 (TMPRSS6 – Du et al., 2008), která inhibuje produkci hepcidinu prostřednictvím degradace hemojuvelinu (Silvestri et al., 2008).
Hepcidin blokuje uvolňování železa z enterocytů (a tím zastavuje jeho střevní absorpci) i z makrofágů tím, že se váže na ferroportin a indukuje jeho internalizaci a degradaci v lysosomech.
Produkce hepcidinu ale není vázána jen na stav zásob železa. Jaterní syntéza hepcidinu je inhibována u pacientů s anémií a hypoxií, mobilizace železa z trávicího traktu a makrofágů je nezbytná pro aktivaci erytropoézy a dostatečnou účinnost erytropoetinu. Naopak zánět, např. prostřednictvím IL-6, stimuluje jaterní syntézu hepcidinu. Anémie chronických chorob je tak spojena s dlouhodobou stimulací produkce hepcidinu, který inhibuje střevní absorpci železa a uvolňování železa z makrofágů, a významně tak přispívá k rezistenci na erytropoetin.
Sérové koncentrace hepcidinu u pacientů s renální anémií a anémií chronických chorob
Stanovení hepcidinu by významně přispělo k diagnostice anémie chronických chorob a (i u pacientů s chronickým selháním ledvin) k zjištění příčin rezistence na erytropoetin. Hepcidin reaguje např. na zvýšený příjem železa v dietě mnohem rychleji než feritin, informuje nás tedy o krátkodobé regulaci metabolismu železa. Měření hepcidinu ale není (vzhledem k velikosti molekuly a malým rozdílům mezi hepcidinem u různých savčích druhů) snadné.
Pacienti s chronickou renální insuficiencí mají zvýšený sérový prohepcidin (prekursor hepcidinu), ještě vyšší koncentrace prohepcidinu byly nalezeny u dialyzovaných pacientů s chronickým selháním ledvin a po transplantaci ledvin (Malyszko et al., 2006). Koncentrace prohepcidinu ale zřejmě korelují s koncentracemi hepcidinu jen velmi volně a měření prohepcidinu se pro klinickou praxi nedoporučuje.
Vlastní hepcidin lze v současné době spolehlivě měřit pouze pomocí hmotnostní spektrometrie (Swinkles et al., 2008). Pomocí této metody bylo možno prokázat korelaci mezi hepcidinem a feritinem. Podání lipopolysacharidu stimulovalo vzestup sérových koncentrací i močové exkrece hepcidinu, pacienti se sideropenickou anémií měly hodnoty hepcidinu ve srovnání s kontrolami sníženy.
Velmi nedávno byla prezentována první úspěšná imunoanalýza hepcidinu (Ganz et al., 2008; Brugnara, 2008). Pomocí této eseje bylo možno prokázat zvýšené sérové koncentrace hepcidinu u pacientů se zvýšeným CRP, mnohočetným myelomem a chronickým selháním ledvin, naopak u pacientů se sideropenickou anémií byly koncentrace hepcidinu na hranici detekce.
Je tedy zřejmé, že dosavadní informace o koncentracích hepcidinu u pacientů s chronickými zánětlivými onemocněními a s chronickým selháním ledvin jsou z metodických důvodů velmi omezené.
Širší dostupnost imunoeseje (ELISA) by výrazně usnadnila možnost zařadit vyšetření hepcidinu do panelu metod, které bychom mohli mít k dispozici i u našich pacientů s chronickým selháním ledvin s (předpokládanou nebo prokázanou) rezistencí na erytropoetin.
Opakované vyšetření hepcidinu by mohlo odlišit pacienty s akutní elevací hepcidinu v důsledku akutního zánětlivého onemocnění od pacientů s chronickým zánětlivým onemocněním. Sérová koncentrace hepcidinu by se podobně jako CRP mohla stát také jedním z prediktorů prognózy dialyzovaných pacientů. Je také možné, že v budoucnu by u pacientů s dlouhodobě vyššími sérovými koncentracemi hepcidinu mohly být cílové hodnoty hemoglobinu definovány odlišně od pacientů s normálním koncentrací hepcidinu. Na odpovědi na tyto zajímavé a pro naše pacienty důležité otázky si ale budeme muset ještě několi měsíců, event. i let počkat.
Literatura
- Brugnara C. An immunoassay for human serum hepcidin at last.Ganz klar? Blood 2008;112:3922–3923.
- Cooper AC, Mikhail A, Lethbridge MW, et al. Increased expression of erythropoiesis inhibiting cytokines (IFN-γ, TNF-α, IL-10, and IL-13) by T cells in patients exhibiting a poor response to erythropoietin therapy.J Am Soc Nephrol 2003;14:1776–1784.
- Du X, She E, Gelbart T, et al. The serine protease TMPRSS6 is required to sense iron deficiency.Science 2008;320:1088–1092.
- Fleming RE, Bacon BR. Orchestration of iron homeostasis.N Engl J Med 2005;352: 1741–1744.
- Ganz T. Hepcidin and its role in regulating systemic iron metabolism.Hematology Am Soc Hematol Educ Program 2006;29–35.
- Ganz T, Olbina G, Girelli D, et al. Imunoassay for human serum hepcidin.Blood 2008;112:4292–4297.
- Kemna EH, Tjalsma H, Willems HL, et al. Hepcidin: from discovery to differential diagnosis.Hematologica 2008;93:90–97.
- Krause A, Neitz S, Magert HJ, et al. LEAP-1, a novel highly disufide-bonded human peptide, exhibits antimicrobial activity.FEBS Lett 2000;480:147–150.
- López-Gómez JM, Portolés JM, Aljama P. Factors that condition the response to erythropoietin in patients on hemodialysis and their relation to mortality.Kidney Int 2008;74(Suppl 111):S75–S81.
- Macdougall IC, Cooper AC. Erythropoietin resistance: the role of inlammation and proinflammatory cytokines.Nephrol Dial Transplant 2002;17(Suppl II):39–43.
- Macdougall IC, Cooper A. The inflammatory response and epoetin sensitivity.Nephrol Dial Transplant 2002;17(Suppl 1):48–52.
- Malyszko J, Malyszko JS, Pawlak K, et al. Hepcidin, iron status, and renal function in chronic renal failure, kidney transplantation, and hemodialysis.Am J Hematol 2006;81:832–837.
- Park CH, Valone EV, Waring AJ, et al. Hepcidin, a urinary antimicrobial peptide synthesized in the liver.J Biol Chem 2001;276:7806–7810.
- Silvestri L, Pagani A, Nai A, et al. The serine protease matriptase-2 (TMPRSS6) inhibits hepcidin activation by cleaving membrane hemojuvelin.Cell Metab 2008;8:502–511.
- Swinkels DW, Wetzels JFM. Hepcidin: a new tool in the management of anaemia in patients with chronic kidney disease?Nephrol Dial Transplant 2008;23:2450–2453.
- Swinkels DW, Girelli D, Laarakkers C, et al. Advances in quantitative hepcidin measurements by time-of-flight mass spectrometry.PLoS ONE 2008;3(7):e2706.
- Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med 2005;73:1340–1342.
- Kategorie: Novinky v nefrologii
- Klíčová slova: anémie; perspektivy