Vývoj glomerulonefritidy u nemocných s revmatoidní artritidou léčených anti-TNF
Stokes MB, Foster K, Markowitz GS, Ebrahimi F, Hines W, Kaufman D, Moore B, Wolde D, D´Agati VD.: Development of glomerulonephritis during anti-TNF-alpha therapy for rheumatoid arthritis. Nephrol Dial Transplant 2005;20:1400-1406.
Tématem sdělení je problematika nově vzniklé glomerulonefritidy (GN) u nemocných s revmatoidní artritidou (RA) léčených přípravky zaměřenými proti tumor nekrotizujícímu faktoru α (anti-TNF α).
Úvod: TNFα je nejdůležitější prozánětlivý cytokin u mnoha chronických zánětlivých chorob, včetně revmatoidní artritidy, juvenilní RA, ankylozující spondilitidy, psoriatické artritidy a Crohnovy choroby. Léčba anti-TNFα užívaná při terapii RA a dalších revmatických chorob zahrnuje solubilní receptor TNFα - etanercept (Enbrel), dále chimerickou monoklonální antiTNFα protilátku IgG1 - infliximab (Remicade) a plně humanizovanou monoklonální protilátku proti TNFα (Humira). Tyto látky jsou obvykle dobře tolerovány, přičemž nejčastějšími nežádoucími účinky bývají cefalea , reakce v místě vpichu a průjem. Závažnější nežádoucí účinky- těžší infekce, srdeční selhání či neurologické či hematologické poruchy - jsou vzácné (Khanna, 2004). U nezanedbatelného počtu pacientů, léčených látkami anti-TNFα, dochází ke vzniku autoprotilátek, včetně antinukleárních protilátek (ANA, protilátek proti dvojšroubovici DNA (anti-dsDNA), antikardiolipinových protilátek (ACLA), což naznačuje, že TNFα hraje urči tou roli v přirozené imunitní regulaci. Bylo rovněž popsáno několik případů vzniku lupus-like syndromu , bez neurologického či ledvinného postižení. V minulosti byl popsán vznik glomerulonefritidy verifikované renální biopsií u čtyř nemocných léčených látkami anti-TNFα (nálezy: jedenkrát rychle progredující GN s ANCA pozitivitou, jedenkrát membranózní GN, dvakrát IgA nefropatie). Cílem sdělení byl o popsat dalších pět případů, jejichž vznik byl pozorován v časové vazbě na léčbu látkami anti-TNFα.
Metody: Při analýze 7 656 nativních renálních biopsií na od dělení patologické anatomie Kolumbijské univerzity zpracovaných v letech 2000-2004 byly na lezeny čtyři případy nemocných s revmatoidní artritidou a jeden případ nemocné s juvenilní RA, u nichž se vyvinula glomerulonefritida v období, kdy byli tito nemocní léčeni látkami anti-TNFα.
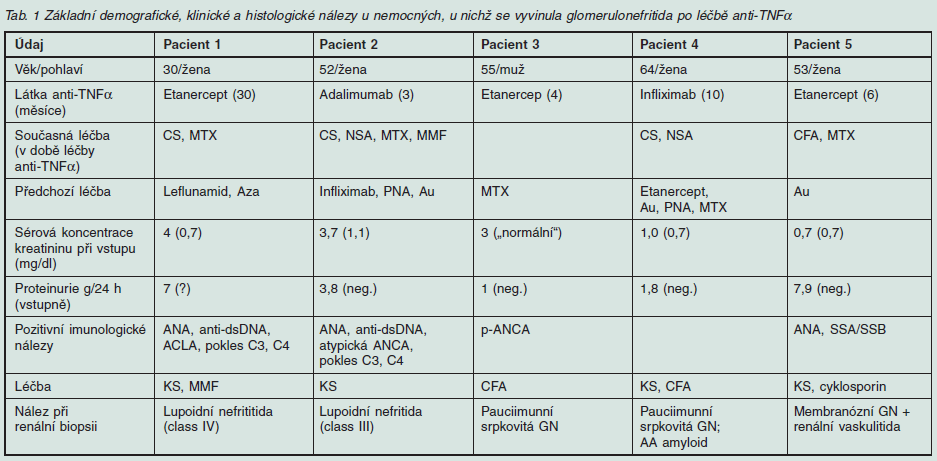
Výsledky: Základní demografické, klinické a histologické nálezy jsou uvedeny v tab. 1. U všech nemocných přesahovala délka trvání revmatického onemocnění deset let (10-30 let). Léčba anti-TNFα látkami trvala řádově měsíce (3-30). Kromě léčby anti-TNFα byli všichni nemocní léčeni dalšími protizánětlivými léky (kortikosteroidy, methotrexatem, nesteroidními antirevmatiky, penicilaminem, mykofenolátem mofetilem, cyklofosfamidem, azathioprinem, leflunamidem či zlatem). Systémové projevy léčby anti-TNFα nebyly u většiny nemocných pozorovány; u nemocného č. 3 se v průběhu léčby objevila alopecie, rash a plicní infiltráty a u nemocného č. 5 senzorická neuropatie. U všech nemocných došlo ke zhoršení renálních funkcí různého stupně, které se pro jevilo vzestupem sérové koncentrace kreatininu, a také ke vzniku proteinurie či jejímu zvýraznění proti předchozímu období. S výjimkou pacienta č. 4 se u všech nemocných objevila pozitivita jedné či více autoprotilátek. Histologické nálezy svědčily u dvou nemocných pro proliferativní formy lupoidní nefritidy (pacienti č. 1, 2), u dalších dvou pro typickou pauciimunní srpkovitou nekrotizující glomerulonefritidu (u nemocných č. 3, 4; v případě nemocné č. 4 v kombinaci s amyloidózou) a v jednom případě (nemocný č. 5) pro membranózní GN s vaskulitickými rysy. S výhradou nemocného č. 3 byla u všech nemocných přerušen a léčba anti-TNFα. U všech nemocných byla zahájena imunosupresivní léčba. V několikaměsíčním rozmezí od provedení renálni biopsie a zahájení imunosupresivní léčby došlo ke zlepšení renálních parametrů (proteinurie, sérové koncentrace kreatininu) u nemocných č. 1, 2, 3 a 5; další akcentace proteinurie (8,5 g/24 h) byla patrna u nemocné č. 4. Nemocný č. 3 vyvinul projevy systémové vaskulitidy a zemřel devět měsíců po biopsii.
Diskuse: U nemocných s revmatoidní artritidou se glomerulonefritida vyvíjí nejčastěji jako součást sekundární amyloidózy, jako komplikace lékové terapie (membranózní GN při léčbě zla tem, penicilaminem, NSA, minimální změny glomerulů při léčbě NSA, p-ANCA pozitivní GN při léčbě PNA), případně se u menší části nemocných , u nich ž se jedná o překryv revmatoidní artritidy a SLE vyvíjí lupoidní nefritida (D'Agati, 1998). Pro etiologickou roli látek anti-TNFα při vývoji glomerulonefritidy svědčí především časová vazba mezi uvedenou léčbou a vznikem GN a sérologických abnormit a dále zlepšení či vymizení GN v případě ukončení léčby anti-TNFα a zahájení imunosupresivní léčby. Lze předpokládat, že na vzniku GN se uplatňuje ne zcela jasným mechanismem porucha regulace imunitního systému , způsobená útlumem TNFα. Z praktického hlediska by tyto nálezy měly vést k pečlivé monitoraci nemocných léčených anti-TNFα látkami s ohledem na včasný záchyt možných projevů nově vzniklé glomerulonefritidy.
ACLA - antikardiolipinové protilátka; ANA - antinukleární protilátka; ANCA - antineutrofilní cytoplazmatická protilátka; Au - zlato; Aza - azatrioprin; CFA - cyklofosfamid; CS - cyklosporin; dsDNA - protilátka proti dvojšroubovici DNA; KS - kortikosteroid; MMF - mykofenolát mofetil; MTX - methotrexat; NSA - nesteroidní protizámětlivá látka; PNA - peniciliamin; SSA/SSB - anti-Rho/anti-La protilátky
Komentář
- Prof. MUDr. Miroslav Merta, CSc., Ph.D., Lékařská fakulta v Hradci Králové
Literatura
- Aringer M, Graninger WB, Steiner G, Smolen JS. Safety and efficacy of tumor necrosis factor alpha blockade in systemic lupus erythematosus: an open-label study. Arthritis Rheum 2004; 50: 3161-3169.
- D´Agati VD. Renal disease in systemic lupus erythematosus, mixed connective tissue disease, Sjogrenís syndrome, and rheumatoid arthritis. In: Jennette JC, Olsen JL, Schwartz MM, et al. Heptinstallís Pathology of the Kidney, vol 1. Philadelphia, Lippincott-Raven, 1998:541-624.
- Ehrenstein MR, Evans JG, Singh A, et al. Compromised function of regulatory T cells in rheumatoid arthritis and reversal by anti-TNFalpha therapy. J Exp Med 2004;200:277-285.
- Charles PJ, Smeenk RJ, De Jong J, Feldmann M, Maini RN. Assessment of antibodies to double-stranded DNA induced in rheumatoid arthritis patients following treatment with infliximab, a monoclonal antibody to tumor necrosis factor alpha: findings in open-label and randomized placebocontrolled trials. Arthritis Rheum 2000;43:2383-2390.
- Khanna D, McMahon M, Furst DE. Safety of tumour necrosis factor-alpha antagonists. Drug Saf 2004;27:307-324.
- Kategorie: Komentované články
- Klíčová slova: antirevmatika; glomerulopatie
Komentovaná práce upozorňuje na výskyt ledvinného, imunitně podmíněného postižení typu glomerulonefritidy jakožto projevu možné komplikace terapie anti-TNFα u nemocných s revmatoidní artritidou. Účinnost látek působících proti TNFα je u revmatoidní artritidy a dalších revmatických onemocnění v současnosti již dobře dokumentována a je prověřen i jejich příznivý bezpečnostní profil. Proto si vydobyly výsadní místo v rámci celé skupiny léčiv nazývaných DMARD (z angl. disease modifying antirheumatic drugs). U některých nemocných s RA, u nichž byla zahájena léčba anti-TNFα, byl pozorován nejen vývoj autoprotilátek, ale také klinických projevů (např. kožní leukocytoklastické vaskulitidy, nodulámího postižení při RA). S jistotou nelze rozhodnout, zda uvedená klinická pozorováni byla projevem přirozeného průběhu onemocnění či podmíněna účinkem právě probíhající anti-TNFα léčby. Obdobný stupeň nejistoty skýtá úvaha o původu/příčině glornerulonefritidy u nemocných s revmatoidní artritidou léčených antiTNFα - neboť GN typu lupoidní nefritidy, pauciimunní srpkovité GN či membranózní GN bývají rovněž diagnostikovány u řady nemocných s RA, kteří nejsou léčeni anti-TNFα. Časová vazba na právě probíhající léčbu nti-TNFα a poměrně 1ychlý ústup renálního postižení v případě ukončení této léčby jsou hlavními důkazy ve prospěch kauzální souvislosti obou dějů. Pokud bychom tuto vazbu připustili, pak by bylo třeba uvažovat o možných mechanismech, jimiž se léčba anti-TNFα na vzniku glomerulonefritidy uplatňuje. Důležitou okolností je, že ledvinné postižení typu GN bylo pozorováno při léčbě různými látkami anti-TNFα. Jako jeden možný mechanismus byla uvedena představa, že navázání infliximabu na TNFα na plazmatických membránách imunitních buněk může vyvolat apoptózu s uvolněním imunogenních nukleosomálních antigenů, které mohou vést k tvorbě antidsDNA (Charles, 2000). Jiný koncept předpokládá, že v důsledku snížených koncentrací C-reaktivního proteinu (působením látek anti-TNFα) nedochází k dostatečné očistě organismu od apoptotických buněk, a vytváří se tak zvýšená imunogenní zátěž (Ehrenstein, 2004). Nálezy nasvědčující tomu, že terapie antiTNFα může vést ke vzniku autoimunitního procesu, jsou však současně v určitém protikladu k opačným pozorováním, svědčícím pro to, že léčbou anti-TNFα lze u myšího modelu potlačit projevy systémového lupusu (SLE). Rovněž klinické zkušenosti u nemocných se SLE ukazují, že koncentrace TNFα a solubilních receptorů pro TNFα korelují se závažností choroby a také s tím, že po léčbě infliximabem dochází k jejich poklesu (Aringer, 2004). Závěrem lze uvedená pozorování a úvahy shrnout v tom smyslu, že je možné předpokládat, že u predisponovaných jedinců mohou v důsledku léčby anti-TNFα vzniknout projevy autoimunitního poškození, projevující se také specifickými formami glomerulonefritidy.