Infekce močových cest u dětí
SOUHRN
Močové infekce patří mezi nejčastější infekce dětského věku. V prvním roce života se vyskytují stejně často u obou pohlaví, v pozdějším věku jsou častěji postiženy dívky. Nejčastějším původcem infekcí močových cest (IMC) je Escherichia coli. Na základě anamnézy, fyzikálního vyšetření a chemického vyšetření moči diagnostickým proužkem můžeme s vysokou pravděpodobností na přítomnost IMC usuzovat. Zvolení správného způsobu odběru moči k mikrobiologickému vyšetření je stěžejní pro přesnost diagnostiky močové infekce a snížení rizika falešně pozitivních nálezů. Časné nasazení antibiotické terapie je hlavním principem léčby IMC. Volba antibiotika závisí na typu infekce a lokální citlivosti původců. Komplikované formy akutní pyelonefritidy vyžadují delší dobu antibiotické léčby, případně i intervenci radiologa či urologa. V případě rekurentních IMC je zapotřebí se zaměřit na vyloučení abnormalit močového traktu a dysfunkce močového měchýře a střeva. Riziko dlouhodobých následků v souvislosti s renálním jizvením mají hlavně jedinci s oboustranným postižením ledvin. Tento přehledový článek shrnuje současné poznatky o etiologii, diagnostice i léčbě IMC u dětí.
Klíčová slova: dysfunkce močového měchýře a střeva – infekce močových cest – jizvení ledvin – rekurentní močové infekce – vezikoureterální reflux
Úvod
Infekce močových cest (IMC) představují jednu z nejčastějších bakteriálních infekcí dětského věku. Můžeme je rozdělit do dvou základních skupin: infekce horního segmentu (ledvin) – akutní pyelonefritida – a infekce dolního segmentu – akutní cystitida. Právě toto odlišení dle klinických a laboratorních parametrů je důležité pro zvolení adekvátního léčebného postupu a další dispenzarizaci pacienta (tab. 1). Správné zařazení typu IMC bývá obtížnější hlavně u novorozenců a kojenců. Febrilní IMC může vést k jizvení ledvin s významnými následky pro pacienta, proto je potřeba věnovat pozornost včasné diagnostice a léčbě. U dětí s opakovanými IMC je nutné aktivně pátrat po jejich příčině a bránit tak recidivám.
Etiologie
Nejčastějším původcem močových infekcí je gramnegativní tyčinkovitá bakterie Escherichia coli, jež je přirozenou součástí střevní mikroflóry člověka.1 Mezi další vyvolavatele patří gramnegativní bakterie Klebsiella, Proteus, Enterobacter, Pseudomonas a grampozitivní bakterie Staphylococcus a Enterococcus. Vzácněji se etiologicky uplatní viry – adenovirus, BK virus, coxsackie obvykle u imunosuprimovaných jedinců. U pacientů recentně léčených antibiotiky pro IMC, imunosuprimovaných dětí a u nemocných se zavedeným močovým katétrem můžeme nalézt mykotického původce, nejčastěji je jím Candida a Aspergillus.2 Urogenitální tuberkulóza dětí je v našich podmínkách velmi vzácná.
Výskyt
Prevalence IMC je přibližně 7 % u febrilních kojenců a malých dětí. Četnost závisí na pohlaví, věku a u chlapců na skutečnosti, zda jim byla provedena cirkumcize. Ve věku do tří měsíců nejčastěji onemocní IMC chlapci bez cirkumcize. Obecně v prvním roce života jsou IMC postiženi chlapci a dívky rovnoměrně, v pozdějším věku se močové infekce vyskytují častěji u dívek.3 Prevalence IMC stoupá poté hlavně u dívek v adolescentním věku v souvislosti se zahájením sexuální aktivity. Více než 30 % dětí trpí následně opakovanými močovými infekcemi.4
Patogeneze
Nejčastější příčinou IMC je ascendentní infekce. Periuretrální oblast je kolonizována uropatogenními enterickými kmeny bakterií, které se retrográdním pohybem přes uretru dostávají do močového měchýře, případně poté do horního segmentu uropoetického traktu. Dívky mají v porovnání s chlapci kratší uretru a významnější bakteriální kolonizaci periuretrální oblasti, proto je u nich vznik ascendentní infekce snazší. U chlapců zase preputium představuje potenciální rezervoár bakteriálních patogenů. Bakterie mohou být do močových cest zaneseny také při katetrizaci močového měchýře. Hematogenní IMC se vyskytují významně méně často, a to hlavně u dětí v prvních měsících života pod obrazem sepse.
IMC vzniká v důsledku nerovnováhy mezi virulencí bakterií a obrannými faktory hostitele. Escherichia coli je vybavena fimbriemi, které jí umožňují navázat se na buňky uroepitelu a setrvávat v urotraktu navzdory proudění moči. Mezi další významné faktory přispívající ke vzniku IMC na straně uropatogenních organismů patří α‑hemolysin, M‑hemaglutinin a endotoxin. Po invazi uroepitelu patogeny dochází k tvorbě intracelulárního biofilmu, který chrání bakterii před imunitním systémem hostitele. Lokální obranné mechanismy představují místní produkce hlenu a sekrece antimikrobiálních peptidů – katelicidinu a α‑defensinu. Navíc dochází v uroepitelu k expresi toll‑like receptorů se schopností rozeznávat molekulární znaky patogenu a spustit signální kaskádu s následnou produkcí cytokinů, chemokinů a aktivací lymfocytů.5 Buňky urotelu produkují interleukin 8, jenž je zodpovědný za kumulaci a aktivaci neutrofilů. Dále je buňkami epitelu tvořen i interleukin 6, který aktivuje C‑reaktivní protein (CRP) a stimuluje produkci slizničního imunoglobulinu A (IgA).6 Samotný proud moči a dostatečné vyprazdňování močového měchýře také brání invazi i adhezi patogenů, proto právě obstrukční uropatie a dysfunkce močového měchýře představují jeden z hlavních rizikových faktorů vzniku močových infekcí. Děti s imunodeficiencemi vzácně trpí opakovanými IMC, jelikož specifická imunita nehraje natolik zásadní roli v ochraně před vznikem IMC.
Klinický obraz
Symptomatologie IMC je značně heterogenní a závisí na lokalizaci postižení – horní nebo dolní segment – i na věku dítěte. V některých případech, častěji u malých dětí, je správná diagnóza určena se zpožděním. Horečka je hlavním příznakem dětí s akutní pyelonefritidou. Starší děti si obvykle také stěžují na bolest břicha či v bedrech, u mladších dětí pozorujeme spíše bolest břicha, případně nechutenství a zvracení. Pacienti s akutní cystitidou udávají často dysurické obtíže – bolesti při močení, bolesti v podbřišku, pociťují také časté nutkání k mikci – polakisurii. Mohou mít rovněž bolesti vyzařující do beder, horečka ale obvykle není průvodním symptomem akutního zánětu močového měchýře. Je nutno mít na paměti, že infekce mimo močový trakt nevylučuje souběžnou IMC.7 Velmi nespecifické mohou být příznaky IMC u novorozenců, někteří vykazují známky sepse, část z nich může být subfebrilní či afebrilní. Také intolerance stravy, zvracení, podrážděnost, hypotermie či protrahovaný ikterus patří mezi symptomy IMC v této věkové kategorii.8
Diagnostika
Fyzikální vyšetření
Fyzikální vyšetření může být u dětí s IMC velmi nespecifické. Vzácně lze palpovat rezistenci např. v případě zvětšené ledviny či močového měchýře. U starších dětí může palpace břicha vyvolávat bolesti a diskomfort. Důležité je vyšetření zevních genitálií a perinea, kde je možné odhalit anatomické abnormality, balanitidu, vulvovaginitidu, synechie vulvy a další. Důležitá je také aspekce sakrální oblasti vzhledem k tomu, že patologie v této oblasti se často druží s diagnózou neurogenního močového mechýře.7
Mikrobiologické vyšetření
Diagnóza IMC je založena na přítomnosti klinických příznaků a nálezu signifikantního počtu bakterií v moči. Odběr moči na kultivaci musí předcházet zahájení antibiotické léčby. U starších dětí se nejčastěji používá záchyt středního proudu moči. Při tomto způsobu odběru moči dochází u části pacientů ke kontaminaci mikroby z preputia či z vaginální flóry. Před odběrem je proto vhodné omýt okolí ústí močové trubice mýdlovou vodou, riziko kontaminace vzorku moči u chlapců dále snižuje přetažení předkožky během odběru. Vyšetření moči ze středního proudu je možné i u prekontinentních dětí (kojenců a malých batolat), je však nutno brát v potaz přibližně 25% riziko kontaminace vzorku moči.9 Nález více než jednoho bakteriálního kmene v kultivačním vyšetření moči je suspektní z kontaminace vzorku.2 Odběru středního proudu moči lze využít i u mladších dětí. Ke stimulaci mikce u novorozenců a kojenců byly navrženy některé manévry (taktilní stimulace v suprapubické oblasti, paravertebrální masáž v lumbální oblasti). Nevhodný je však odběr moči k mikrobiologickému vyšetření do sběrného sáčku, jelikož je zatížen vysokým rizikem kontaminace. Tento způsob odběru je namístě pouze v případě screeningového chemického vyšetření moči, které by mělo být před zahájením antibiotické léčby potvrzeno invazivním odběrem kultivace moči.10 Pokud provedení neinvazivního odběru není možné či vhodné, přistupujeme u kojenců a malých batolat k jednorázové katetrizaci močového měchýře. Za zlatý standard odběru moči s minimálním rizikem kontaminace je považována suprapubická punkce s použitím ultrazvuku, tato metoda ale nemá v naší zemi tradici.11
Za signifikantní bakteriurii byl již od 50. let 20. století považován počet bakterií ≥ 105/ml moči v cévkované moči. U 20 % malých dětí s močovou infekcí byl však zjištěn počet bakterií nižší.12 Hodnocení bakteriurie závisí na způsobu odběru moči, liší se regionálně i v rámci doporučení jednotlivých odborných společností. Americká pediatrická společnost považuje za signifikantní počet bakterií 5 × 104/ml moči s nálezem pyurie odebrané katetrizací, Evropská dětská urologická společnost považuje i nižší hodnoty za významné.13 Při odběru moči suprapubickou punkcí je obvykle jakákoliv kvantita mikrobů v moči považována za signifikantní. Obzvláště u imunokompromitovaných pacientů, u nichž nebyl vykultivován patogen, je nutno pomýšlet na virovou etiologii. K průkazu virů lze využít kultivaci, častěji však metodu PCR ze vzorku moči.2
Chemické vyšetření moči
Chemické vyšetření moči je obvykle prvním laboratorním vyšetřením, které lze použít při podezření na IMC. Lékaři prvního kontaktu mají k dispozici testační proužky, kterými mohou v moči detekovat řadu analytů. U většiny pacientů s IMC nacházíme ve vzorku moči leukocyturii, ale často se opomíjí, že u asi 10 % nemocných není počet leukocytů v moči zvýšený.11 Jedná se obvykle o infekce, které nejsou vyvolány E. coli. Většina patogenů produkuje nitrit reduktázu, enzym, který katalyzuje přeměnu nitrátů na nitrity, jež jsou následně taktéž detekovány diagnostickými proužky. Klebsiella a Enterecoccus tento enzym neprodukují. Pozitivita nitritové reakce je také méně spolehlivá u kojenců, u kterých dochází při infekci k časté mikci. Nitritový test je vysoce specifický, má ale nízkou senzitivitu. Právě detekce leukocyturie a nitritů patří mezi hlavní diagnostické parametry IMC.10 V diagnostice IMC využíváme také krevní markery – elevace hodnot C‑reaktivního proteinu (CRP), prokalcitoninu a leukocytóza v krevním obraze jsou obvykle přítomny u dětí s akutní pyelonefritidou na rozdíl od jedinců s infekcí dolního segmentu močového traktu.
Asymptomatická bakteriurie
V rámci diagnostiky IMC je nutné vyloučit asymptomatickou bakteriurii, jež je definována jako nález signifikantní bakteriurie ve dvou po sobě odebraných vzorcích moči u dítěte bez klinických známek IMC a nálezu patologické leukocyturie. Její incidence je u dětí významně nižší než incidence IMC. Kultivačně se obvykle prokáže E. coli. U dítěte s horečkou jiné etiologie je odlišení asymptomatické bakteriurie od IMC velmi obtížné. Bakteriální kmeny E. coli spojené s asymptomatickou bakteriurií jsou méně virulentní a jejich fimbrie jsou kódovány odlišnými geny než kmeny vyvolávající IMC.2,14 V současné době probíhá výzkum močových biomarkerů k odlišení asymptomatické bakteriurie od IMC.
Sterilní pyurie
Sterilní pyurie je definována jako nález zvýšeného počtu leukocytů v moči u pacienta s negativní močovou kultivací. Může se objevit u dětí s částečně odléčenou močovou infekcí, apendicitidou, tuberkulózou, Kawasakiho nemocí, eventuálně v případě virové, mykotické či parazitární IMC. Dále může doprovázet imunopatologické stavy, jako je systémový lupus erythematodes, glomerulonefritidy, Kawasakiho nemoc, či intersticiální nefritidu, analgetickou nefropatii, nefrolitiázu, případně vzniká v souvislosti s přítomností cizího tělesa v močových cestách.14
Zobrazovací metody
Hlavním cílem využití zobrazovacích metod v rámci diagnostiky IMC je vyloučení vrozených vývojových vad urotraktu a komplikovaných forem IMC. Nejvíce využívána je sonografie, která je vhodná pro svoji neinvazivitu a absenci ionizujícího záření. Ultrazvukem posoudíme velikost ledvin, stav parenchymu, šířku pánvičky, kalichů, případně močovodů a stěny močového měchýře. Ultrazvuk provádíme obvykle časně u pacientů s febrilní IMC a následně eventuálně v závislosti na klinickém stavu nemocného. K diagnostice akutní pyelonefritidy lze využít také statickou scintigrafii ledvin 99mTcDMSA, nicméně toto vyšetření je spojeno s ionizujícím zářením a horší dostupností, proto se v rámci diagnostiky využívá pouze výjimečně. Statickou scintigrafii indikujeme častěji k detekci renálního jizvení s odstupem času od proběhlé infekce. Mikční cystouretrografie (MCUG) je rentgenové vyšetření spojené s podáním rentgen kontrastní látky do močového měchýře po jeho katetrizaci. Jedná se o zlatý standard detekce vezikoureterálního refluxu (VUR). V průběhu času se indikace MCUG významně zúžily, ale stále nejsou názory na nutnost provedení tohoto vyšetření jednotné. V současnosti MCUG provádíme na našem pracovišti v souladu s postupem Americké pediatrické společnosti u dětí s opakovanými akutními pyelonefritidami, dále u pacientů se závažným či atypickým průběhem IMC, etiologií jinou než E. coli či u jedinců se zjevnou anatomickou abnormalitou diagnostikovanou sonografickým vyšetřením – dilatace vývodného močového systému, hypo‑/dysplazie ledviny, patologie močového měchýře a další.10 MCUG lze vyšetřit časně u pacienta se zaléčenou IMC nebo s odstupem času od proběhlé infekce.
Diferenciální diagnostika
Na akutní pyelonefritidu by mělo být včas pomýšleno v rámci diferenciální diagnostiky febrilního dítěte. Velmi důležité je provést odběr vzorku moči k mikrobiologickému a biochemickému vyšetření před zahájením antibiotické léčby. Dysurické obtíže či leukocyturie, příznaky typické pro akutní cystitidu, mohou být přítomny i u řady dalších onemocnění (tab. 2). U dětí s přetrvávající hematurií či proteinurií bez nálezu infekční příčiny je nutno pomýšlet na jiná renální neinfekční onemocnění. V případě polakisurických obtíží, urgencí a inkontinence u dětí s negativní kultivací moči je důležité vyloučit často opomíjenou diagnózu – dysfunkci mikce. U adolescentů je potřeba zvážit také sexuálně přenosné choroby vyvolávající symptomatickou uretritidu. Nejčastěji se uplatňují Neisseria gonorrhoeae, Chlamydia trachomatis, Ureaplasma urealyticum a Trichomonas vaginalis.
Léčba a prevence
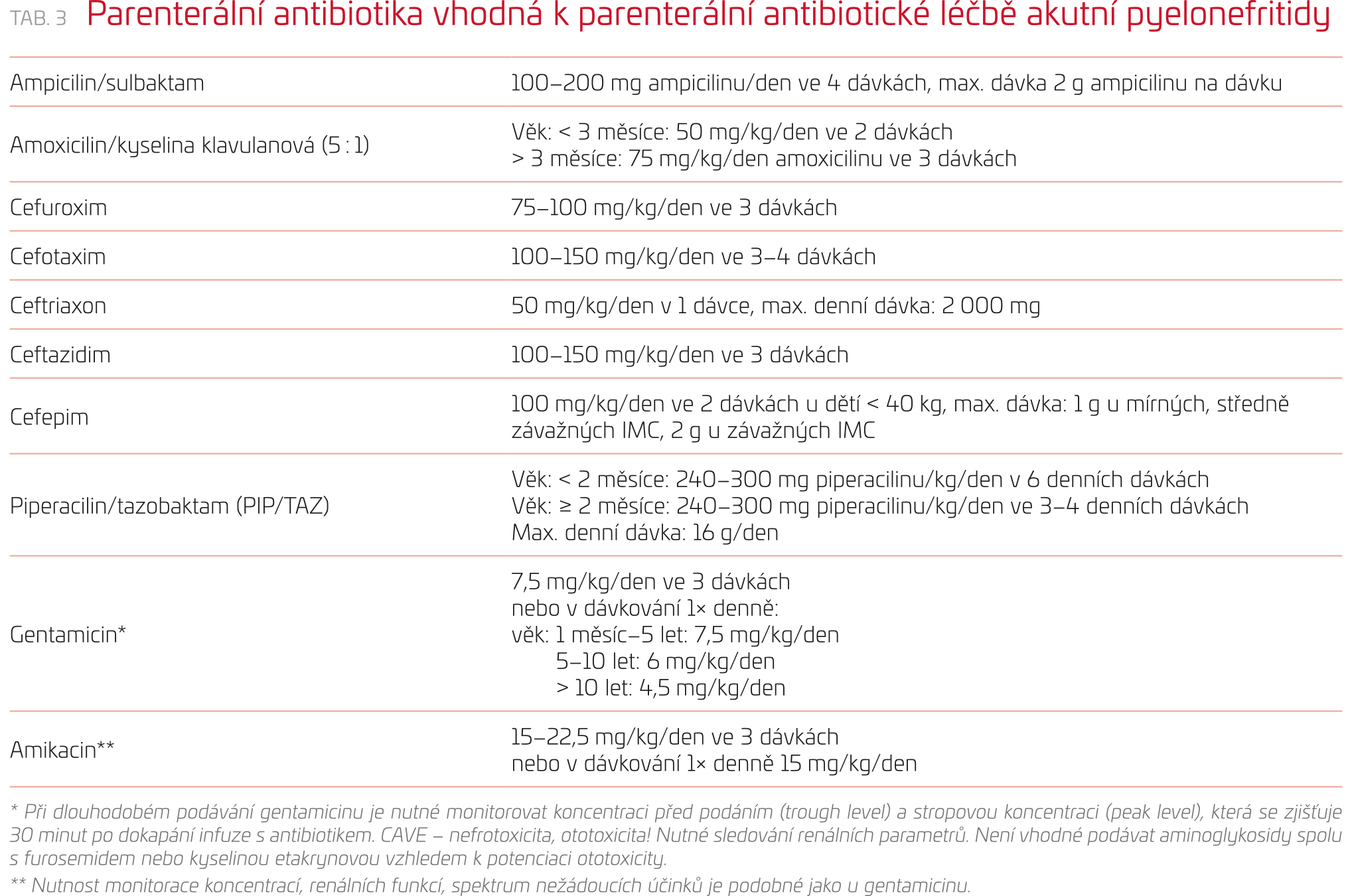
Včasně nasazená antibiotika spolu se symptomatickou terapií (rehydratace, antipyretika) představují léčbu IMC. Nejčastěji užívaná antibiotika shrnují tabulky 3–5. Odklad v podání antibiotik o více než 48 hodin je spojen s vyšším rizikem vzniku renálního jizvení (o 47 %).16 Výběr antibiotik se řídí závažností průběhu infekce, výsledky vyšetření, lokální citlivostí původců IMC k antibiotikům a předchozí anamnézou pacienta. U dětí s akutní pyelonefritidou empiricky zahajujeme terapii širokospektrým antibiotikem (tab. 3). Hlavně díky široké preskripci antibiotik narůstá rezistence původců IMC na antibiotika, což často komplikuje terapii nejen močových infekcí. Volba antibiotika závisí na lokální bakteriální citlivosti. Parenterální podání antibiotik je iniciálně vhodné u malých kojenců mladších dvou až tří měsíců, u dětí se závažným průběhem IMC – urosepse, v případě dehydratace s nemožností perorální rehydratace, u nemocných s intolerancí perorálních antibiotik či tekutin a také u pacientů, u nichž nemůže být zajištěna adekvátní péče ze strany pečující osoby. Většině dětí lze tedy již od počátku podávat antibiotika per os.17 Pacienty léčené iniciálně parenterálně je po stabilizaci klinického stavu možné převést na perorální terapii. Významné zlepšení klinického stavu pozorujeme obvykle do 24–48 hodin od zahájení podávání antibiotik. U malé části dětí mohou horečky přetrvávat i po 48 hodinách navzdory účinné léčbě. V těchto případech je zapotřebí přehodnotit stávající terapii a provést ultrazvuk ledvin k vyloučení komplikací infekce.2 Vhodná doba antibiotické léčby u imunokompetentních dětí s akutní pyelonefritidou je 10–14 dní. Akutní cystitidu léčíme antibiotiky s úzkým antimikrobiálním spektrem (tab. 3). Doporučená doba antibiotické léčby akutní cystitidy není jednotná, tří‑ až pětidenní užívání antibiotik se v současné době zdá racionální ve většině případů.
Komplikace
V některých případech může dojít k rozvoji komplikací akutní pyelonefritidy. Klinicky mohou být hlavně zpočátku tato onemocnění neodlišitelná od prostého zánětu ledvin či mohou napodobovat jiný nitrobřišní zánětlivý proces či tumor. Mezi nejčastější patří rozvoj akutní fokální pyelonefritidy (lobární nefronie), vzácněji může dojít ke vzniku renálního abscesu. Výjimečně se můžeme setkat s xantogranulomatózní pyelonefritidou, jež představuje závažnou formu postižení ledviny granulomatózním zánětem s přítomností makrofágů s vysokým obsahem lipidů obvykle v terénu obstrukce močových cest či litiázy. Pokud je toto onemocnění lokalizováno, může imitovat tumor, v některých případech zasahuje parenchym celé ledviny. Horečka, bolesti břicha a celkové neprospívání představují hlavní příznaky této nemoci u dětí.18 Zcela výjimečně byla v dětském věku zjištěna emfyzematózní pyelonefritida, nekrotizující infekce ledvin s produkcí plynu. Původci této formy IMC jsou běžné patogeny močových infekcí.
Akutní fokální bakteriální nefritida
Akutní fokální bakteriální nefritida je charakterizována lokálním zánětlivým ložiskem bez kolikvace v ledvinném parenchymu. Postihuje obvykle jeden či více ledvinných laloků a představuje přechodovou formu zánětu mezi akutní pyelonefritidou a renálním abscesem. Diagnostikuje se zpravidla sonograficky jako hyperechogenní, izoechogenní či hypoechogenní ložisko. Při diagnostických rozpacích je namístě provedení vyšetření MR nebo CT. Etiologicky se nejčastěji uplatňuje E. coli. Léčebný přístup v případě této diagnostické jednotky není jednotný, doporučuje se delší celková doba antibiotické terapie (3 týdny), z toho parenterální podávání ještě 2–3 dny po vymizení horeček.19
Renální absces
Renální absces je ohraničený ložiskový hnisavý proces v renálním parenchymu. Jedná se o vzácnou komplikaci IMC, jež vzniká častěji následkem ascendentní močové infekce či hematogenním rozsevem. E. coli, Staphylococcus aureus, případně anaerobní bakterie představují nejčastější původce. Mezi predispozice patří vrozené vady urotraktu, urolitiáza a porucha imunity. Pacienti mívají výrazné systémové projevy infekce a při laboratorním vyšetření nacházíme často významně zvýšené zánětlivé parametry a leukocytózu v krevním obraze. Mezi hlavní diagnostické zobrazovací metody patří sonografie, magnetická rezonance (MR) a výpočetní tomografie (CT). Včasná diagnostika a terapie renálního abscesu jsou důležité, jelikož se jedná o život ohrožující stav. V léčbě využíváme antibiotika, případně perkutánní či otevřenou drenáž abscesového ložiska. U většiny pacientů je dostačující konzervativní terapie – podávání antibiotik po dostatečně dlouhou dobu, indikace drenáže závisí na velikosti abscesu, případně na vývoji klinického stavu pacienta.20
Rekurentní močové infekce
Jednu nebo více epizod močové infekce po atace IMC prodělá 8–30 % dětí. Včasná diagnostika i nasazení adekvátní léčby jsou zásadní hlavně pro zabránění vzniku nevratných změn renálního parenchymu v podobě jizvení. Rodiče dětí s rizikem opakovaných IMC musejí být poučeni o včasném vyhledání lékaře v případě výskytu symptomů. Velmi důležitá je identifikace dětí s dysfunkcí měchýře a střeva (DMS), jež je jedním z nejvýznamnějších rizikových faktorů vzniku opakovaných IMC. Společná přítomnost DMS a vezikoureterálního refluxu pravděpodobnost vzniku IMC ještě zvyšuje. V neposlední řadě se snažíme u pacientů s opakovanými febrilními infekcemi identifikovat trvalé změny v ledvinné tkáni v podobě renálního jizvení.11
Dysfunkce močového měchýře a střeva
Dysfunkce močového měchýře a střeva je charakterizována poruchou vyprazdňování močového měchýře a střeva u dětí, jež se již naučily chodit na toaletu a které nemají žádnou anatomickou vadu či neurologickou poruchu urotraktu. DMS je velmi častá, nacházíme ji u 30–50 % dětí s první močovou infekcí a u poloviny dětí s VUR.21 Přispívá ke vzniku IMC u dětí léčených dlouhodobě antibiotickou profylaxí a snižuje významně úspěšnost endoskopické léčby VUR. Diagnostika spočívá v důkladné anamnéze zaměřené hlavně na příznaky obstipace a denních mikčních poruch. K tomuto účelu byly vypracovány i speciální dotazníky.22 V současné době máme k dispozici dostatek dat prokazujících asociaci DMS se sekundárním VUR, s recidivujícími IMC a s jizvením renálního parenchymu. Terapie spočívá ve farmakologické léčbě obstipace a v režimových opatřeních (např. mikce v pravidelných intervalech). V některých případech je namístě multidisciplinární péče.11
Vezikoureterální reflux
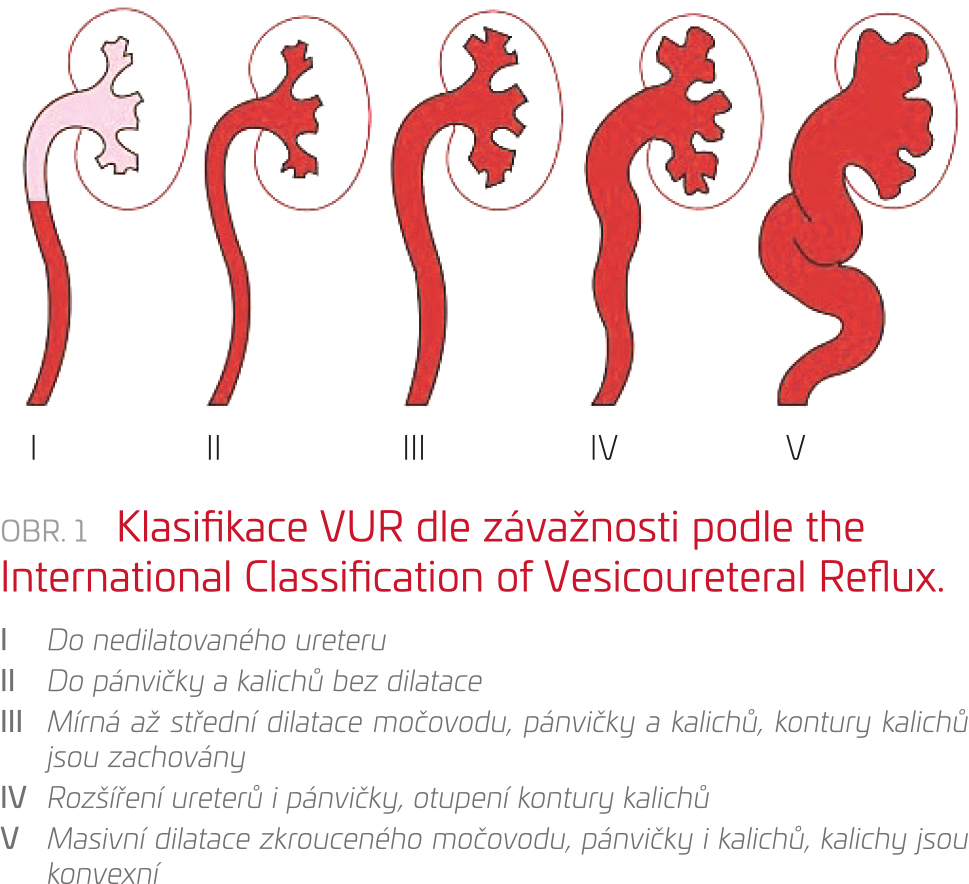
Vezikoureterální reflux je definován jako zpětný tok moči do jednoho či obou močovodů, eventuálně do dutého systému ledviny. Podle závažnosti jej lze rozdělit do pěti stupňů (obr. 1). Zatímco VUR 1. stupně představuje reflux moči pouze do distálního ureteru, VUR 5. stupně je spojen s významnou dilatací močovodu, pánvičky i kalichů. VUR (obzvláště vyššího stupně) je považován za rizikový faktor vzniku opakovaných IMC a jizvení ledvin jako trvalého následku močových infekcí. Prevalence VUR v pediatrické populaci není známa, u 25–40 % dětí po prodělání akutní pyelonefritidy byl VUR zjištěn.23 Z hlediska patogeneze lze rozlišit dva základní typy VUR:
- Primární VUR – vzniká v důsledku insuficience ureterovezikální junkce, příčinou je krátký segment intravezikálního ureteru.
- Sekundární VUR – vzniká v souvislosti s vysokými intravezikálními tlaky, což vede k poruše uzávěru ureterovezikální junkce během kontrakce močového měchýře.
Primární VUR se v průběhu času spontánně upravuje a obvykle nakonec zcela vymizí. V případě VUR vyššího stupně je tato doba delší a k úplné úpravě dojít nemusí. U dětí se sekundárním VUR je nejčastěji příčinou porucha funkce močového měchýře, u těchto pacientů je namístě podrobné urologické vyšetření k objasnění příčiny a zahájení adekvátní léčby. Cílem léčby dětí s VUR je snížit počet IMC, hospitalizací a jizvení ledvin. U pacientů s primárním VUR a opakovanými IMC máme v současnosti k dispozici tři léčebné přístupy:
- observaci;
- antibiotickou profylaxi;
- chirurgickou korekci VUR.
Smyslem podávání antibiotické profylaxe (tab. 6) je sterilizace moči antibiotikem s úzkým spektrem jako prevence vzniku IMC. Výsledky studií s podáváním profylaxe jsou rozporuplné a její podávání lze doporučit obzvláště u dětí s VUR vyššího stupně a opakovanými močovými infekcemi. Hlavním nežádoucím účinkem antibiotické profylaxe je vznik antibiotické rezistence. Mezi chirurgické metody korekce VUR řadíme endoskopickou podslizniční instilaci biokompatibilního materiálu a otevřenou reimplantaci močovodu. Pro podávání brusinkového džusu v rámci prevence rekurence IMC u dětí není dostatek podpůrných dat. Obdobně pro účinek probiotik v terapii rekurentních IMC máme k dispozici pouze omezené množství důkazů. Přístup k léčbě dětí s opakovanými IMC by měl být předmětem spolupráce dětského nefrologa, urologa, eventuálně gastroenterologa či neurologa.24
Dlouhodobé následky jizvení ledvin
Renální jizvení detekovatelné statickou scintigrafií 99mTcDMSA může vznikat prenatálně jako následek dysplazie ledviny nebo v souvislosti s akutním zánětem renálního parenchymu. U dětí s první atakou akutní pyelonefritidy bez urogenitální vrozené vady je však prevalence jizvení v souvislosti s vrozenou dysplazií ledviny diagnostikovaná vyšetřením 99mTcDMSA velmi nízká. Pacienti s VUR mají obecně vyšší riziko rozvoje akutní pyelonefritidy a renálního jizvení, a hlavně opakované febrilní IMC jsou spojeny s větší mírou jizvení ledvin. Pozoruhodné je, že u některých dětí s akutní pyelonefritidou nacházíme jizvy i při absenci VUR, který tedy není jediným rizikovým faktorem renálního jizvení. Mezi rizikové faktory vzniku ledvinných jizev patří VUR vyššího stupně, doba trvání horeček > 48 hodin před zahájením podávání antibiotika, opakované IMC a jiný vyvolavatel než E. coli.14 Pohled na rizika spojená s dlouhodobým jizvením ledvin není mezi odborníky jednotný. Mezi hlavní následky jizvení ledvin patří snížená glomerulární filtrace, hypertenze a obtíže v graviditě (hypertenze). Na základě současného poznání se zdá, že vyšší riziko vzniku chronických následků mají obzvláště jedinci s oboustranným jizvením ledvin. Pacienti s renálním jizvením by měli být dlouhodobě dispenzarizováni s cílem časné identifikace následků.23
Literatura
- Edlin RS, Shapiro DJ, Hersh AL, Copp HL. Antibiotic resistance patterns of outpatient pediatric urinary tract infections. J Urol 2013;190:222–227.
- Kaufman J, Temple‑Smith M, Sanci L. Urinary tract infections in children: an overview of diagnosis and management. BMJ Paediatr Open 2019;3:e000487.
- Shaikh N, Morone NE, Bost JE, Farrell MH. Prevalence of urinary tract infection in childhood: a meta‑analysis. Pediatr Infect Dis J 2008;27:302–308.
- Keren R, Shaikh N, Pohl H, et al. Risk Factors for Recurrent Urinary Tract Infection and Renal Scarring. Pediatrics 2015;136:e13–e21.
- Samuelsson P, Hang L, Wullt B, et al. Toll‑like receptor 4 expression and cytokine responses in the human urinary tract mucosa. Infect Immun 2004;72:3179–3186.
- Ragnarsdóttir B, Svanborg C. Susceptibility to acute pyelonephritis or asymptomatic bacteriuria: host‑pathogen interaction in urinary tract infections. Pediatr Nephrol 2012;27:2017–2029.
- Simões E Silva AC, Oliveira EA, Mak RH. Urinary tract infection in pediatrics: an overview. J Pediatr (Rio J) 2020;96(Suppl 1):65–79.
- Saadeh SA, Mattoo TK. Managing urinary tract infections. Pediatr Nephrol 2011;26:1967–1976.
- Tosif S, Baker A, Oakley E, et al. Contamination rates of different urine collection methods for the diagnosis of urinary tract infections in young children: an observational cohort study. J Paediatr Child Health 2012;48:659–664.
- Subcommittee on Urinary Tract Infection SCoQI, Management, Roberts KB. Urinary tract infection: clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics 2011;128:595–610.
- Tullus K, Shaikh N. Urinary tract infections in children. Lancet 2020;395:1659–1668.
- Tullus K. Low urinary bacterial counts: do they count? Pediatr Nephrol 2016;31:171–174.
- Subcommittee On Urinary Tract I (2016) Reaffirmation of AAP Clinical Practice Guideline: The Diagnosis and Management of the Initial Urinary Tract Infection in Febrile Infants and Young Children 2–24 Months of Age. Pediatrics 2016;138:e20163026.
- Mattoo TK, Shaikh N, Nelson CP. Contemporary Management of Urinary Tract Infection in Children. Pediatrics 2021;147:e2020012138.
- Mehta A, Williams V, Parajuli B. Child with Dysuria and/or Hematuria. Indian J Pediatr 2017;84:792–798.
- Shaikh N, Mattoo TK, Keren R, et al. Early Antibiotic Treatment for Pediatric Febrile Urinary Tract Infection and Renal Scarring. JAMA Pediatr 2016;170:848–854.
- Hoberman A, Wald ER, Hickey RW, et al. Oral versus initial intravenous therapy for urinary tract infections in young febrile children. Pediatrics 1999;104:79–86.
- Bingol‑Kologlu M, Ciftci AO, Senocak ME, et al. Xanthogranulomatous pyelonephritis in children: diagnostic and therapeutic aspects. Eur J Pediatr Surg 2002;12:42–48.
- Cheng CH, Tsau YK, Chen SY, Lin TY. Clinical courses of children with acute lobar nephronia correlated with computed tomographic patterns. Pediatr Infect Dis J 2009;28:300–303.
- Chen CY, Kuo HT, Chang YJ, et al. Clinical assessment of children with renal abscesses presenting to the pediatric emergency department. BMC Pediatr 2016;16:189.
- Shaikh N, Hoberman A, Keren R, et al. Recurrent Urinary Tract Infections in Children With Bladder and Bowel Dysfunction. Pediatrics 2016;137:e20152982.
- van Engelenburg‑van Lonkhuyzen ML, Bols EMJ, Bastiaenen CHG, et al. Childhood Bladder and Bowel Dysfunction Questionnaire: Development, Feasibility, and Aspects of Validity and Reliability. J Pediatr Gastroenterol Nutr 2017;64:911–917.
- Tullus K. Vesicoureteric reflux in children. Lancet 2015;385:371–379.
- Zieg J. Vesicoureteric reflux in children: many questions still unanswered. Čas Lék Čes 2016;155:31–34.
- Kategorie: Názor hosta
- Klíčová slova: dysfunkce močového měchýře a střeva; infekce močového traktu ; jizvení ledvin; rekurentní močové infekce; vezikoureterální reflux