Karcinom ledviny a jeho léčba
Souhrn
Renální karcinom (renal cell carcinoma, RCC) je druhým nejčastějším urologickým nádorem. Pacienti s RCC stadií I–III jsou léčeni chirurgicky. Cílem systémové léčby metastazujícího RCC (mRCC) je maximální kontrola nádorové choroby za udržení uspokojivého celkového stavu nemocného. I když se mRCC obecně považuje za nevyléčitelné onemocnění, poslední výsledky ukazují, že u části pacientů dochází k parciální, nebo dokonce kompletní regresi nádorů, která přetrvává bez další léčby. V terapii mRCC se uplatňuje cílená léčba zaměřená na klíčové dráhy angiogeneze a buněčného metabolismu a léčba imunoonkologická, případně kombinace uvedených modalit. Většina pacientů bude léčena sekvenčně několika léky nebo kombinacemi. Zásadním problémem v současné klinické praxi je hledání spolehlivého biomarkeru pro identifikaci správného pacienta pro jednotlivé léčebné možnosti.
Klíčová slova: cílená léčba – imunoterapie – renální karcinom
Úvod
Karcinom ledvin (RCC) tvoří asi 2–3 % všech maligních nádorů v dospělosti. Podle posledních dostupných epidemiologických údajů z roku 2017 je incidence nádoru ledviny v České republice 29,01 a mortalita 10,55 osoby na 100 tisíc obyvatel. Incidence i mortalita jsou v posledních letech stacionární, avšak incidence RCC je z neznámých důvodů u nás nejvyšší na světě.1
Asi u jedné čtvrtiny nemocných jsou metastázy přítomny již v době diagnózy, u dalších 25–30 % je generalizace zjištěna metachronně, tedy až později po radikálním odstranění primárního nádoru.
Nejčastějším histologickým typem RCC je světlobuněčný karcinom (asi 75 % všech případů). V patogenezi sporadických RCC hraje významnou roli snížení exprese nebo funkce von Hippelova–Lindauova (VHL) proteinu způsobené inaktivačními mutacemi nebo hypermetylací jeho promotoru. Dysfunkce VHL se vyskytuje u 83 % všech případů RCC a 88 % případů světlobuněčného RCC. Světlobuněčný RCC je vysoce vaskularizovaný nádor, který invazivně roste a agresivně metastazuje. V důsledku relativně vysoké exprese neoantigenů patří RCC mezi vysoce imunogenní nádory.
Přehled léčby renálního karcinomu
Základem terapie RCC stadií I–III je operace. Pokud je to technicky možné, přednostně by měla být indikována nefron šetřící (parciální) nefrektomie. Otevřené, laparoskopické či robotické operace mají podobné onkologické výsledky. Prognóza pacientů s renálním karcinomem po nefrektomii záleží především na klinickém stadiu onemocnění a na dalších parametrech, jako jsou stupeň diferenciace (grade) nádoru a přítomnost symptomů onemocnění před operací.
Mimo klinické studie se adjuvantní léčba u pacientů s resekovaným nádorem ledviny v současnosti nedoporučuje, a to ani u nemocných s vysokým rizikem. Proběhlo totiž několik velkých studií s cílenými léky typu tyrozinkinázových inhibitorů (TKI), které však nepřinesly jednoznačné výsledky. V největší studii S‑TRAK došlo k oddálení rekurence, ale celkové přežití bylo stejné v rameni s adjuvantně podávaným sunitinibem i bez něj – lék tedy nebyl schopen likvidovat mikrometastázy a přispět k vyléčení. Probíhají další klinické zkoušky, zejména s imunoterapií.
V terapii metastazujícího RCC (mRCC) se uplatňuje cílená léčba zaměřená na klíčové dráhy angiogeneze a buněčného metabolismu a léčba imunoonkologická, případně kombinace uvedených modalit.2
Cílené léky u mRCC inhibují dráhu vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor, VEGF) nebo regulační komplex serin‑threoninové kinázy zodpovídající za metabolickou a proliferační aktivitu buňky mammalian target of rapamycin (mTOR). Z inhibitorů dráhy VEGF jsou v současnosti registrovány tyrozinkinázové inhibitory receptoru VEGF (VEGFR) sunitinib, pazopanib, sorafenib a axitinib, monoklonální protilátka proti VEGF bevacizumab, kabozantinib, multifunkční blokátor VEGFR a dalších receptorů MET a AXL. Registrované inhibitory molekuly mTOR zahrnují everolimus a temsirolimus.
Základem imunoonkologické léčby mRCC jsou léky ze skupiny inhibitorů kontrolních bodů imunity (checkpoint inhibitors, CPI). Úspěchy CPI v onkologii v poslední dekádě jsou nezpochybnitelné. V posledních deseti letech způsobily tyto léky revoluci v léčbě melanomu a podstatně zlepšily prognózu pacientů s metastazujícím renálním karcinomem, plicním karcinomem, kolorektálním karcinomem s mikrosatelitovou instabilitou, nádory sliznic hlavy a krku, trojitě negativním karcinomem prsu, uroteliálními nádory a s některými dalšími malignitami. Mezi inhibitory dráhy membránového proteinu programované buněčné smrti (PD‑1) registrované v léčbě mRCC patří nivolumab, pembrolizumab, atezolizumab a avelumab. Podávají se samostatně, v kombinaci s dalším CPI ipilimumabem (inhibitor receptoru CTLA‑4) nebo nově s inhibitory dráhy VEGF.
Principy protinádorové imunoterapie a její toxicita
Fyziologickou rolí receptorů PD‑1 a CTLA‑4, jejichž inhibitory se v onkologii s úspěchem používají, je limitace imunitní reakce proti cizorodým antigenům tak, aby nedošlo k závažnému poškození orgánů, nebo dokonce celého organismu. Aktivace PD‑1 přispívá k anergii a vyčerpání T lymfocytů, tedy k inhibici jejich dlouhodobé protinádorové aktivity. Tuto aktivitu lze obnovit nebo stimulovat inhibicí interakce mezi receptorem PD‑1 na lymfocytech a jeho ligandem PD‑L1, který se nachází na nádorových buňkách a některých buňkách infiltrujících nádor (například na makrofázích). Tasuku Honjo a James Allison obdrželi za prozkoumání funkce receptoru PD‑1 v roce 2018 Nobelovu cenu za medicínu a fyziologii.
Autoimunitní nežádoucí účinky CPI jsou relativně časté, zejména v případě podávání kombinací imunoonkologických léků, avšak fatální průběh těchto nežádoucích účinků je při správné a včasné léčbě naštěstí vzácný. Navíc je již prokázána souvislost mezi efektem imunoterapie a výskytem autoimunitních nežádoucích účinků. Proto lze usuzovat i na společnou podstatu a neoddělitelnost léčebného a terapeutického účinku a zaměřit úsilí hlavně na dostatečnou edukaci nemocných a připravenost onkologických pracovišť rychle a efektivně v případě nežádoucích účinků zasáhnout.
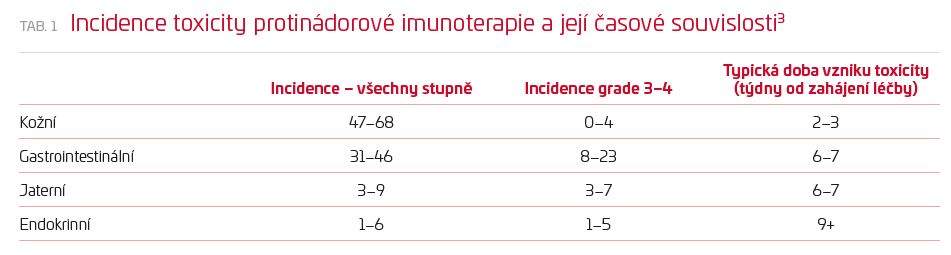
Aktivace imunitního systému a následné autoimunitní poškození mohou postihovat jakýkoliv orgán nebo tkáň, nejčastěji však bývají postiženy kůže, tlusté střevo, játra, plíce a štítná žláza (tab. 1). Zatímco autoimunitní nemoci se obvykle vyvíjejí měsíce až roky s pozvolným zhoršováním příznaků, projevy autoimunity u pacientů léčených CPI jsou velmi akcelerované a rozvíjejí se v průběhu několika dnů.
Optimalizace imunoonkologické léčby mRCC
Cílem systémové léčby mRCC je maximální kontrola nádorové choroby za udržení uspokojivého celkového stavu nemocného. Ač je mRCC považován za nevyléčitelné onemocnění, poslední výsledky ukazují, že u části pacientů dochází k parciální, nebo dokonce kompletní regresi nádorů přetrvávající bez další léčby. Těchto „de facto“ vyléčených pacientů je kolem 2–3 % po léčbě TKI a 10 % po imunoonkologické léčbě CPI.4 Proto je u vybraných nemocných indikována intenzivní terapie imunoonkologickými kombinacemi, která je sice relativně toxická, avšak může vést k úplnému vyléčení pacienta s metastázami.
I když jistě bude ještě nějakou dobu probíhat optimalizace léčebných strategií zaměřených na imunoonkologickou léčbu, již nyní lze definovat některé závěry pro praxi a úkoly pro klinický výzkum nejbližší budoucnosti.
Jednou z možností zlepšení účinku protinádorové imunoterapie je ovlivnění střevního mikrobiomu. V dnešní době je již prokázáno, že efekt imunoterapie u nemocných s metastazujícím melanomem i nežádoucí účinky léčby do jisté míry závisejí na složení střevní flóry. Toto složení by přitom mohlo být celkem jednoduše ovlivnitelné probiotiky, antibiotiky, případě transplantací stolice od pacientů, u nichž imunoonkologická léčba dobře zabírá, možná dokonce i napříč diagnózami.
Dalším důležitým úkolem je hledání a validace biomarkeru, který by umožnil individualizaci léčby – výběr optimálního léku, kombinace nebo sekvence. Celkem logicky byla za takový biomarker považována exprese PD‑L1 na nádorových buňkách, avšak výsledky nejsou jednoznačné, a právě u mRCC tento biomarker nefunguje. Dalším zkoumaným parametrem je kvantita nádorových antigenů, které nádorovou buňku „zviditelní“ pro imunitní systém. Existuje korelace mezi antigenicitou nádoru a počtem nových mutací, tedy parametrem nazvaným mutační nálož (tumour mutation burden, TMB). Ani tento biomarker však není pro predikci odpovědi na imunoonkologickou léčbu mRCC spolehlivý.
V prospektivních studiích se biomarker hledá v molekulách účinkujících ve třech biologických procesech se zásadním významem pro karcinogenezi RCC a nádorovou imunologii: nádorová angiogeneze, preexistující imunita a nádorové mikroprostředí. Účinnost klasických TKI predikuje vysoká angiogenní aktivita. Imunoonkologická léčba je zase účinná u pacientů s dobrou preexistující imunitou (dobrá funkce efektorových T lymfocytů) a s nízkým počtem imunosupresivních myeloidních buněk infiltrujících nádor. Myeloidní zánětlivý infiltrát v nádoru je spojen s vysokou expresí interleukinu 6 (IL‑6), prostaglandinů a skupiny chemokinů CXCL8. Výsledkem je potlačení protinádorové imunity. Blokáda dráhy VEGF do určité míry tuto imunosupresi koriguje, a proto je u těchto nemocných léčbou volby asi kombinace CPI a TKI.5
I když se zdá, že expresní analýza by mohla sloužit jako biomarker v klinické praxi, na validaci si ještě musíme počkat. Navíc u takto rozsáhlé analýzy bude jistě problém s kvantitou a kvalitou vzorku (biopsie) a s nádorovou heterogenitou.
Závěr
Validovaný biomarker pro výběr léčby u mRCC tedy v současnosti nemáme k dispozici. Většina pacientů bude léčena sekvenčně několika z výše uvedených léků nebo jejich kombinacemi. Tyto sekvence nejsou obvykle založeny na důkazech z prospektivních studií, nicméně spíše na názoru expertů. Z veřejného zdravotního pojištění se standardně hradí tři linie léčby. Úhradová omezení pro léčbu mRCC jsou v České republice relativně komplikovaná a v reálné praxi výrazně ovlivňují zvolený léčebný postup.
Podpořeno MZ ČR – RVO Thomayerova nemocnice – TN 0064190.
Literatura
- Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita, (cit 2020‑02‑03). Dostupný z http//www.svod.cz.
- Zhoubný novotvar ledviny (C64). Modrá kniha České onkologické společnosti. 26. aktualizace. Masarykův onkologický ústav, Brno, 2020. Platnost od 1. 3. 2020.
- Weber JS. Practical management of immune‑related adverse events from immune checkpoint protein antibodies for the oncologist. Am Soc Clin Oncol Educ Book 2012:174–177.
- Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal‑Cell Carcinoma. N Engl J Med 2018;378:1277–1290.
- McDermott DF, Huseni MA, Atkins MB, et al. Clinical activity and molecular correlates of response to atezolizumab alone or in combination with bevacizumab versus sunitinib in renal cell carcinoma. Nat Med 2018;24:749–757.
- Kategorie: Názor hosta
- Klíčová slova: cílená léčba; Imunoterapie; karcinom ledvin