Složení těla je asociováno s klinickým osudem pacientů s nedialyzačním chronickým onemocněním ledvin
Lin TY, Peng CH, Hung SC, Tarng DC
Již před řadou let1 byl mezi indexem tělesné hmotnosti (body mass index, BMI) a mortalitou chronicky dialyzovaných pacientů popsán inverzní vztah, který je někdy nazýván paradoxem obezity. Nicméně stále není jasné, zda je to zvýšená svalová hmotnost, nebo naopak objem tělesného tuku, který přináší výhodu přežití. BMI sice silně koreluje s procentem tělesného tuku, ale neodlišuje tuky od netukové hmoty (lean tissue mass). Navíc u pacientů s chronickým onemocněním ledvin (chronic kidney disease, CKD) je vyšší pravděpodobnost, že dojde k retenci tekutin, kterou BMI nedokáže odlišit od prostého zvýšení tělesné hmotnosti na podkladě nárůstu tukové tkáně.2 V důsledku toho neustále sílí snaha o vyvinutí přístroje, který by sofistikovanější metodou odhadl tělesné složení, resp. jeho jednotlivé složky. Významný posun přineslo používání monitoru tělesného složení (body composition monitor, BCM, Fresenius Medical Care, Bad Homburg, Německo).
Metoda BCM je založena na novém využití multifrekvenční bioimpedanční spektroskopie a dnes se běžně používá k posuzování stavu tekutin u pacientů s CKD léčených chronickou dialýzou.3 Přesnost měření tělesného složení pomocí BCM byla ověřena ve srovnání s referenčními standardy pro měření tělesného složení. Metoda BCM je založena na jedinečném tříkompartmenovém modelu, který umožňuje jednak změření podílu tělesného tuku versus netukové hmoty, jednak současně umožňuje rozpoznat i patologickou retenci tekutiny (hyperhydrataci), důležitý prediktor přežití pacientů léčených chronickou hemodialýzou.4 Nicméně u ještě nedialyzovaných pacientů s vyššími stadii CKD existují jen omezené údaje týkající se vztahu tělesného tuku nebo netukové hmoty a klinického osudu pacienta. Navíc výše zmíněný paradox obezity je dobře dokumentovaný pro krátkodobou úmrtnost, ale není jasné, zda tato „ochrana nadváhou“ přetrvává dlouhodobě.
Autoři sdělení se rozhodli prozkoumat souvislost mezi tělesným tukem a netukovou hmotou, parametry změřenými pomocí BCM a složenými výslednými parametry definovanými jako úmrtí ze všech příčin a kardiovaskulární (KV) příhody. V prospektivní kohortě sledovali celkem 326 pacientů (224 mužů a 102 žen, průměrný věk 65,8 ± 13,3 roku), s CKD stadia 3–5, kteří doposud nebyli léčeni dialýzou. Medián odhadované glomerulární filtrace (eGFR) činil 27,2 ml/min/1,73 m2, kdy 44,8 % pacientů mělo CKD stadia 3 (n = 146), 32,8 % CKD stadia 4 (n = 107) a 22,4 % CKD stadia 5 (n = 73). Pokud jde o přidružená onemocnění, 85,3 % pacientů mělo hypertenzi (n = 278), 45,4 % diabetes mellitus (n = 148), 23,6 % kardiovaskulární onemocnění (KVO) (n = 77) a 12,3 % ischemickou chorobu dolních končetin (n = 40). Následně byl vypočítán BMI a provedeno vyšetření BCM, které určilo podíl tukové a netukové hmoty. Pacienti pak byli rozděleni do skupin s vysokým (hodnota nad mediánem) nebo nízkým (hodnoty pod mediánem) indexem BMI, vysokým nebo nízkým indexem netukové tkáně (lean tissue index, LTI) a s vysokým nebo nízkým indexem tukové tkáně (fat tissue index, FTI). Současně byly všem pacientům vyšetřeny některé laboratorní parametry (koncentrace albuminu v séru), zánětlivé markery včetně interleukinu 6 (IL‑6) a tumor nekrotizujícího faktoru α (TNFα) a provedeno vyšetření rychlosti pulsové vlny na předloktí (brachial‑ankle pulse wave velocity, baPWV). Pro pacienty s nižším LTI bylo pravděpodobnější, že budou starší, ženského pohlaví, s vyšší prevalencí KVO. Současně měli významně nižší hodnoty BMI, eGFR a koncentrace albuminu v séru, ale významně vyšší hodnoty FTI, baPWV, IL‑6 i TNFα. Pokud jde o BMI, jeho hodnota silně pozitivně korelovala s hodnotou FTI, slabě pak s hodnotou LTI a nepřímá úměra byla zjištěna mezi LTI a FTI. Dále BMI pozitivně koreloval se systolickým krevním tlakem (STK), triglyceridy, eGFR a negativně koreloval s věkem. Hodnota FTI pozitivně korelovala s STK, triglyceridy a s IL‑6. Hodnota LTI pozitivně korelovala s eGFR, ale byla negativně asociována s věkem, močovým poměrem proteinu a kreatininu (protein‑creatinine ratio, PCR) a s IL‑6.
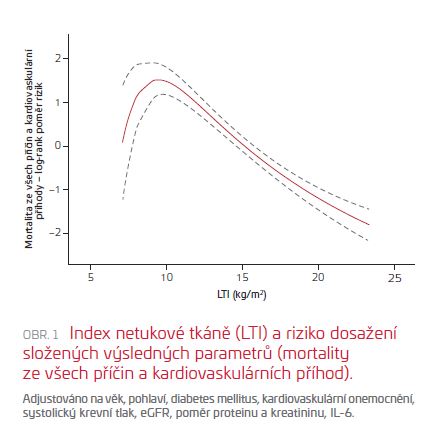
Během následného sledování (medián 4,6 roku) bylo zaznamenáno celkem 40 úmrtí a 68 kardiovaskulárních příhod. Při modelování pomocí Coxova modelu proporcionálních rizik se zjistilo, že vysoký FTI, ale nikoli vysoký BMI či vysoký LTI byl svázán s nižším rizikem dosažení složených výsledných parametrů ať společně, či samostatně. Pokud byli pacienti dále rozvrstveni do čtyř odlišných skupin podle tělesného složení výše definovaného podle LTI a FTI, tak pouze skupina s vysokým LTI a vysokým FTI měla významně nižší riziko dosažení složených výsledných parametrů (hazard ratio 0,36, 95% interval spolehlivosti 0,14–0,87, reference: skupina s nízkým LTI a FTI). Dále vztah mezi LTI a složenými výslednými parametry byl popsán jako reverzní, s křivkou ve tvaru písmene U, přičemž hodnota 9 kg/m2 představovala nejvyšší hodnotu rizika a hodnoty větší než 15 kg/m2 byly spojeny s ochranným účinkem (viz obr. 1).
Autoři studie dospěli k závěru, že v populaci pacientů se středně pokročilým či pokročilým CKD dosud neřešeným dialýzou poskytoval LTI lepší odhad KV rizika než samotný BMI. Dále i současně přítomná vyšší hodnota LTI a vyšší hodnota FTI (ve srovnání se současně nízkou hodnotou LTI a FTI) se jevila jako spojená s nižší mortalitou a nižším výskytem KV příhod těchto pacientů. Pro zlepšení prognózy pacientů s CKD je ovšem třeba určit, jaké je optimální tělesné složení.
Komentář
- prof. MUDr. Ivan Rychlík, CSc., FASN, FERA, I. interní klinika 3. LF UK a FNKV, Praha
Literatura
- Kalantar‑Zadeh K, Kopple JD, Kilpatrick RD, et al. Association of morbid obesity and weight change over time with cardiovascular survival in hemodialysis population. Am J Kidney Dis 2005;46:489–500.
- Hung SC, Kuo KL, Peng CH, et al. Volume overload correlates with cardiovascular risk factors in patients with chronic kidney disease. Kidney Int 2014;85:703–709.
- Wizemann V, Wabel P, Chamney P, et al. The mortality risk of overhydration in haemodialysis patients. Nephrol Dial Transplant 2009;24:1574–1579.
- Zoccali C, Moissl U, Chazot C, et al. Chronic fluid overload and mortality in ESRD. J Am Soc Nephrol 2017;28:2491–2497.
- Kakiya R, Shoji T, Tsujimoto Y, et al. Body fat mass and lean mass as predictors of survival in hemodialysis patients. Kidney Int 2006;70:549–556.
- Marcelli D, Usvyat LA, Kotanko P, et al. Body composition and survival in dialysis patients: results from an international cohort study. Clin J Am Soc Nephrol 2015;10:1192–1200.
- Stenvinkel P, Gillespie I, Trunks J, et al. Inflammation modifies the paradoxical association between body mass index and mortality in hemodialysis patients is modified by inflammation. J Am Soc Nephrol 2016;27:1479–1486.
- Lavie CJ, De Schutter A, Patel DA, et al. Body composition and survival in stable coronary heart disease: impact of lean mass index and body fat in the “obesity paradox.”. J Am Coll Cardiol 2012;60:1374–1380.
- Montano‑Loza AJ, Meza‑Junco J, Prado CM, et al. Muscle wasting is associated with mortality in patients with cirrhosis. Clin Gastroenterol Hepatol 2012;10:166–173.
- Gonzalez MC, Pastore CA, Orlandi SP, et al. Obesity paradox in cancer: new insights provided by body composition. Am J Clin Nutr 2014;99:999–1005.
- Carrero JJ, Johansen KL, Lindholm B, et al. Screening for muscle casting and dysfunction in patients with chronic kidney disease. Kidney Int 2016;90:53–66.
- DeFronzo RA, Tripathy D. Skeletal muscle insulin resistance is the primary defect in type 2 diabetes. Diabetes Care 2009;32(Suppl):S157–S163.
- Heimburger O, Qureshi AR, Blaner WS, et al. Hand‑grip muscle strength, lean body mass, and plasma proteins as markers of nutritional status in patients with chronic renal failure close to start of dialysis therapy. Am J Kidney Dis 2000;36:1213–1225.
- Ruiz JR, Sui X, Lobelo F, et al. Association between muscular strength and mortality in men: prospective cohort study. BMJ 2008;337:a439.
- Isoyama N, Qureshi AR, Avesani CM, et al. Comparative associations of muscle mass and muscle strength with mortality in dialysis patients. Clin J Am Soc Nephrol 2014;9:1720–1728.
- Desir GV. Regulation of blood pressure and cardiovascular function by renalase. Kidney Int 2009;76:366–370.
- Kovesdy CP, Kalantar‑Zadeh K. Why is protein‑energy wasting associated with mortality in chronic kidney disease? Semin Nephrol 2009;29:3–14.
- Androga L, Sharma D, Amodu A, et al. Sarcopenia, obesity and mortality in US adults with or without chronic kidney disease. Kidney Int Rep 2017;2:201–211.
- Kategorie: Komentované články
- Klíčová slova: chronické onemocnění ledvin
Epidemiologické studie jednoznačně prokázaly inverzní vztah mezi obezitou a výslednými parametry (úmrtí a KV příhody) ve velkých amerických, evropských i asijských kohortách dialyzovaných pacientů.1 Nicméně obezita byla v těchto studiích primárně diagnostikována pomocí hodnoty BMI, což může představovat zavádějící údaj, protože BMI neodráží tělesné složení, tj. zejména podíl tukové tkáně na celkové hmotnosti. V principu jde především o zhodnocení podílu tzv. viscerálního tuku, který je považován za prognosticky nepříznivý parametr, na rozdíl od tzv. abdominálního tuku lokalizovaného v podkoží. Nepřímo tuto hodnotu viscerálního tuku reprezentuje podíl tukové tkáně (FTI) a netukové tkáně (LTI), tj. svaloviny, kostní tkáně atd. – v případě, že jsou oba tyto indexy vysoké, předpokládá se, že většina tuku je deponována abdominálně, a nikoli viscerálně. Je přitom logické, že pacienti mají současně vyšší hodnotu BMI, tedy trpí nadváhou či obezitou.
Několik nedávno provedených studií se proto zaměřilo na vyšetření vztahu BMI a koncentrací kreatininu v séru nebo antropometrických měření jako parametrů svalové hmoty s cílem zhodnotit relativní význam tuku, resp. netukové hmoty, pro přežití hemodialyzovaných pacientů. Další metodu ke zhodnocení tělesného složení publikoval Kakiya a spol.5 Na rozdíl od těchto studií, které používaly nepřímé metody k určení tělesného složení, využil denzitometrii (DEXA) k posouzení relativní důležitosti tuku vs. netukové tkáně pro přežití u celkem 808 japonských chronicky hemodialyzovaných pacientů. Konečně nedávno byla publikována velká mezinárodní kohortová studie zahrnující 37 345 hemodialyzovaných pacientů, která ke zhodnocení vlivu optimálního složení těla na přežití použila BCM.6 Výsledky všech výše uvedených studií podpořily důležitou souvislost mezi složením těla, resp. parametrem LTI, a přežitím pacientů léčených chronickou hemodialýzou. Na druhé straně podobné důkazy tohoto vztahu u pacientů s vyšším stadiem CKD, ale ještě nedialyzovaných nebyly dosud k dispozici. Přitom je teoreticky možné, že u obézních pacientů může dojít k výskytu KV příhod v dřívějších fázích CKD, a tudíž tito pacienti mají kratší délku života než neobézní pacienti. Z toho by pak vyplývalo, že pouze ti „nejzdravější“ obézní pacienti přežijí dostatečně dlouho, aby se dožili dialýzy. Tento typ „survival bias“ je více patrný ve spojení s krátkodobým hodnocením výsledných parametrů – pokud existuje výhoda přežití u obézních dialyzovaných pacientů, v dlouhodobém časovém horizontu mohou převažovat škodlivé účinky konvenčních rizikových KV faktorů ve srovnání se všemi „konkurenčními“ rizikovými faktory.1 Příkladem komplikovanosti tohoto tématu může být i práce Stenvinkela a spol.,7 která ukázala, že vyšší hodnota BMI poskytovala ochranný účinek u dialyzovaných pacientů jen při přítomnosti známek zánětu (definovaných jako hodnota C‑reaktivního proteinu > 10 mg/l a/nebo koncentrace albuminu v séru < 35 g/l). Vyšší podíl netukové tělesné hmoty (tedy především svalů) proto může mít specifickou ochrannou úlohu vůči nepříznivým podmínkám typicky spjatým s CKD. Naopak sarkopenie jako nezávislý prediktor nepříznivé prognózy není parametrem platným jen pro populaci pacientů s CKD – podobné výsledky vykazovali i pacienti s ischemickou chorobou srdeční,8 s jaterní cirhózou9 či s nádorovými onemocněními.10
Dosud bylo vyřčeno několik hypotéz ohledně protektivních vlastností netukové hmoty těla. Kostní sval je primárním místem inzulinem zprostředkovaného vychytávání glukózy a slouží jako zdroj aminokyselin pro využití energie u malnutričních pacientů.11 Inzulinová rezistence kostního svalu je dnes považována za primární metabolickou poruchu u pacientů s diabetem 2. typu.12 Zvýšený objem svalové hmoty tedy představuje významný metabolický přínos, který může pozitivně ovlivnit KV prognózu. Další skutečností je fakt, že parametr LTI dobře koreluje se svalovou silou,13 což bylo inverzně a nezávisle asociováno s úmrtností ze všech příčin v řadě testovaných populací, včetně dialyzovaných pacientů.14,15 Lepší zachování svalové hmoty by mohlo přispět k udržení lepšího funkčního stavu nemocného jedince a jeho přežití, mj. se tím snižuje i riziko pádu a zlomenin. Renaláza, nově popsaný hormon ledvin, který moduluje funkci srdce a krevní tlak regulací katecholaminů, je také exprimována v kosterním svalu.16 Deficit renalázy proto může být příčinou zvýšené sympatikotonie, a tím i rizika KVO u pacientů s CKD s přítomnou sarkopenií.
V referované studii bylo zajímavým, dosud nepublikovaným zjištěním, že současná přítomnost jak vysokého indexu LTI, tak vysokého indexu FTI může představovat ono optimální složení těla, které vede k nejnižšímu riziku rozvoje složených výsledných parametrů. Možné mechanismy, které by vysvětlily „přidaný“ ochranný účinek většího objemu abdominální tukové hmoty, zahrnují především vyšší zásoby energie pro zvládnutí katabolického stresu při CKD, ale také zvýšené hodnoty receptorů TNFα, které mohou kompetovat s prozánětlivými cytokiny, a konečně endotoxin‑lipoproteinové interakce.17 Tyto závěry potvrzuje i nedávno publikovaná studie Androga a spol.,18 která ukázala, že nadměrná adipozita mění vztah mezi svalovou hmotou a úmrtností při CKD. Autoři zjistili, že pacienti s eGFR < 60 ml/min/1,73 m2 v kategorii složení těla hodnocení jako „nesarkopeničtí‑obézní“ měli nejnižší riziko úmrtí (po adjustaci na více proměnných), i když se zdálo, že tato ochranná funkce byla oslabena s delším časem sledování.
Závěrem lze konstatovat, že „metabolické“ téma obezity, tělesného složení, abdominální vs. viscerální tukové tkáně a svalové tkáně je jak u pacientů chronicky dialyzovaných, tak u pacientů s vyššími stadii CKD tématem stále aktuálním, které nám v blízké době jistě přinese další zajímavé poznatky.