Akutní poškození ledvin u pacientů s cirhózou: revidovaná mezinárodní doporučení ICA‑AKI
Angeli P, Gines P, Wong F, et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. J Hepatol 2015 Jan 27. pii: S0168‑8278(14)00958‑1. doi: 10.1016/j.jhep.2014.12.029.
Akutní poškození ledvin (acute kidney injury, AKI) jsou mimořádně častá u pacientů s jaterní cirhózou, komplikují 20 % hospitalizací a mají silný prognostický význam. Krátkodobá mortalita této populace je 55–91 %. Náchylnost této populace nemocných k rozvoji AKI vyplývá z hemodynamických abnormalit charakteristických pro cirhózu. Konzultující nefrologové musejí pro stanovení správného klinického postupu vyhodnotit několik podstatných otázek. Jaká je etiologie AKI, zda by měla být zahájena specifická léčba (vazopresor), jakým lékem (terlipressin, midodrin, octreotid, eventuálně noradrenalin), jaká je prognóza, resp. jak postupovat v případě refrakterního či progredujícího AKI (indikace k náhradě funkce ledvin, načasování, metoda), zda může pacient mít prospěch z léčby v podmínkách intenzivní péče apod. Bohužel péče o tuto skupinu pacientů je nezřídka ztížena limitovanými nástroji k přesné identifikaci příčiny AKI a k odhadu vývoje onemocnění. Dvě prestižní gastroenterologická periodika (Gut, Journal of Hepatology) uveřejnila na počátku 2015 „position paper“, ve kterém International Club of Ascites (ICA) představil revidované konsensuální stanovisko pro diagnostiku a léčbu AKI u pacientů s cirhózou. Tento článek je kompilátem nejpodstatnějších částí textu opatřeným komentářem autora se srovnáním stávajících doporučení s původními.
1. Diagnostická kritéria
AKI Stanovení koncentrace kreatininu v séru je u pacientů s cirhózou zatíženo rizikem nadhodnocení skutečné filtrační funkce ledvin. Příčinou je snížená produkce kreatininu, zvýšená tubulární sekrece, zvýšený distribuční objem vedoucí k dilučnímu efektu, interference analytických metod s často zvýšenými koncentracemi sérového bilirubinu. Inovativním prvkem v nových doporučeních je přijetí kritérií Kidney Disease Improving Global Outcomes (KDIGO) pro definici AKI v podobě dynamických změn koncentrace kreatininu v séru (S‑kreat). Původní definice se opírala o dosažení fixní hodnoty S‑kreat 133 μmol/l. Akutní poškození ledvin u cirhózy je nově definováno jako vzestup hodnot S‑kreat o více než 26,5 μmol/l v průběhu 48 hodin nebo vzestup S‑kreat o více než 50 % původní hodnoty. Jako výchozí může být použita sérová hodnota kreatininu z období předchozích tří měsíců. Pokud známa není, lze vycházet z hodnoty v době přijetí do nemocnice. Na rozdíl od doporučení KDIGO nejsou do definice zahrnuta kritéria diurézy. Důvodem je skutečnost, že řada nemocných je oligurických, přesto mají normální filtrační funkci ledvin.
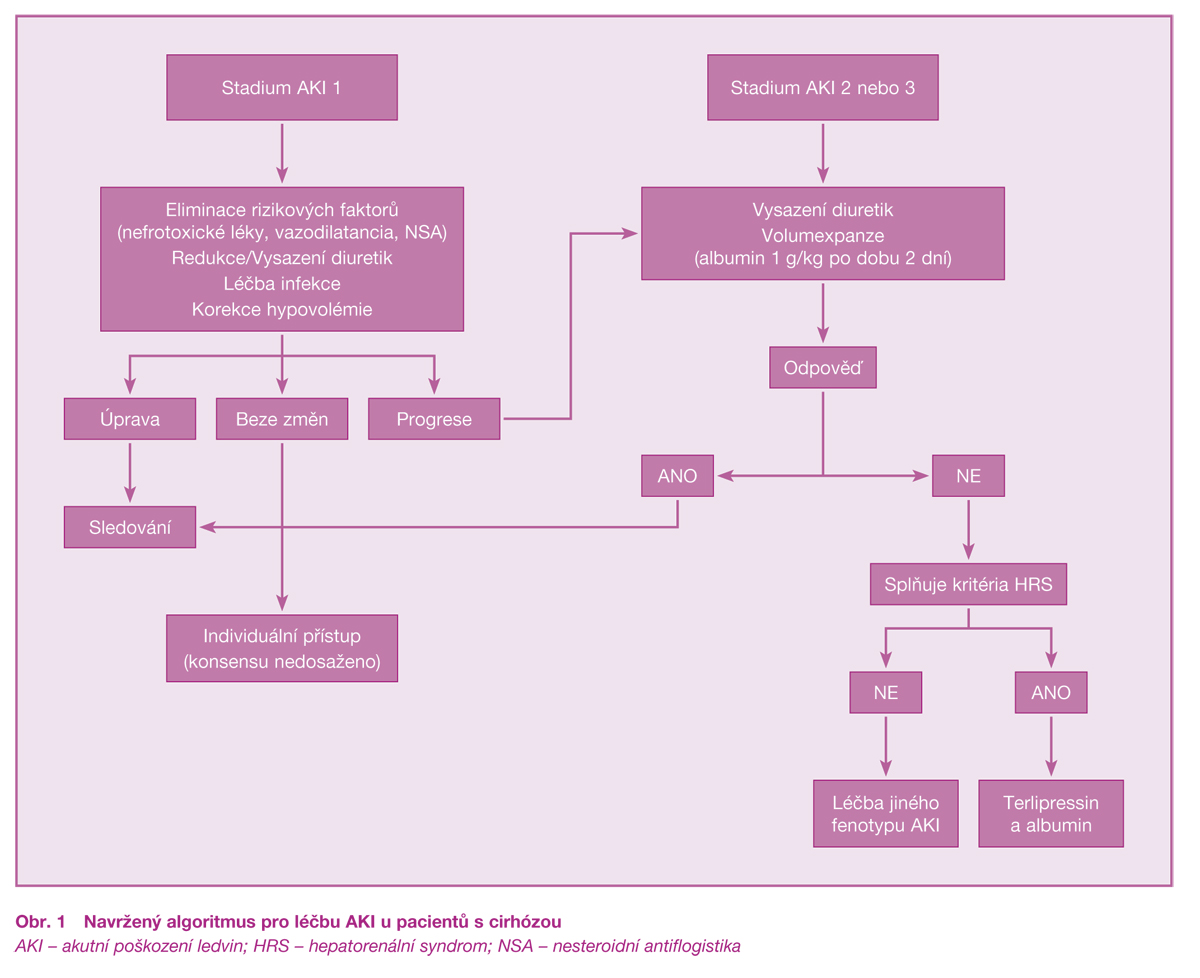
2. Algoritmus přístupu k AKI a jeho léčba
Algoritmus rozlišuje stadia AKI dle definice KDIGO (viz obr. 1). U všech pacientů s cirhózou, ascitem a AKI ve stadiu 1 (viz definice výše) je doporučeno provést co nejdříve následující tři kroky: I) Revize veškeré medikace (včetně volně prodávaných léků), snížení dávky nebo ukončení podávání diuretik, vysazení veškeré nefrotoxické medikace, vazodilatátorů a nesteroidních antiflogistik (NSA). II) Expanze intravaskulární náplně u pacientů s klinickým podezřením na hypovolémii s využitím krystaloidů nebo albuminu nebo krve (posledně jmenovaný přístup u nemocných, kde AKI vzniká na pozadí krevních ztrát, např. do trávicího traktu). III) Promptní rozpoznání a léčba bakteriální infekce. Pacienti, u kterých dochází k progresi AKI navzdory uvedeným opatřením, mají být léčeni jako nemocní, kteří se iniciálně prezentují jako AKI ve stadiu 2 a 3. Léčba zahrnuje vysazení diuretik (pokud nebylo učiněno dříve) a volumexpanzi albuminem (1 g/kg/den po dva dny, maximální dávka 100 g) ke korekci prerenálních příčin. Další postup se řídí příčinou AKI (hepatorenální syndrom – HRS, postrenální AKI, primární renoparenchymové postižení).
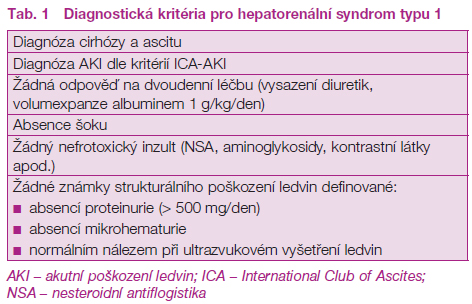
3. Diagnostická kritéria HRS
Přijetí nové definice AKI pro pacienty s cirhózou s sebou přirozeně přineslo i otázku nutnosti revize stávajících diagnostických kritérií pro HRS‑AKI typu 1 (HRS‑1). Dosud platná kritéria se opírala o zdvojnásobení koncentrace S‑kreat na hodnoty překračující 221 μmol/l v průběhu dvou týdnů. Takto nastavená kritéria v teoretické rovině brání časnějšímu zahájení specifické léčby (terlipressin v kombinaci s albuminem), přičemž je známo, že čím vyšší hodnoty S‑kreat, tím horší odpověď na tuto terapii. Nová doporučení proto vyřadila z definice HRS‑1 fixní hraniční hodnotu kreatininu, umožňující časnější a individualizovanou indikaci k vazopresorické léčbě. Ostatní diagnostická kritéria zůstávají beze změny (tabulka 1).
Komentář
- Prof. MUDr. Martin Matějovič, Ph.D., I. interní klinika LF UK a FN Plzeň
- Kategorie: Komentované články
- Klíčová slova: akutní poškození ledvin; guideliny; jaterní cirhóza
Sjednocení definice AKI s využitím mírné modifikace doporučení KDIGO je pro populaci pacientů s cirhózou vítaným krokem. Původně arbitrárně predefinovaná fixní prahová hodnota S‑kreat pro diagnózu AKI (133 μmol/l) je zatížena rizikem opožděné diagnózy, a tím i diagnostických a léčebných opatření. Kromě toho selhává v detekci mírných forem AKI. I studie na pacientech s cirhózou dokumentovaly silnou asociaci mezi 1. stupněm AKI, morbiditou a mortalitou. Samozřejmě, logickým důsledkem adaptace definice KDIGO bude nejen zvýšení senzitivity (pozitivní jev), ale i pokles specificity (negativní jev). Pacienti s cirhózou mohou mít relativně značné fluktuace S‑kreat, především v důsledku tekutinových přesunů, změn ve splanchnické, systémové i renální hemodynamice. Nižší specificita může být tudíž u této populace problematická, vedoucí k nepřiměřeným léčebným opatřením. Jiným důsledkem snížení specificity může časem být nižší mortalita této populace ve srovnání s původními kritérii, mylně interpretovaná jako léčebný úspěch. Příčinou bude nárůst incidence AKI u této populace a detekce lehčích forem s sebou nese pravděpodobnost lepšího průměrného výsledku. V nových doporučeních je ale nutné spatřovat zejména jejich možný přínos. Snížení prahu pro diagnózu AKI by mělo zvýšit bdělost lékařů nad touto křehkou populací nemocných a umožnit včasné přehodnocení přístupu, pojmenování případných precipitujících faktorů a záchyt těžších forem AKI v časném stadiu.
Znalost etiologie AKI u pacientů s cirhózou je dalším zásadním prvkem, který se snaží nová doporučení pojmenovat. Zatímco kombinace vazopresorů s tekutinami je postupem volby u HRS‑1, u čistě prerenálního AKI může léčba vazopresorem průběh AKI zhoršit. Opačně, nepřiměřeně agresivní a pokračující volumexpanze bez včasného použití vazopresorů (terlipressin) při mylně vyhodnoceném „hypovolemickém“ AKI bude rovněž spojena s nepříznivým vývojem (progrese ascitu, nitrobřišní hypertenze, kongesce jater a ledvin, otoky, pleurální výpotky). Zrušení arbitrární hodnoty S‑kreat pro definici HRS‑1 je v tomto ohledu vítaným krokem umožňujícím včasný léčebný zásah (terlipressin, albumin) u nemocných, kteří naplňují ostatní kritéria pro HRS‑1. Pokud pacient naplňuje kritéria pro AKI 2. nebo 3. stupně nebo v průběhu hospitalizace AKI do těchto stadií progreduje i přes úvodní doporučená opatření (viz výše), je v případě naplnění kritérií pro HRS‑1 indikována léčba terlipressinem v kombinaci s albuminem bez ohledu na rigidní hodnotu S‑kreat. Je však nutné upozornit, že časnější indikace k této léčbě zatím nemá oporu v randomizovaných studiích, které v této oblasti chybějí. Obecně lze konstatovat, že jednoduchá forma navržených doporučení je praktická, zlepšuje strukturovaný přístup k nemocnému, a tím snižuje riziko zásadních chyb. Skutečný přínos nových doporučení pro tuto specifickou, ale častou populaci pacientů ukážou až následná prospektivní hodnocení.